槲皮素对心肌缺血后线粒体能量代谢功能的影响Δ
2024-03-04王盼盼杨赞刘冬兰周怡青海大学生态环境工程学院西宁810016
王盼盼,杨赞,刘冬兰,周怡 (青海大学生态环境工程学院,西宁 810016)
心血管疾病是全球范围内造成死亡的主要原因之一,严重影响了人们的生存和生活质量。缺血性心脏病(ischemic heart disease,IHD)在心血管疾病中所占比例较高,是临床上常见病种,其主要临床表现为心肌梗死,近年来IHD的发病率和死亡率呈逐渐上升趋势[1]。正常心肌细胞中,线粒体可通过提供腺苷三磷酸(adenosine triphosphate,ATP)维持心肌细胞活力和功能,而心肌缺血会严重影响线粒体的结构和功能,致使ATP供应不足,从而影响心肌功能[2];阻塞的冠状动脉再灌注还可进一步导致线粒体相关的氧化损伤、细胞死亡和炎症反应[3]。因此,研究心肌缺血后线粒体的能量代谢对于IHD治疗药物的研发至关重要。
药用植物被认为是天然的小分子库和新药发现的重要资源。槲皮素作为天然的植物化合物,在植物界分布广泛,主要存在于苹果、浆果、洋葱、芦笋等水果和蔬菜中,由于其具有强大的抗氧化活性,引起了植物医学和中药研究学者的广泛关注。槲皮素是类黄酮家族成员之一,具有显著的心脏益处,研究表明其可能通过降低血压、抗氧化、干扰肾素-血管紧张素-醛固酮系统和改善内皮依赖性患者的血管功能来改善心血管疾病[4]。基于此,本研究通过构建H9c2心肌细胞缺氧模型和大鼠急性心肌缺血模型探讨了槲皮素对心肌缺血后心肌细胞线粒体代谢功能的影响,以期为治疗IHD提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括CytoFLEX型流式细胞仪(美国Beckman Coulter公司)、XB120A型电子分析天平(瑞士Precisa公司)、ELX800型酶联免疫检测仪(美国Bio-Tek公司)、ECLIPSE Ti-s型荧光倒置显微镜(日本Nikon公司)、TG16-WS型高速台式离心机(长沙湘仪离心机仪器公司)、TDL-50B型低速台式离心机(上海安亭科学仪器有限公司)、MCO-15AC-SC型CO2培养箱(日本Sanyo公司)。
1.2 主要药品与试剂
环孢菌素A(批号C106893,纯度98%)、槲皮素(批号BD105676,纯度99%)均购自河南奥科标准物质科技有限公司;盐酸曲美他嗪(批号22329-76-6,纯度97%)购自上海麦克林生化科技股份有限公司;ATP检测试剂盒(批号ml059183)购自上海酶联生物科技有限公司;磷酸盐缓冲液(批号B040100)购自北京中杉金桥生物技术有限公司;DMEM高糖培养基(批号11995-065)、胎牛血清(批号10099-141)均购自美国Gibco公司;线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(批号40706ES60)购自上海翊圣生物科技有限公司;胰蛋白酶、青霉素-链霉素溶液(100×)、线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)和活性氧(reactive oxygen species,ROS)检测试剂盒(批号分别为C0201、C0222、C2009S、S0033)均购自上海碧云天生物技术股份有限公司;肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号分别为A032-1-1、A020-2-2、A003-1-1)均购自南京建成生物科技有限公司;肌酸激酶同工酶MB(creatine kinase isoenzyme-MB,CK-MB)、大鼠线粒体呼吸链复合物Ⅰ(complex Ⅰ)和complex Ⅳ均购自江苏晶美生物科技有限公司。
1.3 细胞与动物
大鼠H9c2心肌细胞购自中国科学院上海细胞库。48只SPF级的健康SD雄性大鼠购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2019-0028。动物实验根据青海省西宁市实验动物伦理委员会批准的标准进行操作。
2 方法
2.1 细胞实验
2.1.1 H9c2心肌细胞的培养
将H9c2心肌细胞置于含1%青霉素-链霉素双抗和10%胎牛血清的DMEM高糖培养基中,在5% CO2、饱和湿度、37 ℃的条件下培养。
2.1.2 细胞分组、造模与给药
按前期实验结果设置给药剂量。实验分为空白组、模型组、阳性对照组和槲皮素高、中、低剂量组,每组3个复孔。空白组细胞不做任何处理,正常培养2 h;模型组细胞重悬后,接种于24孔板中,待细胞融合度为80%时置于复合成分缓冲液(20 mmol/L 2-脱氧-D-葡萄糖、0.9 mmol/L CaCl2、12 mmol/L KCl、20 mmol/L 羟乙基哌嗪乙硫磺酸、137 mmol/L NaCl、0.5 mmol/L MgCl2,pH 6.2)中,并于含95% N2、0.1% O2、5% CO2、37 ℃的条件下放置1 h诱导缺氧[5];阳性对照组细胞造模前加入1 μmol/L的环孢菌素A预处理1 h,再缺氧处理1 h;槲皮素高、中、低剂量组细胞先用40、20、10 μmol/L的槲皮素预处理1 h,再缺氧处理1 h。结束后,收集各组细胞及其上清液用于后续检测。
2.1.3 H9c2心肌细胞中ROS的检测
使用胰酶消化细胞,将细胞悬液移至离心管中,以1 500 r/min离心5 min,弃上清液,加入DMEM完全培养基,将细胞吹打均匀后计算细胞悬液的密度。将细胞密度达5×104个/mL左右的细胞悬液接种至6孔板中,于37 ℃培养箱中培养。将细胞按照“2.1.2”项下方法分组处理后,使用胰酶消化细胞,加入DMEM完全培养基终止消化,制成细胞悬液,以3 500 r/min离心10 min后收集细胞,使用磷酸盐缓冲液洗涤2次,离心,收集细胞沉淀,每管加入100 μL ROS检测染色液,以37 ℃培养30 min后离心,收集细胞;使用磷酸盐缓冲液洗涤细胞3次,再用200 μL磷酸盐缓冲液重悬细胞,使用流式细胞仪进行ROS荧光强度定量检测。荧光强度值越大,表明细胞中产生的ROS越多。
2.1.4 H9c2心肌细胞MMP的检测
将细胞接种至无菌6孔板中,于37 ℃培养箱中培养。将细胞按照“2.1.2”项下方法分组处理后,用无血清DMEM/F12洗涤3次,常规胰酶消化,收集细胞,加入用二甲基亚砜配制的JC-1(10 µg/mL)探针,在37 ℃恒温孵箱中孵育20 min,再用无血清DMEM/F12洗涤3次,用500 μL无血清DMEM/F12重悬,避光送检,进行流式细胞仪检测。在健康线粒体中,JC-1在基质中发生聚合,形成明显的红色荧光,而受损的线粒体会随着膜电位的降低而丢失,并产生绿色荧光。通过荧光颜色可观察MMP的变化,红/绿色荧光强度比值减小,说明细胞MMP下降。
2.1.5 H9c2心肌细胞MPTP开放程度的检测
按“2.1.3”项下方法处理并收集细胞后,加入200 μL荧光淬灭工作液,混匀,在37 ℃细胞培养箱中培养30 min后,以1 500 r/min离心5 min,收集细胞,使用磷酸盐缓冲液洗涤2次,再用200 μL磷酸盐缓冲液重悬细胞,使用流式细胞仪进行MPTP荧光强度定量检测。绿色荧光越强则说明开放程度越低,绿色荧光越弱则说明开放程度越高。
2.1.6 H9c2心肌细胞上清液中生化指标的检测
按“2.1.3”项下方法处理并收集细胞上清液后,采用双抗体夹心法测定ATP含量,采用硫代巴比妥酸法(TBA法)测定MDA含量,依据酶促反应原理测定LDH含量,采用微量酶标法测定CK含量,具体步骤均按照试剂盒说明书操作。
2.2 动物实验
2.2.1 大鼠分组与造模
按照前期实验结果设置给药剂量。大鼠随机分为假手术组,模型组,槲皮素高、中、低剂量组(100、50、25 mg/kg)和阳性对照组(曲美他嗪6.3 mg/kg),每组8只。大鼠适应性喂养7 d后,按体重每100 g灌胃相应药物1 mL,每天1次,连续7 d。大鼠末次给药2 h后结扎冠状动脉左前降支复制急性心肌缺血模型:麻醉大鼠,固定背部,连接呼吸机辅助呼吸,设置呼吸频率每分钟60次,呼吸比1∶1,潮气量3 mL/kg。大鼠胸部去毛消毒后,沿着心脏方向剪开皮肤,用止血钳分离肌肉,打开肋骨,沿着打开的肋骨使用扩胸器扩宽,找到心脏并剥离心包膜,从左心耳边缘进针、肺动脉圆锥处下1 mm出针进行结扎,使用缝合线快速缝合胸腔和皮肤,并再次消毒,等大鼠恢复自主呼吸后关闭呼吸机电源,放于笼内饲养[6]。
2.2.2 大鼠血清中心肌损伤和抗氧化指标的检测
造模24 h后,从大鼠颈总动脉采集血液,以10 000 r/min离心10 min,收集血清,按试剂盒说明书操作,检测各组大鼠血清中LDH、MDA、CK-MB和SOD的含量。
2.2.3 大鼠血清中线粒体指标的检测
取“2.2.2”项下大鼠血清,按试剂盒说明书操作,检测各组大鼠血清中complex Ⅰ、complex Ⅳ和ATP的含量。
2.3 统计学分析
采用Graph Pad Prism 5.0和SPSS 22.0软件进行统计分析。数据以±s表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 槲皮素对H9c2心肌细胞中ROS的影响
与空白组比较,模型组细胞中ROS荧光强度显著升高(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组细胞中ROS荧光强度均显著降低(P<0.01)。结果见图1和图2。
图1 各组细胞中ROS的流式细胞图

图2 各组细胞中ROS定量检测结果(n=3)
3.2 槲皮素对H9c2心肌细胞MMP的影响
与空白组比较,模型组细胞MMP的红/绿色荧光强度比值显著降低(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组细胞MMP的红/绿色荧光强度比值均显著升高(P<0.01)。结果见图3和图4。

图3 各组细胞MMP的流式细胞图
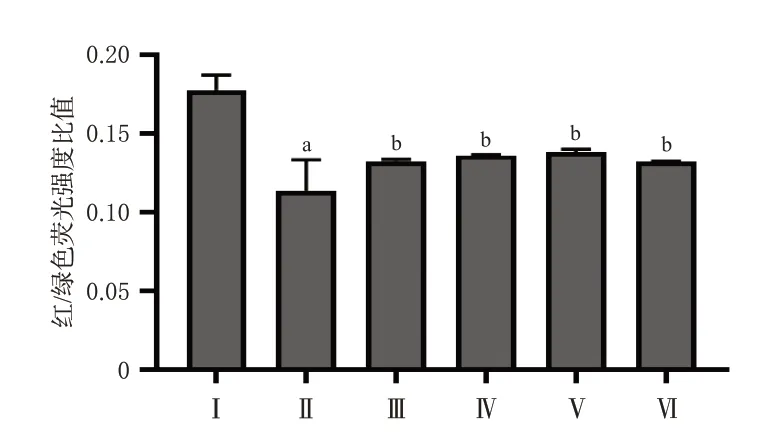
图4 各组细胞MMP定量检测结果(n=3)
3.3 槲皮素对H9c2心肌细胞MPTP开放程度的影响
与空白组比较,模型组细胞MPTP的绿色荧光强度显著降低(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组细胞MPTP的绿色荧光强度均显著升高(P<0.01)。结果见图5和图6。
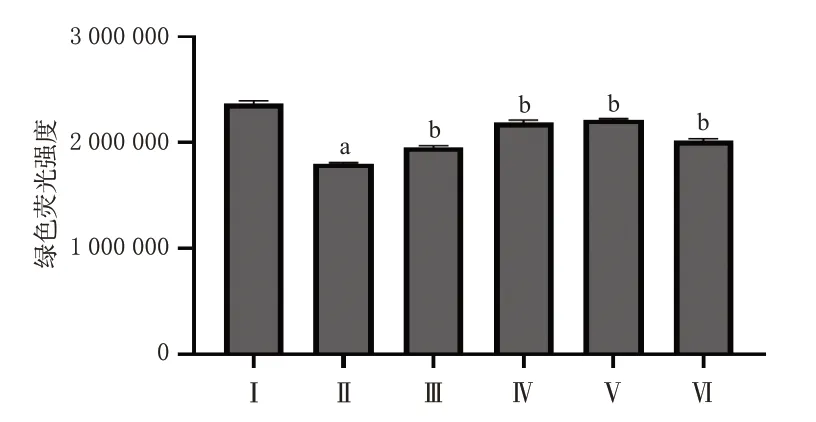
图6 各组细胞MPTP定量检测结果(n=3)
3.4 槲皮素对H9c2心肌细胞上清液中生化指标的影响
与空白组比较,模型组细胞上清液中CK、LDH和MDA含量均显著升高,ATP含量显著降低(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组细胞上清液中CK、LDH和MDA含量均显著降低,ATP含量均显著升高(P<0.01)。结果见表1。
表1 各组细胞上清液中CK、LDH、MDA和ATP含量比较(±s,n=3)

表1 各组细胞上清液中CK、LDH、MDA和ATP含量比较(±s,n=3)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01。
组别空白组模型组槲皮素高剂量组槲皮素中剂量组槲皮素低剂量组阳性对照组CK/(U/mL)0.17±0.06 0.64±0.11a 0.41±0.15b 0.39±0.22b 0.31±0.11b 0.37±0.21b LDH/(U/L)67.89±13.30 265.30±8.49a 83.23±8.36b 87.23±8.44b 80.74±9.89b 96.47±8.67b MDA/(nmol/mL)1.01±0.16 4.99±0.24a 2.79±0.85b 2.38±0.17b 2.19±0.49b 2.50±0.60b ATP/(nmol/L)3 938.00±126.70 668.10±23.00a 3 132.00±13.42b 3 234.00±9.66b 3 348.00±173.40b 3 182.00±87.60b
3.5 槲皮素对大鼠心肌损伤和抗氧化指标的影响
与假手术组比较,模型组大鼠血清中CK-MB、LDH和MDA含量均显著升高,SOD含量显著降低(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组大鼠血清中CK-MB、LDH和MDA含量均显著降低,SOD含量均显著升高(P<0.05或P<0.01)。结果见表2。
表2 大鼠各组大鼠血清中CK-MB、LDH、MDA和SOD含量比较(±s,n=8)
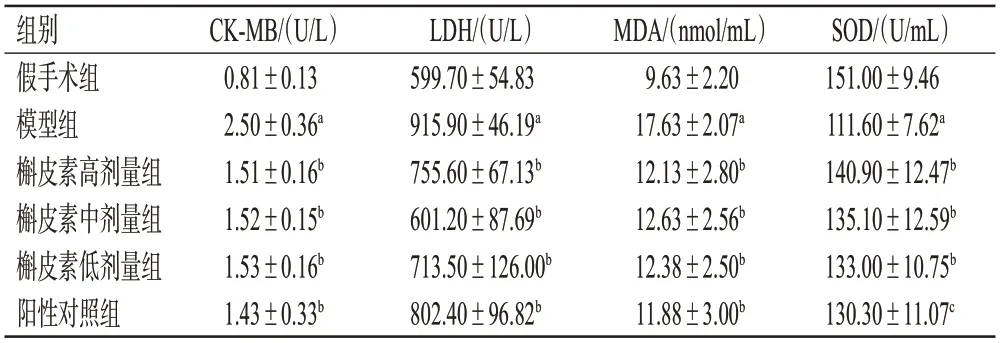
表2 大鼠各组大鼠血清中CK-MB、LDH、MDA和SOD含量比较(±s,n=8)
a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
SOD/(U/mL)151.00±9.46 111.60±7.62a 140.90±12.47b 135.10±12.59b 133.00±10.75b 130.30±11.07c组别假手术组模型组槲皮素高剂量组槲皮素中剂量组槲皮素低剂量组阳性对照组CK-MB/(U/L)0.81±0.13 2.50±0.36a 1.51±0.16b 1.52±0.15b 1.53±0.16b 1.43±0.33b LDH/(U/L)599.70±54.83 915.90±46.19a 755.60±67.13b 601.20±87.69b 713.50±126.00b 802.40±96.82b MDA/(nmol/mL)9.63±2.20 17.63±2.07a 12.13±2.80b 12.63±2.56b 12.38±2.50b 11.88±3.00b
3.6 槲皮素对大鼠血清中线粒体指标的影响
与假手术组比较,模型组大鼠血清中complex Ⅰ、complex Ⅳ和ATP含量均显著降低(P<0.01);与模型组比较,槲皮素高、中、低剂量组和阳性对照组大鼠血清中complex Ⅰ、complex Ⅳ和ATP(阳性对照组除外)含量均显著升高(P<0.05或P<0.01)。结果见图7。

图7 各组大鼠血清中线粒体指标的检测结果(n=8)
4 讨论
槲皮素存在于多种植物中,对心血管系统具有显著的保护作用,可以改善心脏功能、减少心肌肥厚、防止血栓形成、扩张血管、降低血脂等[7]。既往对槲皮素保护心血管系统的研究多集中于心肌缺血再灌注这一领域,而对槲皮素抗心肌缺血以及如何影响线粒体功能方面研究较少。本研究在已有文献的基础上从细胞实验和动物实验两个层面入手,探讨了槲皮素对心肌缺血后线粒体能量代谢的影响,这与开发对线粒体功能具有保护作用的抗心肌缺血药物这一热点相契合,具有一定的创新性。
ROS在许多心血管疾病中起着至关重要的作用。MDA是ROS增加产生的有毒物质之一,同时也是脂质过氧化的终产物,被认为是反映细胞损伤的指标之一。SOD是主要的线粒体抗氧化酶,可以加速ROS的清除,从而避免细胞遭受ROS的损害。MDA能与过量的氧自由基一起攻击细胞膜,从而导致细胞坏死;此外,SOD和MDA在机体内处于动态平衡状态,能够极大限度地控制ROS水平,保持细胞正常功能,因此MDA和SOD常常被用来反映ROS含量,可用于评估氧化应激程度[8]。本研究结果显示,槲皮素高、中、低剂量组细胞中MDA含量和ROS荧光强度均显著低于模型组,槲皮素高、中、低剂量组大鼠血清中MDA含量均显著低于模型组,SOD含量均显著高于模型组,说明槲皮素能较好地清除自由基,降低机体氧化应激损伤。
CK是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶,其主要作用是可逆性地催化肌酸和ATP生成磷酸肌酸和二磷酸腺苷,是评估心脏损伤的一个重要指标。CK-MB是CK的同工酶,其能保持细胞膜的完整性,限制心肌酶的释放,同时对心肌细胞的损伤程度具有高度特异性和敏感性。LDH是无氧糖酵解的终产物,心肌缺血后的无氧呼吸会促使LDH大量产生,故LDH也是心肌损伤的标志酶之一[9-10]。本研究结果显示,槲皮素高、中、低剂量组细胞中LDH和CK含量均显著低于模型组,其中槲皮素高、中剂量可能对细胞的损害较大导致低剂量的效果反而更好;槲皮素高、中、低剂量组大鼠血清中CK-MB和LDH含量均显著低于模型组,说明槲皮素能保持细胞膜的稳定性,减少LDH、CK和CK-MB的漏出,对受损的心肌细胞提供一定的保护作用。
ATP的合成情况可直接反映线粒体功能,缺血会造成线粒体功能严重受损,并导致ATP生成受阻。MPTP是线粒体的活性调节中枢,对于能量代谢的调控十分重要,氧化应激会促使其开放,导致MMP下降,故MMP可快速准确地反映线粒体功能[11-12]。本研究结果显示,与模型组比较,槲皮素高、中、低剂量组细胞中ATP含量均显著升高,MPTP开放程度均显著降低,并升高MMP,说明槲皮素可诱导心肌内源性能量的产生,对心脏起到良好的保护作用。
complex Ⅰ是线粒体电子传递过程的第一个酶,也是氧化应激反应中ROS的主要来源,同时complex Ⅰ的电子传递是细胞中产生能量的重要途径;complex Ⅳ又称细胞色素C氧化酶,处于整个电子传递链的末端,负责将电子从complex Ⅲ上的细胞色素C传递至氧气,生成水,负责细胞的大部分能量生产[13]。本研究结果显示,与模型组比较,槲皮素高、中、低剂量组大鼠血清中的complex Ⅰ、complex Ⅳ和ATP含量均显著升高,说明槲皮素能提高线粒体复合酶的活性,促进ATP的生成。
综上所述,槲皮素能有效减轻心肌缺氧损伤,促进内源性能量的生成,改善心肌缺血后线粒体功能。本研究可为后续发掘更多天然抗心肌缺血药物提供思路。
