精氨酸及其代谢物抑制热应激诱导仔猪支持细胞凋亡的机制
2024-03-01霍元楠邱美佳张姣姣杨炜蓉王鲜忠
霍元楠,邱美佳,张姣姣,杨炜蓉,王鲜忠*
(1.西南大学动物医学院,重庆 400715;2.西华师范大学生态研究所,南充 637009)
公猪支持细胞(sertoli cells,SCs)主要通过为生殖细胞提供生理和营养支持来调节精子发生[1],SCs的数量决定了睾丸的大小和产生精子的能力[2-3]。由于猪阴囊温度普遍低于正常体温2~8 ℃,因此公猪对环境温度变化十分敏感,更容易受到高温影响[4]。有研究发现,热应激导致生精细胞凋亡[5],其凋亡程度取决于热应激的强度和作用时间。凋亡对细胞最直接的影响会使细胞数量减少[6],热应激通过导致SCs凋亡,引起生殖细胞数量减少[7]。研究热应激条件下SCs的凋亡机制对于阐明精子发生的调控机制和提高雄性生殖能力具有重要意义。
精氨酸(arginine,Arg)是一种多功能氨基酸,在细胞凋亡中发挥重要作用。在动物机体内主要以L-精氨酸的方式存在,能提高生长和育肥猪的抗氧化能力,减轻热应激的影响[8],并防止脂多糖(lipopolysaccharide,LPS)诱导的绵羊肠上皮细胞凋亡[9]。一氧化氮(nitric oxide,NO)是由NO合成酶产生的自由基,可催化精氨酸向 L-瓜氨酸的转化[10],精氨酸-一氧化氮(Arg-NO)途径产生的NO在细胞凋亡中具有双重作用[11]。在生理条件下,动物体内合成的精氨酸量不能满足动物机体生长代谢的需要,大多数动物需要从食物中获取Arg[12]。Arg不仅可作为NO前体,还参与腐胺、精胺和亚精胺的生成[13],其中精胺具有抗氧化与抗衰老能力[14],可作为氧自由基清除剂,保护核酸等细胞组分免受氧化损伤,调节细胞死亡过程[15]。但目前尚不清楚精氨酸调节热应激下支持细胞凋亡的机制。外源性精胺通过减少活性氧(reactive oxygen species, ROS)的产生和抑制PERK-eIF2α通路的激活来阻止内质网应激诱导的心肌细胞凋亡[16]。然而,Arg-NO和 Arg-精胺如何调节热应激处理支持细胞的凋亡还需要进一步研究。
本试验以体外培养的仔猪睾丸支持细胞为研究材料,采用试验前期建立的热应激模型,经靶向代谢物测序,筛选出差异氨基酸;通过添加外源性氨基酸,分析外源性氨基酸是否会影响热应激诱导的细胞凋亡。发现热应激降低了支持细胞的精氨酸含量及其相关代谢物,改变了Arg代谢途径,增加了SCs的凋亡率,并进一步探讨了精氨酸和精胺在热应激诱导的支持细胞凋亡中的作用,以便为缓解热应激的不利影响提供新的思路。
1 材料与方法
1.1 材料
1.1.1 试验动物 以来自重庆市北碚区东阳镇某猪饲养场3周龄健康雄性仔猪为研究对象,试验中所有动物程序和方法均经西南大学机构动物护理和使用委员会批准。
1.1.2 试验试剂 DMEM/F12培养基、胎牛血清、新生小牛血清、青链霉素(Gibco公司)。IV型胶原酶、 精氨酸、精胺(Sigma公司)。磷酸盐缓冲液(Phosphate Buffered Saline, PBS)粉末(Biosharp 公司)。苯甲基磺酰氟PMSF、蛋白酶抑制剂(MCE公司)。RIPA裂解液、蛋白预染maker(Thermo Scientific公司)。BCA试剂盒(葆光生物)。山羊抗兔二抗、荧光型二抗、NO检测试剂盒、蛋白上样缓冲液(上海碧云天生物技术公司)。Rabbit Anti-iNOS、Rabbit Anti-ODC、Rabbit Anti-FAS(北京博奥森生物技术公司)。Rabbit Anti-Bcl-2、Rabbit Anti-BAX、Rabbit Anti-ARG1、Rabbit Anti-SSAT1(武汉三鹰生物技术公司)。凋亡检测试剂盒(北京索莱宝科技有限公司)。猪精胺ELISA检测试剂盒(慧嘉生物)。
1.2 方法
1.2.1 睾丸支持细胞的分离培养及纯度鉴定 在无菌条件下采集睾丸组织,然后迅速放入预冷的PBS (按100∶1的比例加入青、链霉素混合物),用封口膜将其封口,放入提前加入冰块的泡沫盒中,在2 h内送至实验室。按照本实验室前期方法进行睾丸支持细胞的分离与纯化。将分离的细胞置于DMEM/F12培养液中,添加10%胎牛血清,在32 ℃,5% CO2下培养48 h,待培养皿底部细胞长满至70%~80%后,用支持细胞特异性的标记蛋白GATA-4进行纯度鉴定,细胞纯度鉴定不低于90%即可用于后续试验[17-18]。
1.2.2 细胞的热处理以及细胞活性检测 纯化后的仔猪睾丸原代细胞培养约24~48 h 后,按照之前实验室建立的热应激模型对细胞进行热处理(44 ℃,30 min),再进行后续试验[19]。使用CellTiter-LμMiTM稳态发光细胞活力测定试剂盒评估细胞活力。将细胞接种于96孔细胞板,每孔加入100 μL CellTiter-LμMiTMSteady发光试剂,振荡2 min促进细胞裂解。室温孵育10 min后使用多功能酶标仪进行化学发光检测,并根据化学发光显示值计算细胞的相对活力,记录试验结果并进行分析。
1.2.3 细胞凋亡检测 使用荧光素异硫氰酸酯(FITC) /PI试剂盒进行凋亡分析[20]。将支持细胞接种于6孔板,于 DMEM/F12培养基中培养24 h, 0.05 mmol·L-1精氨酸处理24 h, PBS洗涤,重悬于结合缓冲液中。将100 μL细胞与5 μL Annexin V-FITC在25 ℃下孵育20 min,得到的混合物加入5 μL PI和400 μL结合缓冲液,用流式细胞仪进行分析。通过NovoExpress1.2.1软件进行数据分析,并将结果进行归一化处理。
1.2.4 细胞的代谢物检测 通过添加精氨酸和热处理后,用0.1 mol·L-1PBS洗涤细胞。用细胞刮刀刮取细胞,将细胞收集于冻干管中。采用超高效液相色谱系统进行分离,质谱分析采用质谱仪在正离子模式下进行。使用Multiquant软件提取色谱峰的峰面积和保留时间,采用氨基酸及其衍生物的代谢物鉴定标准校正保留时间,并计算相应代谢物的浓度。
1.2.5 蛋白表达的检测 使用细胞裂解缓冲液从处理过的细胞中提取总蛋白,并用碧云天BCA蛋白测定试剂盒测定蛋白浓度。采用6%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。BSA封闭液25 ℃封膜2 h,4 ℃结合相应一抗12 h,然后将膜与山羊抗兔或山羊抗小鼠二抗在25℃下孵育2 h,配置显影液后在化学发光成像仪上曝光显影。Quantity One软件定量蛋白条带强度。
1.2.6 RNA 提取及定量 RT-PCR 将支持细胞培养在细胞培养瓶(4×106个·瓶-1)中,在32 ℃的培养箱(含5% CO2)中培养48 h,分别用精氨酸或精胺处理并进行热处理。采用Trizol法提取总RNA。然后使用CFX96TMReal-Time System/C1000 TouchTMThermal Cycler进行qRT-PCR试验。iScriptTM 139 gDNA Clear cDNA Synthesis kit进行反转录,并使用SYBR Green®Master Mix进行1 μg总RNA合成的cDNA进行qRT-PCR。使用2-ΔΔCT方法计算目的基因相对β-actin表达量,本试验所用引物信息见表1。
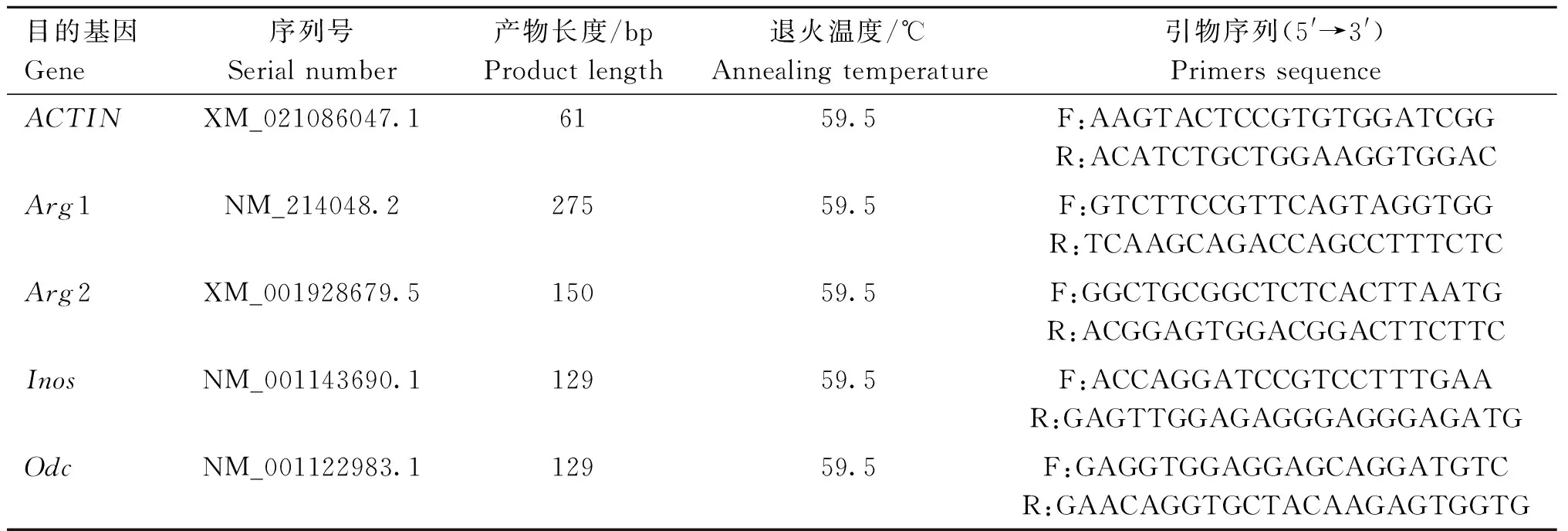
表1 本试验所用引物序列
1.2.7 NO 荧光检测以及精胺的检测 添加精氨酸、精胺和热处理后用0.1 mol·L-1PBS洗涤细胞,然后使用0.25%胰蛋白酶消化细胞2 min, 1 500 r·min-1离心5 min后弃上清。按照DAF-FM DA试剂说明书进行操作,将1 mL悬浮细胞与10 μmol·L-1DAF-FM DA混合,在37 ℃的细胞培养箱中避光孵育20 min。使用流式细胞仪测定每个样品的荧光强度。按照猪精胺酶免疫测定试剂盒的说明书,在给定的标准浓度下形成标准曲线,最后根据450 nm处吸光度值测定试验组精胺浓度。
1.3 统计分析
试验数据使用GraphPad prism7.0软件进行统计分析,两组数据采用非配对样本 Student′st-test进行显著性分析,两组以上采用单因素方差分析,采用Tukey试验多重比较各组间的差异。如果数据不符合正态分析,先进行正弦转化。试验均设有3次独立重复,*为P<0.05表示差异显著,**为P<0.01表示差异极显著。
2 结 果
2.1 热应激对支持细胞活力和凋亡率的影响
与对照组相比,热应激后支持细胞的荧光强度显著降低了42% (P<0.01,图1A)。其次,热应激使支持细胞的凋亡率从3.14%增加到7.36%,增加了134% (P<0.01,图1B)。这表明,热应激增加了支持细胞的凋亡率。

A. 热处理后支持细胞的活性;B. 热处理后支持细胞的凋亡率和凋亡率量化统计。*. P<0.05;**. P<0.01,下同A. The activity of sertoli cells under heat stress; B. Apoptosis rate and quantitative statistics of apoptosis rate of sertoli cells under heat stress. * . P<0.05; **. P<0.01, the same as below
2.2 热处理对精氨酸及精氨酸代谢物的影响
经过热处理后,支持细胞中的精氨酸含量降低了54.9% (P<0.01,图2A)。进一步检测精氨酸的代谢,发现热应激后Inos的mRNA水平升高了60%(P<0.01,图2B),iNOS蛋白水平升高了12% (P<0.01,图2B),NO含量升高了57% (P<0.01,图2C),代谢副产物瓜氨酸含量降低了39.8% (P<0.05,图2 D);代谢产物腐胺和鸟氨酸含量分别提高了103%(P<0.05)和70% (P<0.01,图2D),但精胺含量无显著变化(P>0.05,图2E)。本研究还检测了精氨酸-精胺代谢途径相关酶的mRNA水平,结果发现与对照组相比,热应激后Arg1、Arg2和OdcmRNA水平分别显著升高了2000%(P<0.01)、180%(P<0.01)和10%(P<0.05)(图2F)。上述结果表明,热应激增强了支持细胞中Arg-NO的代谢途径,但对精胺的量无显著影响。
2.3 外源性精氨酸降低热处理后支持细胞的凋亡率
热处理后的精氨酸含量相对于对照组下降了54.9%(P<0.01,图3A)。与单纯热应激组相比,0.05 mmol·L-1外源性精氨酸处理使热应激组支持细胞中精氨酸的含量上升了143%(P<0.01,图3A)。此外,外源精氨酸使热应激条件下支持细胞的凋亡率降低8% (P<0.01,图3B),BAX蛋白水平降低32% (P<0.05,图3C),FAS蛋白水平降低8% (P<0.05,图3C)。以上结果表明,外源精氨酸可减少热应激引起的支持细胞凋亡。
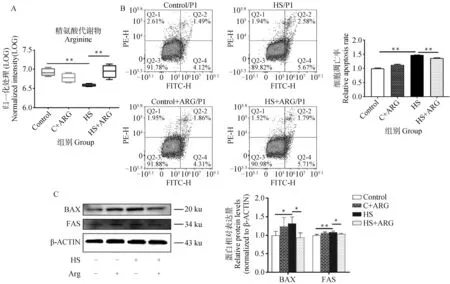
A.精氨酸的变化;B.支持细胞的细胞凋亡率、凋亡量化统计;C.凋亡相关蛋白的表达及量化统计A. Changes in arginine; B. Apoptosis rate and apoptosis quantitative statistics of sertoli cells;C. Expression and quantification of apoptosis-related proteins
2.4 外源性精氨酸改变热应激后支持细胞的精氨酸代谢
与单纯热应激组相比,外源性精氨酸使INOS蛋白水平降低15.3% (P<0.01,图4A),NO含量降低29.5% (P<0.01,图4B),而瓜氨酸水平无显著变化(P>0.05,图4C)。与对照组相比,热应激下,精氨酸-精胺代谢途径中的关键酶ARG1、ODC和SSAT1的蛋白表达显著增加了20.8%、18.3%和400% (P<0.05,图4D)。与热应激相比,外源性精氨酸使ODC升高了41.5%(P<0.01),ARG1下降了23%(P<0.01),但SSAT1升高不显著(P>0.05,图4D),并且鸟氨酸和腐胺含量变化不显著(P>0.05,图4E),而精胺含量提高了10.2% (P<0.01,图4F)。上述结果表明,外源性精氨酸抑制了ARG-NO途径,增强了精氨酸-精胺途径。

A. INOS 蛋白的表达及蛋白量化统计;B.NO 荧光表达及统计;C.瓜氨酸含量统计;D. ARG1、SSAT1、ODC 蛋白的表达及量化统计;E.鸟氨酸代谢物、腐胺代谢物的变化;F.精胺代谢物的变化A. Expression and quantitative statistics of INOS protein; B.NO fluorescence expression and statistics;C.Citrulline content statistics; D. Expression and quantitative statistics of ARG1,SSAT1 and ODC proteins;E. Changes in ornithine metabolites and putrescine metabolites; F. Changes in spermine metabolites
2.5 外源性精胺改变支持细胞的凋亡和NO含量
5 μmol·L-1精胺使热应激条件下支持细胞凋亡率降低53.9% (P<0.01,图5A),BAX蛋白水平显著降低30.9%(P<0.05,图5B),BCL-2蛋白水平升高16.8%(P<0.05,图5B),NO含量降低24.3% (P<0.01,图5C)。这表明外源性精胺可以降低NO含量,从而减弱热应激诱导的细胞凋亡。
3 讨 论
本试验采用质谱多重反应监测(multiple reaction monitoring,MRM)技术分析了正常和热处理条件下支持细胞中氨基酸代谢物的变化。研究数据显示,支持细胞热处理后,精氨酸和精氨酸代谢相关的物质含量发生了显著变化,热应激增强了Arg-NO通路。同时发现,Arg-精胺通路相关酶的mRNA水平明显上升,但精胺含量无显著变化,这表明热应激下精胺作为抗氧化和抗凋亡物质,出现大量消耗,防止细胞的过度凋亡[21]。外源精氨酸或精胺可降低热应激诱导的支持细胞中NO水平和凋亡率。这些结果表明,热应激通过增强Arg-NO途径诱导细胞凋亡,而添加外源精氨酸或精胺加强了精氨酸-精胺通路代谢途径,抑制了Arg-NO途径,从而降低了热处理诱导的支持细胞凋亡。
热应激对动物泌乳[22]、采食量[23]、免疫功能[24]和生殖功能[25]均有显著影响,而这些影响与细胞凋亡密切相关[26]。研究发现,热应激可以诱导各种细胞的凋亡,如小鼠颗粒细胞[27]、小鼠生精细胞[28]、牛肺细胞等[29]。本试验基于前期研究进一步发现,SCs在遭受热处理(44 ℃ 30 min)后,FAS和线粒体依赖性细胞凋亡蛋白表达升高,这暗示热处理后通过内源性途径和外源性途径诱导支持细胞发生凋亡。Xi等[30]发现,热应激(42 ℃ 1 h)可通过调节Bax和Bcl-2的表达水平(内源性途径)使成年公猪睾丸发生凋亡。在本试验中,热应激增加了SCs的凋亡率,这与牛、大鼠和小鼠的42 ℃热处理1 h或41 ℃热处理48 h诱导SCs凋亡的结果相似[31-32]。本试验结果还显示,热应激使精氨酸、瓜氨酸含量降低,并提高了腐胺、鸟氨酸和NO含量。NO对细胞凋亡具有双重作用[33],过量的NO会引起细胞凋亡[34]。本试验发现,热应激诱导SCs中NO含量升高,增强了Arg-NO代谢途径,进而通过线粒体途径和FAS途径诱导睾丸SCs发生凋亡[35-36]。因此,热应激增强Arg-NO代谢途径是导致细胞凋亡率增加的原因。精氨酸可以调控多种细胞的凋亡[37],并且对凋亡的调节作用和抗氧化作用与其代谢密切相关。精氨酸可以通过上调抗氧化酶预防LPS诱导的绵羊上皮细胞凋亡,也可以通过抑制NO的产生上调Bcl-2基因进而对大鼠肝脏缺血再灌注损伤中的坏死和细胞凋亡提供保护,并且抑制精氨酸-NO途径可以减轻热应激诱导的猪上皮细胞凋亡。本试验发现,添加外源精氨酸后,Arg-NO代谢物NO含量下降,细胞凋亡率降低了,这表明精氨酸参与了SCs功能的调控并且可能和细胞中的NO水平下降有关。
鸟氨酸脱羧酶(ODC)和二胺乙酰转移酶1 (SSAT1)是精胺合成[38]和分解代谢的关键酶[39],共同参与多胺代谢的调节[40]。本试验中,热应激后SCs中ODC和SSAT1水平均升高,而精胺的水平没有明显变化,这表明热应激后SCs中精胺的合成和降解速度相当。本试验添加外源精胺不仅降低了热处理组细胞的凋亡率和NO水平,而且还降低了促凋亡蛋白BAX水平,增加了抗凋亡蛋白BCL-2水平,这表明精胺可能通过抑制Arg-NO发挥抗凋亡作用。以上结果表明,抑制 Arg-NO通路,增强精氨酸-精胺途径可能是缓解热应激诱导细胞凋亡的一种有效方式。
4 结 论
热应激条件下通过增强Arg-NO代谢途径诱导支持细胞凋亡。外源精氨酸或精胺可增强精氨酸-精胺代谢途径,抑制Arg-NO途径,减轻热处理诱导的支持细胞凋亡。
