猪卵泡液外泌体处理卵巢颗粒细胞的SNP/Indel筛选分析
2024-03-01刘阳光章会斌文浩宇赵世明丁月云郑先瑞殷宗俊张晓东
刘阳光,章会斌,文浩宇,谢 帆,赵世明,丁月云,郑先瑞,殷宗俊,张晓东
(安徽农业大学动物科技学院,合肥 230036)
转录组测序又被称为RNA-seq,即将生物组织或细胞中全部的RNA(这其中包括了非编码RNA)反转录为cDNA并建立专属的cDNA文库,随后使用高通量测序技术对cDNA文库进行扫描,并将结果映射到生物体参考基因组,通过统计相关的基因Reads,从而获得转录本的具体表达量[1]。SNP(single nucleotide polymorphism)主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列改变,其数量庞大,多态性丰富[2]。从理论上看,每一个SNP位点可以拥有4 种不同的变异形式(转换、颠换、插入或缺失),但实际上发生的只有两种,即转换和颠换[3-5]。由于RNA-seq技术的高灵敏性,这项技术能够发现基因组上的SNP/InDel位点。如,在利用RNA-seq技术对高产和低产庄河大骨鸡的下丘脑和垂体组织的研究中,研究人员发现SNP/InDel纯合子变异体数量高于杂合子变异体数量,且垂体组织中的SNP/InDel数量高于下丘脑组织;在SNP类型中,虽然转换类型的种类少于颠换类型,但转换类型的数量却远远高于颠换[6]。在对高、低产双黄蛋高邮鸭的转录组测序中,在基因外显子区域发现108 206~115 478个SNPs位点,且转换类型总数极显著高于颠换类型总数[7]。
对于雌性动物而言,卵泡发育贯穿了一生,卵泡的质量决定其繁殖能力[8]。一般认为,激素是卵泡发育中的重要调节物质,但近期研究发现在卵泡液微环境中存在着一种微小的物质,可能参与卵巢发育相关的调节机制,这种微小的物质被证明为外泌体[9-12]。
外泌体(exosome)是细胞外囊泡(extracellular vesicles,EVs)的一种类型, 直径在30~150 nm[13]。外泌体首次被发现时,被视为细胞的代谢废弃物[14]。在随后的研究中,研究人员发现外泌体可能在细胞间通讯过程中起到重要作用。在人卵泡液的研究中,卵泡液中的外泌体具有携带供体细胞microRNA和调节受体细胞生理活动的功能[15]。此外,外泌体在动物体内也普遍存在并发挥着相似的作用。在2012年,卵泡液外泌体首次从马的卵泡液中分离[16]。随后,在研究中发现,卵泡液外泌体能够影响GCs中TGF-β/BMP信号通路中的成员,对马发情中期和排卵前的卵泡发育起调节作用[17]。在牛的外泌体研究报道中,卵泡液外泌体可以增强卵母细胞功能并改善温度对卵泡发育造成的负面影响[18]。此外,在猪的生殖研究中,利用蛋白质组学技术对性成熟后备母猪的卵泡液外泌体中的蛋白进行扫描,鉴定出249种关键的蛋白质,通过功能注释发现这些蛋白质与卵泡发育和功能以及排卵和黄体等重要的信号过程相关[19]。虽然当前有关卵泡液外泌体的研究层出不穷,但有关外泌体对受体细胞基因组突变的影响尚未被报道。因此,本研究利用RNA-seq技术对猪卵巢颗粒细胞和与外泌体共培养的猪卵巢颗粒细胞进行高通量测序,得到位于基因的SNP/InDel位点,通过与差异基因比较筛选候选基因,并进行生物信息学分析,探究卵泡液外泌体对颗粒细胞的影响,为揭示外泌体在生殖调控上所发挥的功能提供帮助。
1 材料与方法
1.1 材料
试验所用新鲜猪卵巢采自合肥市某商业屠宰场。猪屠宰后立即采集、分离卵巢,将卵巢保存在含500 IU·mL-1青、链霉素的37 ℃无菌生理盐水中,2 h内用保温瓶运回实验室备用。采用抽提法提取卵泡液,利用梯度离心得到POGCs和卵泡液外泌体。将外泌体溶于PBS溶液中。将纯化后的POGCs接种至细胞培养板,待细胞在培养板内增殖到70%~80%的汇合度时,加入外泌体继续培养24 h。分组情况:猪卵巢颗粒细胞记为GC组(n=3);与外泌体共培养的猪卵巢颗粒细胞记为GCE组(n=3)。
1.2 RNA提取
使用Magzol试剂(Magen,China)从样品中提取总RNA。分别使用K5500(中国北京凯奥)和Agilent 2200 TapeStation(美国安捷伦科技公司)评估RNA的数量和完整性,合格后进行RNA测序。
1.3 RNA测序
基于Illumina平台对构建的文库进行测序,测序长度为150 bp。通过去除带接头的序列(Reads)、低质量序列及无效碱基后得到纯净序列(Clean Reads)用于后续分析。使用HISAT2 2.10用于将干净读数映射到Sus scrofa 11.1参考基因组(http:∥ftp.ensembl.org/pub/release-103/fasta/sus_scrofa/)。并使用TPM(Transcripts Per Kilobase of exon model per Million mapped reads)值来表示基因的表达水平。
1.4 SNP/InDel统计
使用samtools和picard-tool软件对结果进行对比处理,最后对原始结果进行过滤,得到SNP/InDel的分析结果。
1.5 候选基因功能富集分析
使用clusterProfiler R软件包对候选基因进行基因本体(Gene Ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Gens and Genomes,KEGG)通路富集分析,以P<0.05为条件进行差异筛选,并利用ggplot2 R软件包绘制候选基因功能柱状图和气泡图。
1.6 统计分析
利用SPSS 软件(v26.0)对数据进行统计学分析,方差分析和显著性检验使用t-test和 one-way ANOVA,以P<0.05记为差异显著,并在 GraphPad 8.4软件上绘图。
2 结 果
2.1 卵泡液外泌体的鉴定
如图1所示,在透射电子显微镜下观察到外泌体完整的囊泡结构,NTA分析显示外泌体直径范围在100~150 nm,平均直径在150.54 nm。通过Western blot检测外泌体的特异性表面标志物CD9和CD63,在25 ku处有明显条带。这些结果表明已经成功地从猪卵泡液中分离出外泌体。
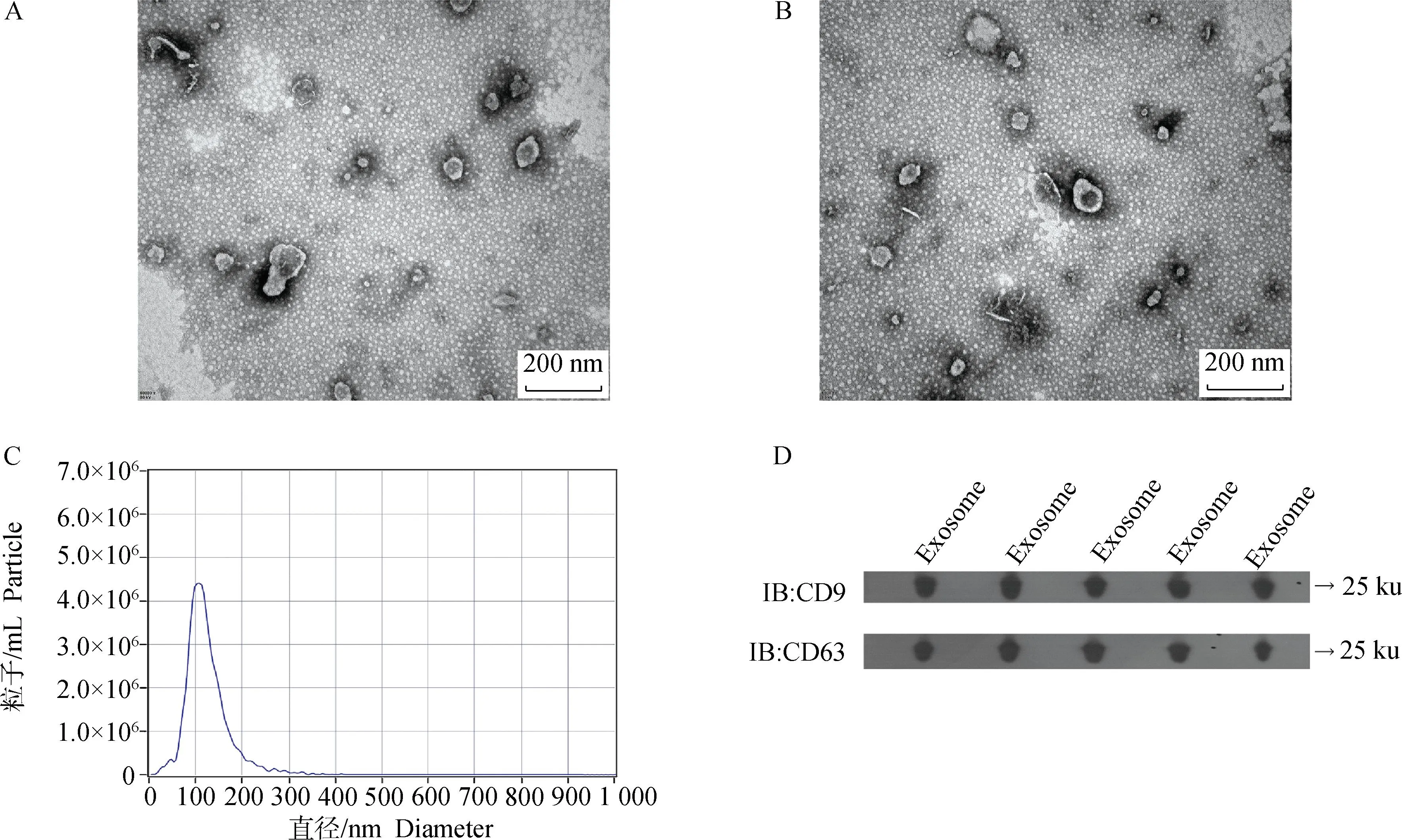
A、B.外泌体电镜结果;C.外泌体NTA结果;D.外泌体Western blot结果A, B.Transmission electron microscopic (TEM) image of exosomes in follicular fluid; C. Nanoparticle tracking analysis showing particle size distribution in exosomes derived from porcine follicular fluid; D.Western blot result of known exosome markers (CD63 and CD9)
2.2 转录组数据
RNA-seq完成后,通过过滤、去除冗余reads。经统计,GC组和GCE组每个样品平均获得5.54×107条clean reads,Q20和Q30质量得分均在92%以上(表1)。该结果表明,本次测序数据质量高,可用于后续分析使用。

表1 样品转录组数据统计表
2.3 SNP/InDel数据统计与分析
利用samtools和picard-tool工具对SNP/InDel数据进行统计,如表2所示,在GC和GCE组的样品共获得1 310 979个SNPs突变和104 498个InDel突变,其中纯合型SNP突变数量为118 831个,纯合型InDel突变数量为51 594个;杂合型SNP突变数量为1 192 148个,杂合型InDel突变数量为52 904个。此外,在与GC组相比较,加入外泌体后,颗粒细胞基因的SNP/InDel数量明显增加。

表2 样本SNP/InDel数量统计表
2.4 SNP突变类型分析
当基因发生SNP突变时,突变位点存在转换和颠换的变化,即A-G、G-A、C-T、T-C、A-T、T-A、C-G、G-C、T-G、G-T、A-C、C-A的12种突变类型。据此对6个样品中突变类型进行统计。如表3所示,在6个样品中SNP转换类型共计973 003个,颠换类型339 974个,转换的类型显著高于颠换类型。此外,通过组间比较发现,在外泌体加入后颗粒细胞的SNP的突变转换和颠换类型均显著高于对照组(P<0.05),结果见图2。

表3 SNP突变类型

*. P<0.05,**. P<0.01
2.5 SNP/InDel突变注释
为了解这些SNP/InDel位点具体在基因上的分布区域,使用SNPPEff工具对6个样品中的SNP和InDel位点进行基因位置注释。如图3所示,SNP突变位点主要来自基因上的8个区域,即3′UTR、5′UTR、基因间隔区、内含子区、外显子区、基因剪切、基因上游区域和基因下游区域。其中3′UTR、基因间隔区、内含子区和外显子区是基因发生SNP突变的主要区域,尤其在内含子区SNP突变数量最多,共有784 205个,其次位于外显子和3′UTR区域,共计187 689和206 060个。

图3 SNPs注释分类Fig.3 SNPs annotation classification
按照上述方法对InDel突变进行注释。如图4所示,InDel突变主要来源于基因上的3′UTR和内含子区。其中位于内含子的InDel突变总计54 375个,位于3′UTR的突变总计为30 105个。另外,还有部分突变位于基因间隔区和外显子。

图4 InDel注释分类Fig.4 InDel annotation classification
2.6 SNP/InDel候选基因筛选
虽测序后获取大量SNP/InDel突变信息,但较多集中在非编码区域。考虑到生物体内基因转录和翻译遵循中心法则,因此,对SNP/InDel突变仅发生在外显子区域的基因进行了统计,并与差异表达的基因进行对比,共获得1 583个候选基因,结果见图5。
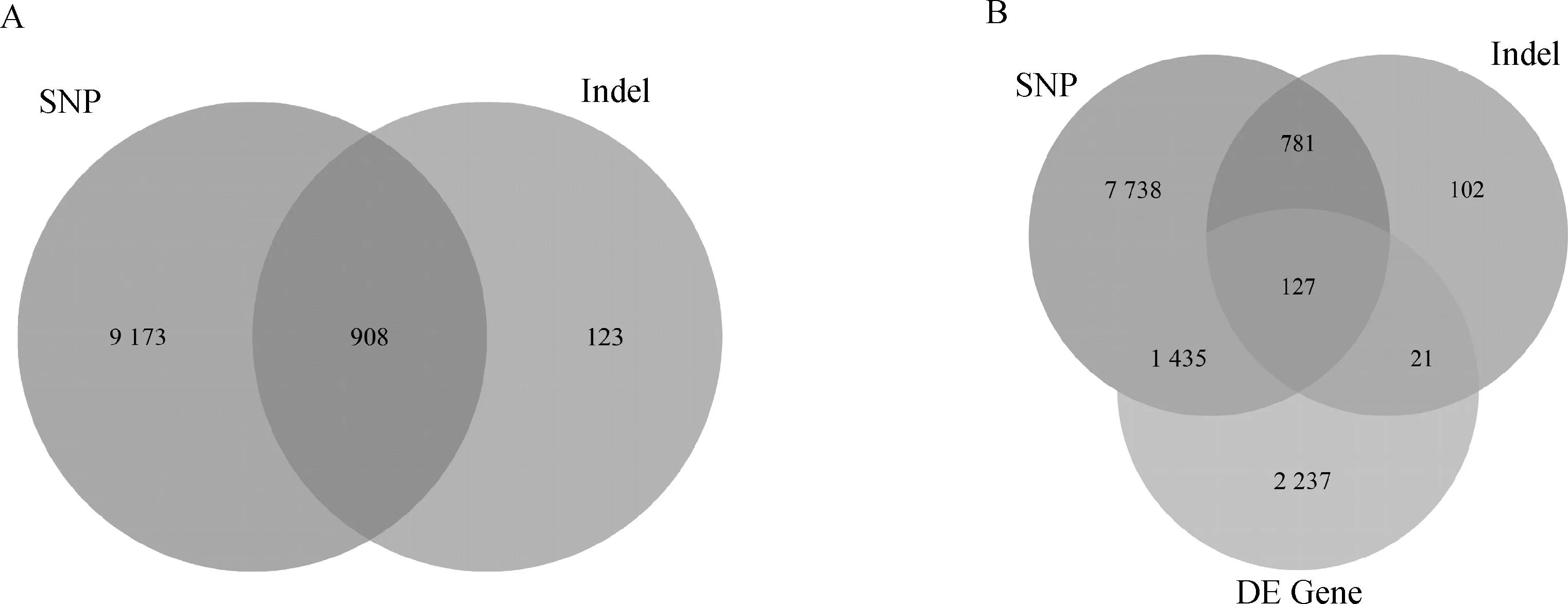
A.SNP和InDel韦恩图; B.突变基因和差异基因维恩图A. Venn diagram of SNP and InDel; B. Venn diagram of mutant and differential genes
2.7 SNP/InDel功能注释
为了解候选基因在外泌体调控中的作用,使用cluster Profiler包在R软件中对1 583个候选基因进行富集分析,并使用ggplot2包对所得结果进行可视化展示。GO功能富集主要从生物过程、分子功能和细胞组成3个方面阐述基因在细胞内的功能。如图6及表4所示,以P<0.05为筛选条件,在生物过程方面候选基因显著富集在细胞周期、细胞分类以及对细胞增殖调控过程中;在细胞组分方面这些基因显著富集在细胞质、细胞核、细胞体中;在分子功能上候选基因显著与ATP、蛋白激酶以及钙离子结合相关。此外,利用KEGG基因库对所筛选的基因进行通路富集,结果见图7及表5,以P<0.05为筛选条件,结果显示候选基因主要在细胞周期以及细胞增殖/凋亡相关通路显著富集。例如,细胞周期、Rap1信号通路、TNF 信号通路、细胞衰老和FoxO信号通路。
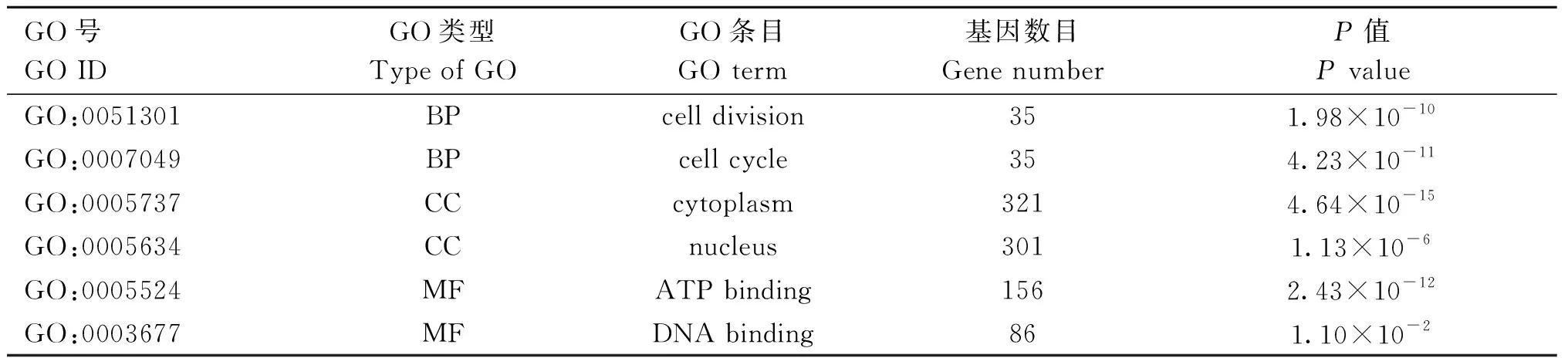
表4 突变基因GO富集条目

表5 突变基因KEGG富集条目
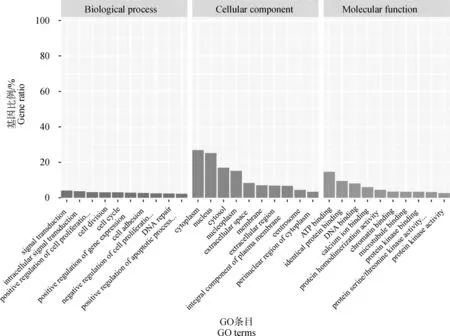
图6 候选基因GO富集分析Fig.6 GO enrichment analysis of candidate genes
2.8 突变基因PPI网络
对KEGG和GO富集的结果进行统计,共发现14个基因被多次富集到细胞周期、增殖/凋亡相关通路。利用STRING软件对14个基因进行互作关系验证,发现11个基因存在互作关系,如图8所示。
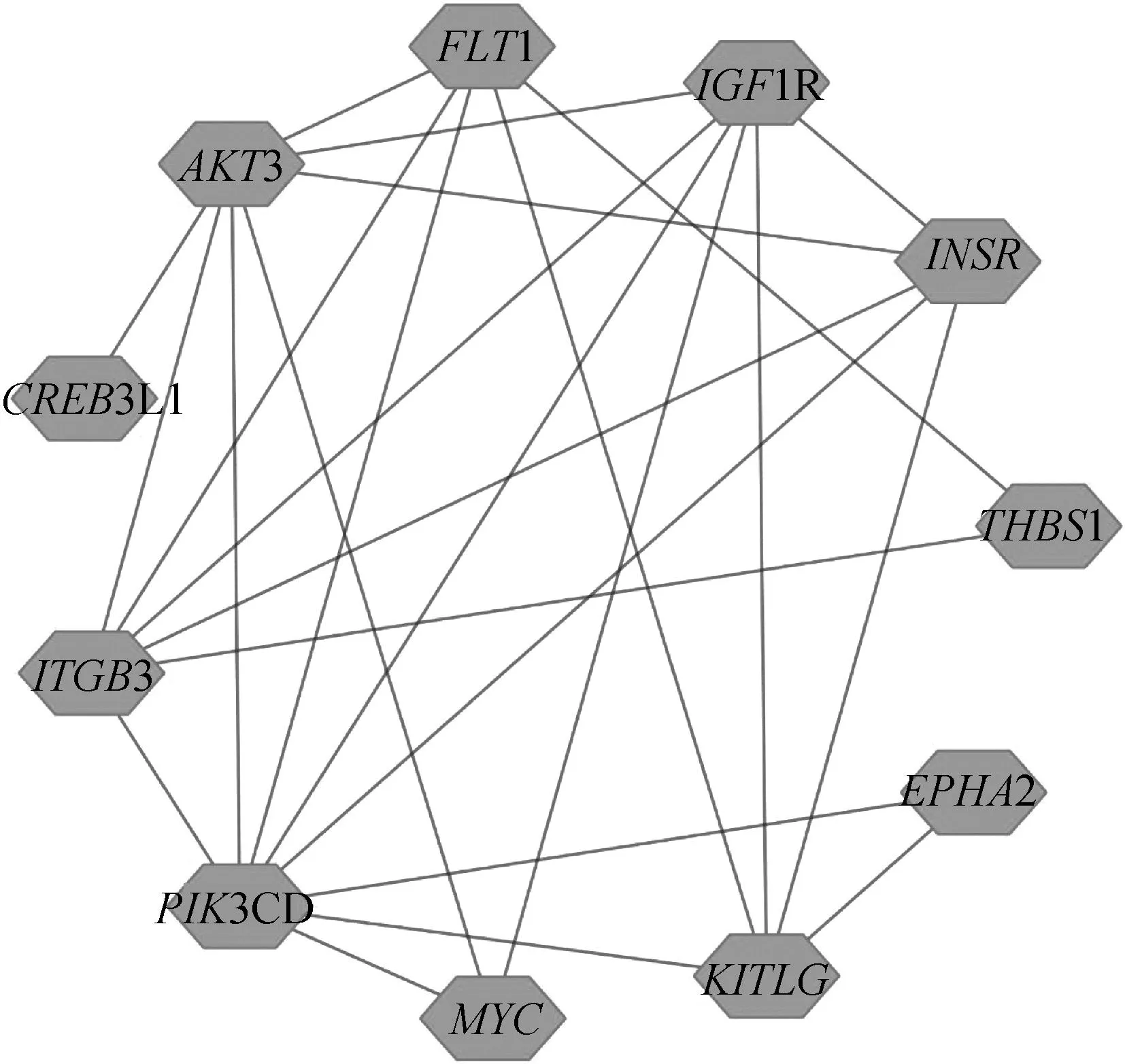
图8 突变基因PPI网络图Fig.8 PPI network of mutant genes
3 讨 论
生物体内遗传信息的传递遵循着中心法则,信使RNA(mRNA)的存在搭建起了DNA与蛋白质之间的沟通桥梁[20-23],以第二代高通量测序技术为基础的RNA-seq是一种无需探针,高效且快速的基因组筛查方法[24]。利用RNA-seq技术,可以将机体内大量的基因信息以数字的形式进行展示,结合生物信息学技术可获取大量遗传数据,为深入研究生物体基因结构和功能提供了基础[25-27]。目前,RNA-seq技术发展迅速,已被广泛应用于基因转录本水平检测、基因转录本结构变异挖掘、基因表观遗传功能研究以及SNP标记开发等方面。
本研究通过RNA-seq技术在GC和GCE组的6个样品中共获得1 310 979个SNPs突变和104 498个InDel突变,其中纯合型突变数量为170 426个,杂合型突变数量为1 245 052个。可见,以SNP突变为主的基因突变发生率较高。相似的结果在前人的研究中也有被发现,如,在120日龄隐性白羽洛克鸡的转录组测序的研究中,发现SNPs 位点103 926个,可变剪接位点29 525个[28]。利用转录组技术在快长与慢长草鱼的肝脏、肌肉和脑组织中共筛选出4 580个SNPs标记,并发现4个与生长性状相关的SNP标记分别位于生长催乳素α基因、早期生长反应蛋白-1基因和肌球蛋白重链基因上[29]。此外,二者所挖掘的基因突变中均为SNP突变类型较多。另外,本研究发现外泌体所造成的受体细胞基因突变类型中,转换类型突变显著高于颠换类型突变。可见,当基因出现SNP突变时,碱基转换类型的发生频率较高。如,在东风螺的研究中,研究人员利用转录组技术共扫描到673 782个 SNPs 位点,且转换位点发生的频率远高于颠换位点[30]。在中华鳖的SNP特征分析研究中, 前人发现SNP变异类型以转换类型为主,转换类型占70.05%,颠换类型占29.95%[31]。此外,利用转录组技术对开产前和产蛋高峰期泰州鹅卵巢进行测序,在1 734个差异表达基因上共检测出73 776~80 478个SNPs位点,这些位点多数分布在内含子区域,且A-G和C-T的转换类型突变发生频率最高[32]。
卵泡液外泌体在卵泡微环境中起着信号传导的作用,能够通过影响颗粒细胞的生理状态,调控卵泡发育进程。为了进一步了解卵泡液外泌体对颗粒细胞基因功能的影响,本研究对突变出现在外显子区域的基因进行了统计筛选,并对所筛选的基因进行了GO和KEGG功能富集。GO富集的结果显示,这些突变基因显著富集在细胞周期、细胞增殖调控、ATP结合、蛋白激酶以及钙离子结合等GO条目;在KEGG功能富集上,突变基因主要在细胞周期以及细胞增殖/凋亡相关通路显著富集,例如,细胞周期、Rap1信号通路和FoxO信号通路。这与前人的研究结果类似,如在卵泡液外泌体处理后的颗粒细胞,相较于对照组,其差异基因主要富集在细胞周期和细胞增殖调控相关的GO条目和KEGG通路上[33]。本研究还发现了11个具有互作关系的候选基因,分别为FLT1、AKT3、CREB3L1、ITGB3、PIK3CD、MYC、KITLG、EPHA2、THBS1、INSR、IGF1R。其中,AKT3是丝氨酸/苏氨酸蛋白激酶家族成员,参与多种生物过程,包括细胞增殖、分化、凋亡[34],前人发现卵泡液外泌体能够通过调节PTEN表达,介导PI3K/Akt/mTOR途径,促进颗粒细胞增殖[35]。IGF1R具有酪氨酸激酶活性。它在大多数恶性组织中高度过表达,通过增强细胞存活作为抗凋亡剂发挥作用[36]。据此推测,卵泡外泌体能够使细胞周期调控相关的基因发生突变,从而调节卵巢颗粒细胞的生理状态,影响卵泡发育过程。这些发现为研究外泌体介导的机制提供了理论帮助,对后续研究外泌体影响细胞的机制具有指导意义。
4 结 论
本试验通过对猪卵巢颗粒细胞,与外泌体共培养的颗粒细胞进行RNA-seq。共发现1 310 979个SNPs突变和104 498个InDel突变,其中纯合型突变数量为170 426个,杂合型突变数量为1 245 052个。另外,在本研究中发现SNP/InDel的转换类型突变显著高于颠换类型突变。通过GO和KEGG功能富集发现这些突变基因与细胞周期和细胞增殖调控过程中显著相关。此外,发现14个与细胞周期、增殖/凋亡调控相关的候选基因,其中11个基因存在互作关系。这些发现为研究外泌体在母猪生殖上的调控提供了理论依据。
