保留十二指肠胰头全切除术11例临床分析
2024-03-01孙浦徐寅凯何骏崔世鹏赵华
孙浦,徐寅凯,何骏,崔世鹏,赵华
苏州大学附属第一医院 普外科,江苏 苏州 215000
胰十二指肠切除术(pancreatoduodenectomy,PD)是治疗胰头部病变的标准术式,切除范围包括胰头、十二指肠、部分胃、胆总管远端及胆囊管,对患者的消化道功能造成了不可忽视的影响。自1972 年Beger等[1]提出保留十二指肠的胰头部分切除术(duodenum-preserving pancreatic head resection,DPPHR)这一术式以来,DPPHR已成为国内外治疗胰头部良性病变与低度恶性病变的常用手术方式之一,因为DPPHR减少了手术创伤,保留了消化道生理功能,提高了患者的生存质量。保留十二指肠胰头全切除术(duodenum-preserving total pancreatic head resection,DPPHRt)由DPPHR发展而来,能更完整地切除胰头,减少术后胰瘘和肿瘤复发的风险。本研究回顾分析2021年7月至2023年5月苏州大学附属第一医院成功施行的保留十二指肠胰头全切除术共11例,现报道如下。
1 资料和方法
1.1 一般资料
本组共11 例,其中男7 例,女4 例,平均年龄55.6(36~77)岁。疾病类型:慢性肿块型胰腺炎2例(1 例伴胰管结石),慢性胰腺炎1 例(车祸外伤所致),胰腺神经内分泌肿瘤1 例,胰头导管内乳头状瘤(intraductal papillary mucinous neoplasm,IPMN)5例,胰腺浆液性囊腺瘤1例,胰头黏液性囊肿1例。临床症状各不相同,慢性肿块型胰腺炎主要表现为反复发作的上腹部疼痛伴腹泻及体重减轻,胰头部IPMN表现为上腹部疼痛不适反复发作。术前患者肿瘤指标均无异常增高,其他相关实验室检查未见手术禁忌。腹部增强CT和MRI检查明确肿瘤位置位于胰头及胰颈部。胰瘘的诊断依据采用国际胰腺外科研究组(ISGPS)于2016年修订的胰瘘定义标准[2]。
1.2 手术方法
全麻下取中上腹正中绕脐切口,逐层进腹,打开Kocher切口及胃结肠韧带进一步探查,确认病变组织可切除后打开小网膜孔,悬吊胃体部。于胰头前方游离横结肠系膜,打开胰腺下缘,游离显露肠系膜上静脉(superior mesenteric vein,SMV),于根部离断胃结肠干,于SMV前方探查胰腺后缘顺利后,紧贴SMV纵向钝性分离胰腺颈部,建立隧道通过顺利。于胰头前方表面分别结扎胃网膜右动脉及胃十二指肠动脉(gastroduodental artery,GDA)分支血管,根部予以缝扎加强。在胰颈部后方SMV右侧电刀离断胰腺,显露主胰管,于近端胰管内置入支撑管。将胰头向右侧掀起,离断SMV至胰头分支后,于其后方自下而上离断钩突系膜。解剖胰头处十二指肠供血血管,在远侧用超声刀自上而下逐步离断胰头,注意保留胰十二指肠前后血管弓,离断过程中注意避免损伤胆管,适当显露胆总管前方及左侧,避免胆总管缺血狭窄(见图1)。在离断胰腺实质并显露胆总管下段左侧壁后,继续向下方游离胰头,可靠结扎近断端主、副胰管,注意保留胆总管,必要时可切开胆总管置入胆道探条引导(见图2)。完整切除胰头后,送术中快速冷冻切片检查,创面仔细止血,快速病理结果提示胰头肿块为非恶性后,距屈氏韧带约25 cm处裁剪网膜后离断小肠,将远端小肠经结肠后提至远端胰腺断面,行胰腺-空肠Rouxen-Y吻合。吻合口缝合满意,腹腔内严密止血,生理盐水冲洗腹腔后吸净,查无明显渗血后分别于胰肠吻合口上、下方各置引流管一根,清点器械纱布无误后逐层关腹。术后均常规给予抗生素3~5 d抗感染和生长抑素7~8 d抑制胰酶分泌治疗,术后第1、3、5 天检测腹腔引流液淀粉酶,第7 天复查腹盆腔增强CT。术后前3 d禁食,并予充分补液支持,3 d后流质饮食,5~7 d后半流质饮食,出现术后胃排空延迟的患者置入空肠营养管予肠内营养支持治疗。

图1 术中切除胰头(A,十二指肠;B,肠系膜上静脉;C,胆总管)
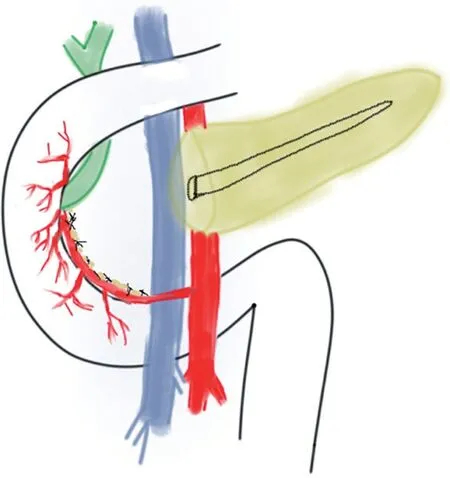
图2 保留十二指肠胰头全切除示意图
1.3 随访方法
采用电话、门诊或互联网等方式随访,了解患者有无疾病复发、内外分泌功能减退、胃排空延迟、胆管狭窄等并发症发生。随访截止时间2023年7月。
2 结果
手术过程顺利,无围手术期死亡,无二次手术。平均手术时间249(165~390)min,平均术中出血量187(50~500)mL,平均术后住院时间27.6(12~55)d。术后共有3 例出现胰瘘,均为B级,经保守治疗后治愈。胆瘘3 例,胆总管狭窄3 例(见图3),其中2 例为胆瘘合并胆总管狭窄。1 例胆瘘患者经PTCD穿刺引流、保守治疗后痊愈,2例胆瘘合并胆总管狭窄患者均行ERCP置入胆管支架+ENBD引流胆汁保守治疗后痊愈;另1 例胆总管狭窄患者亦经ERCP置入胆管支架后痊愈。术后第20 天腹腔出血1 例,根据《胰腺术后外科常见并发症诊治及预防的专家共识(2017)》[3],该例为B级,腹腔动脉造影后考虑出血来源于GDA分支血管,经DSA介入栓塞止血后痊愈。术后腹腔感染1 例,给予腹腔充分冲洗引流、抗生素抗感染后痊愈。胃排空延迟2例,予置入空肠营养管后输入肠内营养对症治疗后均痊愈。所有病例术后均获得随访,随访时间为2 个月至2年,均无复发、内外分泌功能减退、胃排空延迟等远期并发症发生,无死亡病例。DPPHRt患者临床资料总结见表1。
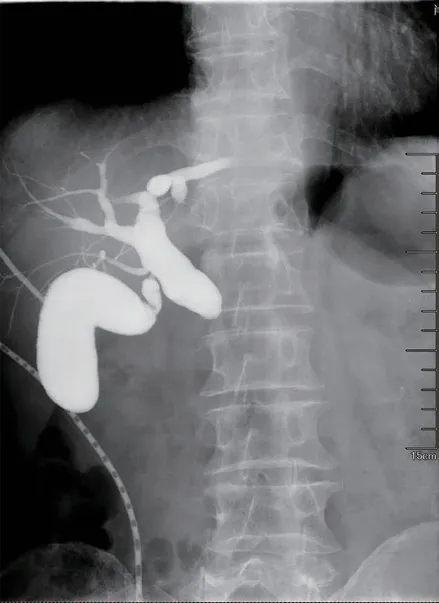
图3 病例3 术后胆总管下端狭窄

表1 DPPHRt患者临床资料
3 讨论
3.1 DPPHRt的起源和适应证
1972 年Beger及其团队提出了保留十二指肠的胰头切除术,即Beger术[1]。作为DPPHRt的起源,该术式最初用于治疗胰头肿块型慢性胰腺炎。胰腺和十二指肠之间的神经和激素反馈机制对调节胰腺内外分泌很重要[4],相比于胰十二指肠切除术,Beger术能改善患者的中远期预后,包括缩短住院时间、提升生活质量以及保存内、外分泌功能[5-7]。Frey等[8-9]于1987年在Beger术基础上改进,提出Frey术,该术式不需要横切胰头,可减少术中对肠系膜上静脉和门静脉的损伤。Gloor等[10]在2001年对Frey术和Beger术改良,提出了Berne术,同Frey术一样,保留背侧部分胰腺组织,不横切胰头,无需分离门静脉,也不纵行切开胰腺,减少了胰腺空肠吻合口的面积。Beger术、Frey术和Berne术这三种术式的预后并无显著差异,都可选择[11-13]。
从胰头切除的范围上来说,Beger术、Frey术和Berne术残留的胰头组织较多,这些残留组织可能与胰瘘、胆瘘、胆管狭窄等并发症有关,并且残留胰头组织可能增加疾病复发甚至癌变的风险。1990年Imaizumi等[14]提出保留十二指肠的全胰头切除术(DPTPHR),1994年Takada等[15]提出可以不进行Kocher游离,完全切除从门静脉前方至十二指肠附着部的胰头组织。王槐志教授[16]提出了保留胆总管、十二指肠、Oddi括约肌的胰头整块全切除术,在胰头全切除后行胰管-空肠黏膜对黏膜吻合。这些术式在治疗胰头良性或低度恶性肿瘤方面更有优势,因为胰头的切除更充分,减少了残留胰头组织肿瘤复发的风险[17-19]。总的来说,DPPHRt适用于:(1)慢性胰腺炎反复腹痛影响生活质量,经内科治疗无缓解者;(2)慢性胰腺炎引起门静脉或肠系膜上静脉压迫、十二指肠狭窄者;(3)胰头良性病变、交界性肿瘤、低度恶性肿瘤,如黏液性囊腺瘤、浆液性囊腺瘤、导管内乳头状黏液瘤、神经内分泌肿瘤及实性假乳头状瘤等。需要注意的是,肿瘤性质、大小、位置和侵及范围对手术方式的选择起到近乎决定性的作用。对于高度怀疑恶性、肿瘤体积大、侵及范围广、术中快速病理提示恶性者应果断行PD或其他根治性手术。对于肿瘤体积较小(直径<2 cm)、位置表浅、包膜完整且与周围组织界限清楚、距离主胰管尚有一定距离(>3 mm)者可选择行局部剜除手术;对于位于胰腺颈体部、肿瘤体积较大(直径2~5 cm)、距离主胰管较近(<2 mm)、合并周围组织侵犯者可行胰腺中段切除术[20-22]。
3.2 三种DPPHRt术式的比较
随着腔镜技术和机器人辅助腔镜技术的愈加成熟,腹腔镜下保留十二指肠胰头全切除术(laparoscopic duodenum-preserving total pancreatic head resection,LDPPHRt)和机器人辅助下保留十二指肠胰头全切除术(robot-assisted duodenumpreserving total pancreatic head resection,RADPPHRt)在越来越多的临床中心开展[23]。笔者认为开腹DPPHRt和LDPPHRt各有优势,开腹手术的优势体现在:(1)术中可凭借触觉更好把握胰腺质地、肿瘤位置和胰十二指肠前后血管弓的走行,有利于尽可能地保留胆总管和十二指肠的血供;(2)开腹手术下的操作如缝合打结、分离胆总管、分离血管等更为直接便利。腹腔镜手术的优势在于:(1)皮肤切口小,更美观,腹壁切口疝的发生率较低;(2)视野清晰,3D腹腔镜和机器人辅助腹腔镜的立体视觉有助于精细操作;(3)腹腔镜结合吲哚菁绿荧光显像技术可于术中显露胆总管、辨别是否出现胆汁溢出,有利于减少术后胆瘘的发生[24]。虽然现在国内外只有少数中心开展此项技术,但DPPHRt微创化是未来的必然趋势。LDPPHRt依赖术者的熟练度,需要在有条件的临床中心进一步推广此项技术,从而提高手术成功率和改善预后。
3.3 DPPHRt的操作要点
根据本研究中11例患者的治疗经验,结合国内外各临床中心的实践,DPPHRt的操作要点在于保证十二指肠及胆总管的充足血供。十二指肠血供主要来自胰十二指肠前后动脉弓,Horiguchi等[25]认为胰十二指肠前后动脉弓之间的发育存在不平衡,43%的病例是以后动脉弓占优势,40%的病例前后动脉弓的发育均等,17%的病例则以前动脉弓供血占优势。由此可见,胰十二指肠上后动脉是胆总管胰腺内段的主要供血动脉,此动脉的保留对减少术后胆道并发症尤为重要。少数患者十二指肠血供主要来源于前动脉弓;尽管前动脉弓多穿过胰头而难以保留,术中亦应尽量保存前动脉弓。很多学者认为,为了保证十二指肠的血供,不应行Kocher切口游离胰头及十二指肠,以免影响后腹膜穿支血管对十二指肠的血供。实际上这种担心是多余的,因为在实际手术操作中几乎见不到来源于后腹膜的穿支血管进入十二指肠,而且行Kocher切口游离胰头及十二指肠可将手术野变浅,掀起胰头及十二指肠,在直视下辨认并分离出胰十二指肠下后动脉,因此行Kocher切口游离胰头及十二指肠可降低手术难度,有利于寻找胰十二指肠前、后动脉弓[26]。
3.4 DPPHRt术后胆管并发症的防治
DPPHRt的术后并发症主要有胰瘘、胆瘘、急性胰腺炎发作、胰腺断面出血、胃排空延迟、胆管炎、胆管穿孔、胆管狭窄、缺血性十二指肠瘘、腹腔脓肿、粘连致机械性肠梗阻、内外分泌功能不全等。胆管并发症以胆瘘、胆管狭窄较为常见[5-7]。Beger等[27]在2015年的一项荟萃分析中报道,术后胆管狭窄发生率约为4.3%。该团队于近期发表的一项荟萃分析指出,B级和C级胰瘘的发生率约为19.0%,胆瘘发生率约为6.3%[28]。本研究中胆管并发症尤其是胆瘘、胆管狭窄的发生率较高,故本文重点讲述胆管并发症的防治。
胆瘘量小者一般无明显症状;量大且无有效腹腔引流者表现为局限性或弥漫性腹膜炎的症状和体征,如腹胀腹痛,高热及腹部压痛、反跳痛、肌紧张等,甚至出现感染性休克。胆瘘的发生可能与术中损伤胆管、胆管过度剥离致影响血供[27]、未完整保留胰十二指肠前后动脉弓等有关[29]。我们总结经验,术后胆瘘的危险因素可以概括为:(1)各种原因导致术中分离胆总管过程中误伤胆总管,如反复急慢性胰腺炎致胆总管周围组织粘连致密、肿瘤体积较大或距离胆总管较近等;(2)术中损伤胰十二指肠血管弓,致胆总管血供受损。针对这些危险因素,胆瘘的预防可从以下两方面着手。(1)术中保留胆管血供:术前可以利用影像学血管成像技术、3D模拟重建技术对胰头十二指肠周围血管走行情况预先评估,有效保留血管弓;尽可能完整地保留前动脉弓,避免术后出现十二指肠及胆管缺血;还可向胰腺实质注射生理盐水,将胰腺实质与疏松结缔组织的间隙从2 mm增加到5~8 mm,更便于分离;术中吲哚菁绿荧光显像技术的应用可更加安全、高效、实时地鉴别术中胆汁溢出[24]。(2)避免术中胆管损伤:对于反复炎症致组织粘连严重、肿瘤与胆总管距离较近者可于术前留置ENBD管[30]或术中行胆总管探查,内置支架管以利于显露和保护胆总管;在胆总管与十二指肠之间及胆总管后外侧保留一薄层的胰腺组织,既可避免过度剥离胆总管造成的意外损伤,又可保留胆总管的血供,但需注意此法有发生胰瘘的风险;如果患者有胆总管扩张,可切开胆总管,在其中插入一根导尿管指引胆总管的走行,从而避免其损伤。胆瘘的治疗包括:基础治疗,如抗炎、抑酸、应用生长抑素、维持电解质平衡等;建立通畅引流,如ERCP放置胆道支架,ENBD治疗;PTCD+超声引导下腹腔穿刺引流;二次手术治疗,清洗腹腔胆汁,建立充分外引流[31]。
本研究中3 例患者出现胆总管狭窄,我们分析其危险因素可能为:(1)术中切除了胆总管与十二指肠壁之间的薄层胰腺组织,导致乳头周围胆总管功能性狭窄(即过度剥离胆总管导致血供受损);(2)十二指肠内侧残留胰腺组织的胰腺炎复发,压迫胆管造成术后胆管狭窄。术后胆总管狭窄的预防与术后胆瘘的预防相似,关键都在于如何在术中避免损伤胆总管并尽可能完整地保留胆总管的血供。本研究中有一例患者于术中不慎损伤胆总管侧壁,术中判断胆总管血供未受影响,术后留置T管,预后良好,并未出现相关胆管并发症。因此笔者认为若术中不慎损伤了胆总管但血运未受影响,可用5-0无损伤缝线修补并放置T管,但是需适当延长T管放置时间以避免造成术后胆总管狭窄。若患者并发术后胆总管狭窄,推荐首选ERCP放置胆管支架[32],支架置入失败、保守治疗均无效者可二次手术切除狭窄段,重建胆道,但风险较大。
通过分析我院11 例行DPPHRt患者的情况并结合文献,该术式作为一种保留器官功能的手术,给临床医生提供了一种新的选择。随着临床医生在术中越来越好地保留十二指肠和胆总管的血供,保留十二指肠的胰头全切除术也愈加完善。需要注意的是,不可盲目追求器官功能的保留,当行胰头全切除有很大难度时,例如胰头部炎症导致胰腺组织与周围组织结构严重粘连,亦或是当胰头部恶性肿瘤侵犯十二指肠或胆总管时,应果断放弃保留器官功能的术式。期待有更多的临床研究证实该术式的诸多优点,同时也期待更多新技术与DPPHRt的结合。
