术前外周血NLR联合PLR在胰腺癌根治性切除术预后评估中的价值
2024-03-01阮哲宇刘俊杰柯毅恒沈亦钰
阮哲宇,刘俊杰,柯毅恒,沈亦钰
1.浙江中医药大学嘉兴学院联培基地,浙江 嘉兴 31400;2.嘉兴学院第二附属医院 肝胆胰外科,浙江嘉兴 314000
胰腺导管细胞癌(pancreatic ductal adenocarcinoma,PDAC)是一种常见的消化系统恶性肿瘤,其病情变化迅速,发现时多已是晚期,是病死率排名第7 的恶性肿瘤,是最致命的癌症类型之一[1]。大量研究均表明,炎症反应是肿瘤的主要特征之一,参与肿瘤细胞增殖和转移等过程,影响肿瘤患者的生存预后[2]。肿瘤患者的全身炎症反应主要由各种炎性细胞构成,包括中性粒细胞、淋巴细胞、单核细胞、血小板等,这些细胞的排列组合和各种算法对包括胰腺癌在内的消化系统肿瘤预后的判断具有重要价值。其中中性粒细胞/淋巴细胞比值(neutrophilto-lymphocyte ratio,NLR)和血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)是目前研究最多的炎症指标,已有大量研究表明NLR及PLR均与胰腺癌患者预后相关[3-6]。在这些研究的基础上,本研究借助X-tile软件计算出NLR及PLR基于Kaplan-Meier曲线的最佳临界值,进一步探讨NLR和PLR与接受根治性手术切除的胰腺癌患者预后的关系。
1 资料和方法
1.1 一般资料
回顾性分析2013年1月至2019年12月在嘉兴第二医院收治的98例行根治性切除术的胰腺癌患者的临床资料。患者以门诊复查或电话方式进行随访,截止至2022年6月30日,无失访。总生存期(月)为行根治性手术治疗至死亡或随访截止的时间。
1.2 病例纳入和排除标准
纳入标准:(1)行根治性手术治疗;(2)病理诊断为PDAC;(3)无其他恶性肿瘤病史;(4)无远处转移或其他部位来源的肿瘤侵袭;(5)临床病理资料完整。排除标准:(1)组织学诊断为非PDAC,如多形性癌、黏液癌、腺泡细胞癌等;(2)术后发生严重并发症致生存时间<30 d;(3)有血液病和炎症性疾病的感染证据或病史,影响血常规结果;(4)随访资料缺失。
1.3 统计学分析
使用X-Tile和SPSS 26.0 软件完成数据处理与统计分析。采用Kaplan-Meier曲线确定NLR和PLR的最佳临界值;通过Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。单因素分析采用χ2检验,多因素分析采用Cox比例风险回归模型。P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般情况
共纳入胰腺癌患者98例,其中男47例,女51例;年龄40~86岁,中位年龄65岁;肿瘤位置:胰头69例,胰体尾29 例;肿瘤分化程度:中高分化50 例,低分化48 例;淋巴结转移:阳性36 例,阴性62 例;神经侵犯:阳性45 例,阴性53 例;外周血中性粒细胞计数为(3.95±1.77)×109/mL,淋巴细胞计数为(1.40±0.66)×109/mL,血小板计数为(191.76±68.13)×109/mL。在随访期间,83例患者死亡,生存期3.0~37.0个月,中位生存期为13.5个月。
2.2 术前NLR及PLR分别与胰腺癌患者预后的关系
利用X-Tile软件得出NLR及PLR基于Kaplan-Meier生存曲线的最佳临界值,NLR的最佳临界值为3.3,PLR的最佳临界值为203.3。根据NLR和PLR的最佳临界值将98 例胰腺癌患者分别分为高NLR组(NLR>3.3,n=38)和低NLR组(NLR≤3.3,n=60),高PLR组(PLR>203.3,n=19)和低PLR组(PLR≤203.3,n=79)。Kaplan-Meier曲线表明,高NLR组中位生存期(10.0个月)较低NLR组(16.0个月)短,差异有统计学意义(P<0.05),见图1。高PLR组中位生存期(9.0个月)明显短于低PLR组(15.0个月),差异有统计学意义(P<0.05),见图2。这提示术前高NLR、PLR均与患者预后不良相关。

图1 高、低NLR胰腺癌患者的生存曲线
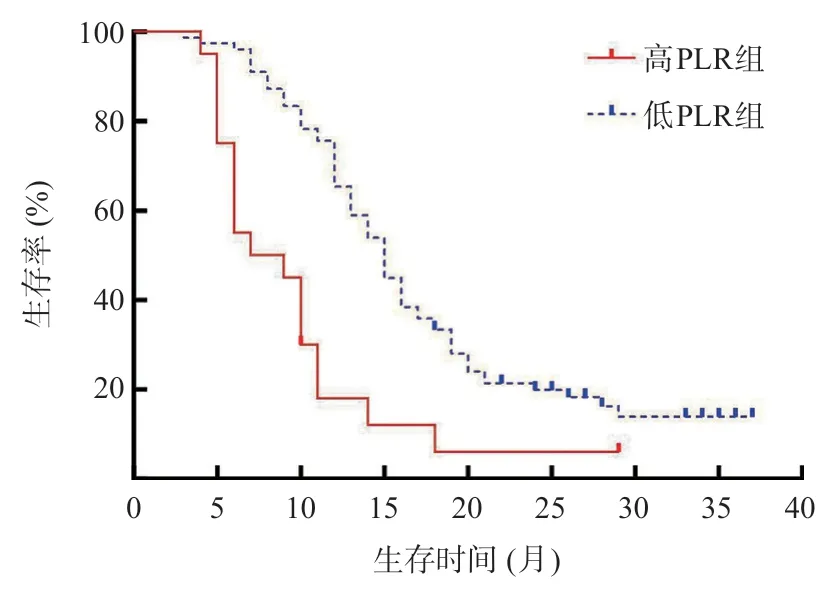
图2 高、低PLR胰腺癌患者的生存曲线
2.3 术前NLR联合PLR与胰腺癌患者预后的关系
Kaplan-Meier 曲线表明NLR 与PLR 均高组(NLR>3.3且PLR>203.3,n=12)、NLR高或PLR高组(NLR>3.3或PLR>203.3,n=33)、NLR与PLR均低组(NLR≤3.3且PLR≤203.3,n=53)中位生存期分别为6.0(95%CI4.30-7.70)个月、12.0(95%CI9.85-14.15)个月和17.0(95%CI14.33-19.67)个月,差异均有统计学意义(P<0.05),见表1和图3。

表1 NLR联合PLR不同分组的胰腺癌患者组间生存期的关系
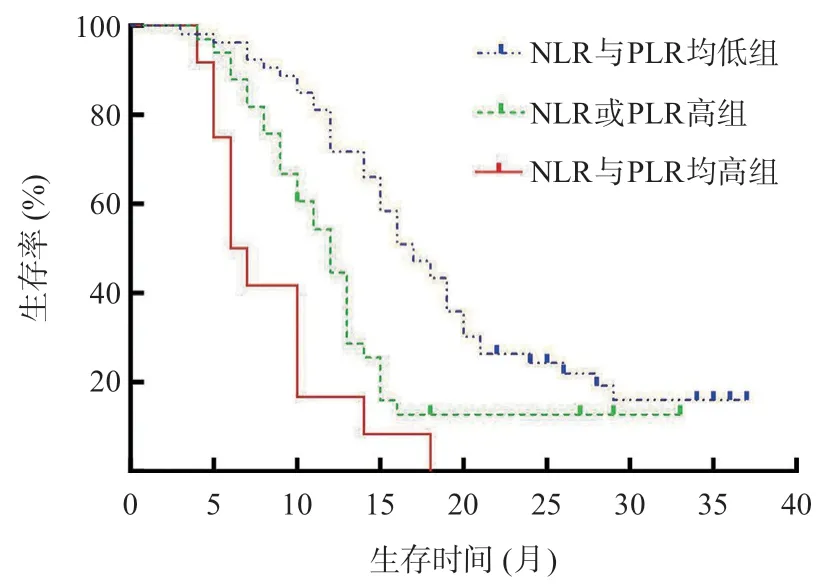
图3 NLR联合PLR不同分组的胰腺癌患者生存曲线
2.4 胰腺癌患者预后影响因素分析
单因素分析结果表明,手术前高NLR(>3.3)、高PLR(>203.3)、高CA199(>200 U/L)、肿瘤低分化和淋巴结转移与本研究中行根治性手术切除胰腺癌患者的预后不良有关(P<0.05),见表2。将上述变量纳入多因素分析,结果表明手术前高NLR(>3.3)、高PLR(>203.3)、肿瘤低分化和淋巴结转移是本研究中行根治性手术切除胰腺癌患者预后不良的独立危险因素(P<0.05),见表3。

表2 胰腺癌患者预后不良的单因素分析

表3 胰腺癌患者预后不良的危险因素Cox多因素回归分析
3 讨论
在消化系统恶性肿瘤中,PDCA的预后最差,病死率和发病率相近,是癌症相关死亡的第四大原因[7]。虽然近年来PDCA的综合治疗有明显改善,但其预后仍然较差,5 年生存率仅为9%。因此,进一步探究PDCA患者预后相关指标,并以此为患者制定个性化治疗策略仍然具有临床意义。
既往研究已证明,肿瘤相关炎症可通过参与肿瘤增殖与转移的过程,影响肿瘤患者的生存时间[8-9]。已经确定,由循环炎症生物标志物,包括C反应蛋白、中性粒细胞、淋巴细胞、血小板、单核细胞和纤维蛋白原介导的全身炎症反应在包括胰腺癌在内的消化道恶性肿瘤的肿瘤发生和发展中起重要作用[10-14]。目前,NLR和PLR作为关注最多的炎症指标,反映了外周血的中性粒细胞、淋巴细胞和血小板的数量。近年来研究表明,术前NLR和PLR是胰腺癌患者预后不良的独立危险因素[12,15]。无论是可切除性胰腺癌,还是局部晚期或转移性胰腺癌,NLR和PLR均与患者预后密切相关,NLR和PLR均高组的胰腺癌患者生存率低于NLR和PLR均低组的胰腺癌患者[16-18]。但因国家、种族及入组条件不同,目前NLR和PLR用于判断胰腺癌预后的临界值并未统一,仍待进一步界定。
既往研究多根据ROC曲线确定NLR和PLR的临界值,此方法的局限性在于选取临界值时只考虑了临床资料的生存结局,并未纳入生存时间,导致各组间的生存曲线差异并未达到最大,这也是各研究报道界定NLR和PLR临界值存在差异的原因。采用X-Tile计算Kaplan-Meier生存曲线最佳临界值,然后根据最佳临界值进行分组,能将患者的预后差异最大化。本研究根据该软件所得的NLR和PLR最佳临界值,对患者分组后进行预后分析,结果提示,对于行根治性手术切除的胰腺癌患者,术前高NLR组患者死亡风险是低NLR组的1.792倍,术前高PLR组患者死亡风险是低PLR组的2.038倍,表明高NLR、及高PLR均提示患者预后不良。此外,以往的研究多围绕单一的炎症指标进行展开,而对多炎症指标联合预测患者预后的探讨较少[15-18]。本研究进一步探索了NLR联合PLR在患者预后评估中的作用。结果显示,NLR与PLR均高组患者中位生存期(6.0个月)较NLR或PLR高组(12.0个月)、NLR与PLR均低组(17.0个月)明显缩短,提示NLR联合PLR可以进一步对这些患者的预后进行分类。这为后续的胰腺癌患者预后研究提供了新思路,可通过增加纳入其他炎症指标,如淋巴细胞/单核细胞比值和纤维蛋白原/清蛋白比值,以及营养指标和凝血指标,进行更系统性的预后分层。
本研究Cox回归分析结果提示肿瘤位置和神经侵犯与患者预后无关,这与既往报道的胰腺癌预后因素存在差别,表明本研究同时存在一定局限性:其一是样本量上的不足和回顾性研究导致结果可能存在偏倚,其二是单中心的研究数据分析无法充分代表总体人群。
综上所述,本研究证明NLR和PLR均与行根治性手术切除的胰腺癌患者预后有关,NLR联合PLR或许能够为行根治性手术切除的胰腺癌患者提供更为准确的预后分层。
