子宫内膜异位症患者新鲜与冻融胚胎移植的妊娠结局比较
2024-03-01戴芳芳郭钰英田秀珍刘乾文郑波麻延芳陶林林霍翠芳
戴芳芳,郭钰英,田秀珍,刘乾文,郑波,麻延芳,陶林林,霍翠芳
(邢台不孕不育专科医院,邢台 054000)
子宫内膜异位症(EMs)是指子宫内膜组织(腺体和间质)生长在子宫体以外的慢性妇科疾病[1-2]。生育期女性EMs患病率为10%~15%[3]。辅助生殖技术(ART)是治疗EMs相关不孕的有效方法[4]。EMs还可能影响卵母细胞与胚胎的发育[5]。促性腺激素释放激素激动剂(GnRH-a)能有效抑制脑垂体,阻止内源性LH峰出现,降低盆腔微环境炎性因子水平,改善内膜容受性,减少对卵母细胞和胚胎的不良影响。对于EMs患者目前较多的研究报道均是采用超长方案或长方案进行促排卵[6-7]。有研究表明,EMs全胚冷冻组的着床率、临床妊娠率和活产率显著高于鲜胚移植组[8];然而也有报道,EMs患者应用不同的长方案,无论是冻融胚胎移植(FET)还是新鲜胚胎移植,其临床妊娠率及胚胎着床率均无明显差异[9]。目前关于EMs患者行全胚冷冻后FET与新鲜胚胎移植的妊娠结局结论并不一致,两种移植策略的临床效果尚不太明确,且鲜见不同分期EMs的结局比较。因此,本研究纳入不同分期EMs患者(各分期均是行IVF助孕前已行手术确定)的临床资料进行分析,旨在评估EMs不同分期患者全胚冷冻FET或鲜胚移植对助孕结局的影响。
资料与方法
一、研究对象
回顾性分析2017年1月至2021年12月在邢台不孕不育专科医院生殖医学中心因EMs行IVF/ICSI-ET助孕患者的临床资料(共552个周期)。
纳入标准:(1)年龄20~45岁;(2)符合《妇产科学》第9版中EMs诊断标准,诊断为EMs患者[2];入组EMs患者均因不孕或卵巢囊肿经腹腔镜或开腹手术诊断,EMs的分期符合美国生殖医学学会(ASRM)分期标准[10];(3)体质量指数(BMI)≤30 kg/m2。
排除标准:合并存在内、外科或妇科恶性疾病;存在子宫畸形、子宫肌瘤、子宫内膜病变、宫腔粘连及怀疑宫腔内有占位性病变者;存在内分泌、免疫性或代谢性疾病等;男方重度少弱畸精子症、无精子症、冷冻精子者;反复种植失败患者;输卵管积水未处理者;血栓疾病史或血栓性家族史者;合并多囊卵巢综合征、生殖道畸形者;双方或一方染色体异常等其他不孕原因的患者。
根据移植周期不同分为:鲜胚移植组(新鲜胚胎移植周期242个)和FET组(全胚冷冻后FET周期310个)。又根据EMs分期分为Ⅰ~Ⅱ期亚组(鲜胚移植组中190个,FET组中222个)和Ⅲ~Ⅳ期亚组(鲜胚移植组中52个,FET组中88个)。
二、研究方法
1.控制性促排卵(COH):所有EMs患者均采用降调节方案促排卵(包括长方案、超长方案)。在黄体期或者月经周期第2~3天给予长效达菲林(益普生,法国)1~3支降调节。返院后给予重组卵泡刺激素(r-FSH,普丽康,默沙东,荷兰)100~250 U/d皮下注射促排卵。依据阴道B超监测卵泡生长情况调整给药剂量,卵泡中后期酌情加用HMG(珠海丽珠)促进排卵。当直径≥18 mm的卵泡数量≥2枚时,单独注射HCG(珠海丽珠)8 000~10 000 U诱发排卵,35~37 h后取卵。
3.FET周期内膜准备:所有行FET的患者均采用降调节+人工周期或人工周期方案进行内膜准备。(1)人工周期内膜准备:月经周期第2~4天开始使用戊酸雌二醇(补佳乐,仙灵,德国)4~6 mg/d,连用7 d后根据内膜厚度调整药物剂量,补佳乐使用天数≥11 d,最大剂量9 mg/d。用药至内膜厚度≥8 mm时行内膜转化。转化日后第4天移植卵裂期胚胎,第5天移植囊胚。移植当日开始使用黄体酮软胶囊(安琪坦,法杏,法国)阴道给药(200 mg,tid)同时口服给药(100 mg,bid)行黄体支持。(2)降调节+人工周期内膜准备:患者自月经周期第2天起给予长效达菲林(益普生,法国)1~3支降调节。降调返院之后用药同人工周期内膜准备。
4.妊娠情况判断:胚胎移植后14 d测定血液β-HCG水平,阳性者于第28日行阴道B超检查,有妊娠囊及原始心管搏动者确定为临床妊娠。超声显示胚胎发育良好者,逐渐减量至孕10周停药。
5.观察指标:(1)患者资料:收集两组患者的年龄、不孕年限、BMI、抗苗勒管激素(AMH)水平、子宫内膜厚度、移植胚胎数等。(2)妊娠结局指标:包括总临床妊娠率、种植率、宫外孕率、流产率、活产率;卵裂胚妊娠率、卵裂胚种植率;囊胚妊娠率、囊胚种植率、囊胚占比。
三、统计学方法
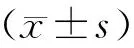
结 果
一、鲜胚移植组与FET组及不同EMs分期亚组的一般资料比较
鲜胚移植组和FET组患者的不孕年限、BMI、AMH水平比较均无统计学差异(P>0.05)。鲜胚移植组的内膜厚度显著高于FET组,平均年龄显著低于FET组(P均<0.05)(表1)。
表1 鲜胚移植组与FET组及不同EMs分期亚组的一般资料比较(-±s)
鲜胚移植组中EMs分期Ⅰ~Ⅱ期及Ⅲ~Ⅳ期患者的内膜厚度均显著高于FET组不同分期患者(P均<0.05),EMs分期Ⅰ~Ⅱ期患者的平均年龄显著低于FET组中EMs Ⅰ~Ⅱ期患者(P<0.05);FET组中EMs分期Ⅰ~Ⅱ期患者的平均不孕年限显著高于Ⅲ~Ⅳ期患者(P<0.05)(表1)。
二、鲜胚移植组与FET组及不同EMs分期亚组的胚胎实验室指标比较
鲜胚移植组的移植胚胎数显著高于FET组(P<0.05),鲜胚移植组中EMs分期Ⅰ~Ⅱ期患者的移植胚胎数显著高于FET组Ⅰ~Ⅱ期患者(P<0.05);FET组中EMs分期Ⅰ~Ⅱ期患者行降调节人工周期内膜准备方案比例显著低于Ⅲ~Ⅳ期患者(P<0.05)(表2)。
表2 鲜胚移植组与FET组及不同EMs分期亚组的胚胎实验室指标比较[(-±s),%]
三、鲜胚移植组与FET组及不同EMs分期亚组的妊娠结局比较
鲜胚移植组的临床妊娠率、种植率、宫外孕率、流产率及活产率与FET组均无显著性差异(P>0.05),鲜胚移植组中Ⅲ~Ⅳ期患者的临床妊娠率、种植率及活产率显著低于FET组Ⅲ~Ⅳ期患者(P<0.05),FET组中Ⅰ~Ⅱ期患者的临床妊娠率及种植率显著低于Ⅲ~Ⅳ期患者(P<0.05)(表3)。
如果说隐喻是利用事物之间的相似性促动范畴的扩展,那么转喻就是利用事物的相关性促动的扩展。有些范畴化既包含着隐喻又包含着转喻,两者共同作用。图式是人们在认识客观世界的过程中基于身体经验而形成的固定的认知结构模式,如路径图式、终点图式,图式与图式之间存在着转换关系,由于这种转换关系促动的多义现象就是图式转换因素。规约意象是人脑中反映的客观事物和情景的形象和印记,它在量词范畴扩展方面发挥了极其重要的作用,文中也详细的以日语中的量词“本”为例解释了图式转换和规约意象的作用。

表3 鲜胚移植组与FET组及不同EMs分期亚组的妊娠结局比较(%)
鲜胚移植组的囊胚妊娠率显著低于FET组(P<0.05),鲜胚移植组中Ⅰ~Ⅱ期患者的卵裂胚妊娠率、卵裂胚种植率显著高于Ⅲ~Ⅳ期患者(P<0.05);鲜胚移植组中Ⅲ~Ⅳ期患者的卵裂胚妊娠率、卵裂胚种植率、囊胚妊娠率及囊胚种植率显著低于FET组中Ⅲ~Ⅳ期患者(P<0.05),而囊胚移植占总移植数比例显著高于FET组中Ⅲ~Ⅳ期患者(P<0.05);FET组EMs分期Ⅰ~Ⅱ期患者的囊胚妊娠率及囊胚种植率显著低于Ⅲ~Ⅳ期患者(P<0.05)(表4)。

表4 鲜胚移植组与FET组及不同EMs分期亚组的卵裂胚及囊胚移植结局比较(%)
讨 论
EMs是指子宫内膜腺体和间质种植在宫体以外的盆腹腔脏器表面或浸润生长,导致该部位病灶周期性出血,进而导致腹痛不适、生育力下降以及盆腹腔包块等的一种雌激素依赖性炎症性疾病。不孕妇女中EMs患病率高达20%~30%[11]。有研究提示EMs患者胚胎着床受损,可能与子宫内膜的缺陷、腹腔微环境异常或胚胎本身的质量下降有关[12]。辅助生殖治疗的成功率除了与胚胎质量有关,还依赖于胚胎-子宫内膜的相互作用及子宫内膜容受性[13]。EMs患者腹腔液微环境改变等因素综合作用导致卵母细胞质量下降,受精及种植能力降低[14]。EMs患者内膜蜕膜化反应不良[15],在位内膜中存在多种与子宫内膜容受性相关的异常表达因子[16],子宫内膜组织胞饮突、黏附分子、白血病抑制因子(LIF)以及整合素家族表达水平下降等多种因素最终导致种植窗期的子宫内膜容受性下降[17]。推测EMs可能通过介导某些炎症因子影响患者的子宫内膜容受性从而影响胚胎着床、临床妊娠率及活产率[18-19]。
目前研究认为,GnRH-a治疗后的EMs患者腹腔液中炎症细胞因子水平降低,子宫内膜胞饮突的数量增加,整合素表达增强,可以一定程度上提高子宫内膜容受性[20];对于轻中度EMs患者采用长效长方案降调节可能更有利于提高EMs不孕患者的临床妊娠率[21]。通过改善盆腔微环境,提高子宫内膜容受性,有利于胚胎种植[22-23]。糖链抗原-125(CA125)对于评估EMs的严重程度有重要的参考价值。本研究中对于EMs患者行促排卵启动前均检查CA125。若CA125水平≥16 μU/ml则采用超长方案,旨在更好地改善患者的盆腔环境。CA125<16 μU/ml者则采用长方案进行促排卵。但也有研究报道,GnRH-a治疗后,BMI轻度增加,胰岛素抵抗(IR)明显升高[24],继而对EMs患者的胚胎种植、临床妊娠及活产不利。本研究结果显示行新鲜胚胎移植的EMs分期Ⅰ~Ⅱ期患者的卵裂胚移植的妊娠率及种植率显著高于Ⅲ~Ⅳ期患者(P<0.05),与既往文献报道的结果相似。
鲜胚移植周期中COH过程导致了超过生理量的激素水平,可能损害子宫内膜容受性[25]。有研究显示,有活性的雌激素可加重EMs的病理进程和临床症状,降低子宫内膜的胚胎容受性,从而影响胚胎种植率[26]。FET周期中通过外源性补给雌激素,血内浓度远远低于新鲜促排卵周期的雌激素水平。然而也有研究发现FET并不能避免EMs对子宫内膜容受性的影响[27]。徐嘉宁等[9]发现EMs患者应用不同的长方案,无论是FET周期还是新鲜周期,其临床妊娠率及胚胎着床率均无明显差异;但文章中无EMs患者不同分期的占比,不同移植胚胎类型中亦没有明确区分卵裂胚及囊胚的占比。
有研究指出,在EMs不孕患者中,全胚冷冻后行FET可获得较高的累积妊娠率及较低的妊娠期糖尿病(GDM)风险[28]。且冷冻胚胎后行FET在恢复子宫内膜容受性方面亦安全有益[29]。有研究认为,EMs的严重程度影响IVF/ICSI的结果,EMs Ⅲ~Ⅳ期患者的IVF结局较差[30]。还有研究表明,EMs的严重程度可能对ART助孕妊娠后的早产率有不良影响[31]。轻度EMs患者全胚冻存后首次行FET的临床妊娠率与鲜胚移植周期相似,但早期流产率更低,活胎分娩率更高[32]。但也有研究认为,IVF结局与EMs严重程度无关[33]。EMs不孕患者腹腔镜术后行IVF-ET助孕时不孕时间短对提高妊娠率有益[34]。本研究结果显示,FET组中EMs Ⅰ~Ⅱ期患者的整体临床妊娠率、种植率、囊胚妊娠率及囊胚种植率均显著低于Ⅲ~Ⅳ期患者(P<0.05)。分析结果可能与FET周期EMs患者中Ⅰ~Ⅱ期患者的不孕年限比Ⅲ~Ⅳ期患者更长、行降调节+人工周期准备内膜的Ⅲ~Ⅳ期患者比例较大、GnRH-a增加了子宫内膜容受性有关。但也不除外与本研究纳入的研究对象较少,可能存在研究偏倚有关。
本研究中EMs患者鲜胚移植周期的内膜厚度均显著高于FET患者(P<0.05),然而EMs患者全胚冷冻后行FET的囊胚妊娠率较鲜胚移植周期的囊胚移植有升高趋势。在分期比较中,EMs Ⅰ~Ⅱ期鲜胚移植周期的卵裂胚妊娠率显著高于FET周期(P<0.05),但卵裂胚种植率无统计学差异;这可能与鲜胚移植周期移植胚胎数显著高于FET周期有关(P<0.05)。EMs Ⅲ~Ⅳ期FET周期的总移植妊娠率、种植率、活产率,卵裂胚的妊娠率、种植率,囊胚的妊娠率、种植率均显著高于鲜胚移植组(P<0.05),提示对于EMs Ⅲ~Ⅳ期患者建议行全胚冷冻后FET。与岳彩欣等[28]的研究结果相似,认为EMs不孕患者中,全胚冷冻后行囊胚FET可获得较高的累积妊娠率。另外,徐洁等[20]报道EMs患者IVF/ICSI单胚胎移植后总的妊娠丢失风险并不会增高。本研究结果与之相似。但本研究的不足之处为:FET内膜准备方案未纳入自然周期方案;EMs患者的临床妊娠率较输卵管因素低,为增加患者的临床妊娠率可能移植胚胎数较高。为了改善行辅助生殖助孕患者的妊娠结局,我中心建议患者移植前改善和调整生活方式,对于肥胖和重度肥胖患者建议减重至BMI≤30 kg/m2后再给予移植,因此,BMI>30 kg/m2的EMs人群尚没有相关数据,存在一定局限性。
综上所述,EMs患者全胚冷冻后行FET的临床妊娠率较鲜胚移植周期有升高趋势,尤其对于EMs Ⅲ~Ⅳ期患者建议全胚冷冻后行FET。但本研究为单中心回顾性队列研究,后期尚需要进一步开展多中心的随机临床试验来验证研究结论。
