敲低锌转运蛋白ZIP7抑制小鼠睾丸支持细胞增殖的研究
2024-03-01特力格尔刘璇李媛静李欢欢王树松马婧
特力格尔,刘璇,李媛静,李欢欢,王树松,,,马婧*
(1. 河北医科大学研究生院,石家庄 050017;2. 河北师范大学化学与材料科学学院,石家庄 050024;3. 河北省生殖健康医院 河北省生殖医学重点实验室,石家庄 050071)
锌在多个生物学过程中具有重要功能,确保其含量稳定对于维持正常生命过程至关重要。这一动态平衡主要由锌转运蛋白(Zn transporters,ZnT)家族和锌铁调控转运蛋白(Zrt-,Irt-related proteins,ZIP)家族的相关转运蛋白(统称为锌转运蛋白)调控。其中,ZnT家族可降低细胞质锌浓度;ZIP家族可升高细胞质锌浓度。这些锌转运蛋白主要表达于细胞膜或细胞器质膜表面,调控细胞内和细胞器中的锌稳态[1-4]。近年来有研究表明锌转运蛋白在男性生殖中发挥重要作用:有研究显示ZnT7和ZnT8蛋白可能通过调节睾酮合成酶的表达参与睾酮合成过程[5-6];Zhu等[7]发现睾丸ZIP12蛋白在精子发生过程中维持锌稳态,可保护精原细胞免受氧化应激损伤。
ZIP7是ZIP家族LIV-1亚家族的重要成员之一,在多种组织中广泛表达。研究发现,ZIP7不仅可以直接调节细胞内的锌离子稳态,而且参与了多种信号通路的调控,在胰岛素抵抗、Ⅱ型糖尿病、乳腺癌、心肌再灌注损伤等的病理过程中起重要作用[8-10]。有研究表明,ZIP7在睾丸组织粗线期精母细胞中的含量高于圆形精子细胞,提示其可能参与精子发生过程中锌稳态的调节[11]。然而,既往研究对睾丸支持细胞中锌转运体的生理功能及作用机制的报道较少。因此,本研究观察了ZIP7在小鼠睾丸支持细胞(TM4细胞)中的表达定位,建立ZIP7基因敲低(siRNA干扰)模型来研究ZIP7敲低对TM4细胞的影响及其机制,旨在从细胞水平探究ZIP7的生物学功能,以期为研究锌转运蛋白在雄性生殖细胞中的作用提供一定理论基础。
材料与方法
一、材料与试剂
小鼠睾丸支持细胞系(TM4细胞)购自武汉普诺赛公司。DMEM/F-12完全培养基购自美国Sigma公司;胎牛血清和马血清购自美国VivaCell Biosciences公司;青霉素-链霉素双抗溶液和Trypsin EDTA Solution A购自以色列Biological Industries公司;1×PBS缓冲液、H2O2、Triton X-100和抗荧光衰减封片剂购自北京索莱宝科技有限公司;BSA购自澳大利亚Bovogen Biologicals公司;siRNA套餐(mSlc39a7)购自天津中实基因科技有限公司;OPTI-MEM减血清培养基购自美国Gibco公司;LipofectamineTM2000购自美国Invitrogen公司;SuperKineTM超敏型细胞增殖检测试剂(CCK-8)购自美国Abbkine公司;6分钟耐热首链cDNA合成试剂盒购自天津中实基因科技有限公司;2×SYBR Green Fast qPCR Mix购自美国ABclonal公司;活性氧检测试剂盒购自北京盒子生工科技有限公司;兔抗ZIP7抗体购自美国Abcam公司;鼠抗蛋白质二硫键异构酶(PDI)抗体购自美国GeneTex公司;鼠抗性别决定区Y框蛋白9(SOX9)抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG(H+L)和异硫氰酸荧光素(FITC)标记的山羊抗兔IgG(H+L)购自美国KPL公司;HRP标记的山羊抗鼠IgG(H+L)购自美国Sera Care公司;Fluor594标记的山羊抗小鼠IgG(H+L)购自美国Affinity公司;鼠抗GAPDH抗体购自美国Immunoway公司;兔抗c-Jun氨基末端激酶(JNK)抗体、兔抗磷酸化JNK(p-JNK)抗体、兔抗细胞外信号调节激酶(ERK)抗体和兔抗磷酸化ERK(p-ERK)抗体购自杭州华安生物技术有限公司;高效RIPA细胞裂解液购自北京索莱宝科技有限公司;Western blot相关试剂购自北京庄盟国际生物基因科技有限公司;超敏ECL化学发光检测试剂购自上海李记生物有限公司。
二、实验方法
1.TM4细胞的培养与鉴定:TM4细胞培养在DMEM/F12培养基(含5%HS、2.5%FBS、1%青霉素-链霉素双抗溶液)中,置于5%CO2、37℃细胞培养箱中48~72 h。显微镜下观察到细胞呈上皮细胞样贴壁生长,镜下细胞形态与标准TM4细胞系一致;并对TM4细胞进行短串联重复序列(Short tandem repeat,STR)基因分型鉴定,通过细胞免疫荧光染色法检测TM4细胞上支持细胞标志物SOX9的表达,结果认为可鉴定为TM4细胞系。
2.细胞免疫荧光染色法检测ZIP7在TM4细胞上的定位:将细胞爬片放入24孔板中接种细胞,细胞贴壁24 h后吸弃培养液,PBS清洗3次;冰甲醇固定10 min;固定后PBS清洗3次;0.5%Triton X-100通透处理15 min;PBS清洗3次;5%BSA溶液室温封闭50 min;弃去封闭液,一抗稀释液4℃过夜孵育,一抗稀释浓度为ZIP7(1∶200)、PDI(1∶200)、SOX9(1∶200)。次日,从4℃冰箱取出细胞爬片后室温平衡30 min,PBS清洗3次;荧光二抗稀释液37℃避光孵育1 h,二抗稀释浓度为FITC标记的山羊抗兔IgG(1∶250)、Fluor594标记的山羊抗小鼠IgG(1∶250),PBS避光清洗3次,用抗荧光衰减封片剂封片,使用MD ImageXpress Micro高内涵细胞成像分析系统采集图像。
3.细胞转染:将TM4细胞接种在6孔板中,待细胞密度达到70%~90%时转染ZIP7 siRNA。OPTI-MEM减血清培养基分别与LipofectamineTM2000和siRNA混匀,室温静置5 min。将LipofectamineTM2000缓慢滴进siRNA中,轻轻吹吸混匀后室温静置20 min。将6孔板中旧的培养基弃掉,加入800 μl的OPTI-MEM减血清培养基,再将LipofectamineTM2000-siRNA混合物逐滴加入每孔中。转染4~6 h后观察细胞状态,弃掉旧培养基,加入2 ml完全培养基。转染24 h后检测RNA水平变化,48 h后检测蛋白水平变化,用ZIP7 siRNA组与对照组的相对表达水平表示干扰效率(剩余基因/蛋白表达百分比)。
4.CCK8法检测TM4细胞增殖能力:TM4细胞分为对照组和ZIP7 siRNA组,按5×103个细胞/孔的密度在96孔板中接种细胞,每组设置6个复孔。置于细胞培养箱中培养24 h后,观察细胞密度和贴壁状态,进行细胞转染。在转染24 h和48 h后,弃去96孔板中的旧细胞培养液,加入含10%CCK-8溶液的培养基,在细胞培养箱中孵育30 min,用酶标仪测定450 nm波长处每孔的OD值,处理数据并绘制增殖曲线。
5.DHE荧光探针检测TM4细胞内活性氧(ROS)水平:DHE可以穿过细胞膜进入细胞,被细胞内的ROS氧化后形成氧化乙啶掺入染色体DNA中,使细胞核呈现明亮红色荧光。用DMEM/F12培养基稀释DHE(1∶500),使终浓度为10 μmol/L。去除旧细胞培养液,向24孔板加入200 μl稀释好的DHE。细胞培养箱内孵育30 min,每隔3~5 min颠倒混匀一次,使探针和细胞充分接触。弃去上层培养液,用PBS反复轻轻吹打,在荧光显微镜上检测荧光并拍照记录,采用Image J软件对图片进行荧光强度的半定量分析。
6.实时荧光定量PCR(qPCR)检测TM4细胞内ZIP7 mRNA的相对表达量:细胞转染结束后吸弃6孔板中的细胞培养液,PBS清洗3次,每孔加入500 μl RL1裂解液,室温裂解10 min后,转移至DNA-cleaning管中,随后操作按试剂盒说明书提取RNA。每份RNA标本中加入4 μl 5×Fast Plus RT Master mix和1 μl 20×Oligo dT &Random Primer,并用RNase-free水将整个反应体系补足20 μl,充分混匀,瞬时离心后上机。逆转录反应程序设置:50℃ 5 min(第一链cDNA合成)、95℃ 1 min(失活反转录酶MuLV)。从逆转录仪中取出cDNA样本,配制20 μl qPCR反应体系:10 μl 2×SYBR qPCR Mix,1 μl cDNA,0.4 μl上游引物,0.4 μl下游引物,8.2 μl H2O。设置qPCR扩增程序:94℃预变性3 min,94℃ 15 s、60℃ 30 s,共40个循环,在72℃ 30 s处收集荧光信号,72℃延伸5 min。目的基因以GAPDH为内参基因进行校准,以对照组细胞中目的基因表达量作为对照,并根据2-△△Ct计算基因的相对表达量。GAPDH上游引物为:5′-CATCACTGCCACCCAGAAGACTG-3′,下游引物为:5′-ATGCCAGTGAGCTTCCCGTTCAG-3′;ZIP7上游引物为:5′-AGCCATGGGACTTCTAGGGA-3′,下游引物为:5′-GATGAGGTGGAGGAACGCAT-3′。
7.Western blot法检测TM4细胞中ZIP7、JNK、p-JNK、ERK和p-ERK蛋白表达水平:细胞转染结束后吸弃6孔板中的细胞培养液,用预冷的PBS清洗3次,加入适量RIPA蛋白裂解液[按1∶100的比例提前加入丝氨酸蛋白酶抑制剂苯甲基磺酰氟(PMSF),现用现配]裂解细胞中的蛋白,将蛋白收集在1.5 ml EP管中,旋涡震荡20 min,4℃ 12 000 rpm离心10 min,取上清液检测蛋白浓度。将等量的蛋白样品用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,使用湿转法将蛋白转移到PVDF膜上;使用5%脱脂牛奶对PVDF膜封闭2 h;分别加入鼠抗GAPDH单克隆抗体(1∶50 000)、兔抗ZIP7单克隆抗体(1∶1 000)、兔抗JNK多克隆抗体(1∶1 000)、兔抗p-JNK多克隆抗体(1∶1 000)、兔抗ERK多克隆抗体(1∶1 000)、兔抗p-ERK多克隆抗体(1∶1 000),4℃孵育过夜;次日,洗膜后加入HRP标记的山羊抗鼠IgG(H+L)和HRP标记的山羊抗兔IgG(H+L)(1∶5 000),37℃孵育1 h,洗膜,超敏ECL化学显影,化学发光成像仪检测,Image J软件分析蛋白条带灰度值。用JNK、ERK分别对p-JNK、p-ERK归一化,p-JNK/JNK和p-ERK/ERK表示对照组和ZIP7 siRNA组JNK、p-JNK、ERK、p-ERK的蛋白表达水平。实验至少重复3次,取平均值。
三、统计学分析
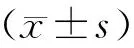
结 果
一、TM4细胞的细胞免疫荧光染色
ZIP7表达绿色荧光,支持细胞标志物SOX9表达红色荧光,细胞核DAPI染色呈现蓝色荧光,细胞免疫荧光显示TM4细胞表达支持细胞标志物SOX9和ZIP7(图1)。
二、ZIP7在TM4细胞上的表达定位
本研究采用细胞免疫荧光染色法检测ZIP7的亚细胞定位,结果显示,ZIP7表达绿色荧光,与内质网特异性标志物PDI的红色荧光高度重合,两者重合呈现出黄色荧光,表明ZIP7定位于TM4细胞的内质网上(图2)。

图2 ZIP7在TM4细胞中的亚细胞定位(高内涵细胞成像分析系统,×100)
三、敲低ZIP7抑制TM4细胞增殖
本研究采用siRNA干扰TM4细胞中的ZIP7水平,并采用qPCR和Western blot方法联合验证siRNA转染效果,结果显示与对照组相比,ZIP7 siRNA组的ZIP7 mRNA和蛋白表达量显著降低(P分别<0.05和<0.01,图3A~C),干扰效率分别为41.0%和55.6%。CCK8法检测TM4细胞增殖能力,结果显示siRNA转染24 h和48 h后TM4细胞增殖能力显著降低(P<0.001),提示ZIP7敲低会抑制TM4细胞的增殖(图4)。

A:qPCR检测两组TM4细胞中ZIP7 mRNA相对表达量:与对照组比较,**P<0.01;B:Western blot法检测两组TM4细胞ZIP7蛋白表达;C:两组TM4细胞中ZIP7蛋白表达水平的半定量分析:与对照组比较,**P<0.01。图3 TM4细胞ZIP7转染效率

CCK8法检测转染ZIP7 siRNA 24 h和48 h后TM4细胞的增殖能力:与对照组比较,#P<0.001。图4 敲低ZIP7抑制TM4细胞增殖
四、敲低ZIP7后TM4细胞ROS水平升高
DHE荧光探针会使细胞核呈现红色荧光,细胞内ROS水平越高,红色荧光越强。ZIP7 siRNA组较对照组红色荧光显著增强(P<0.001),提示敲低ZIP7后TM4细胞内ROS水平显著升高(图5)。
A:荧光染料DHE检测TM4细胞内ROS水平;B:两组TM4细胞内荧光强度的半定量分析:与对照组比较,#P<0.001。图5 敲低ZIP7后TM4细胞的ROS水平升高
五、敲低ZIP7后激活JNK磷酸化
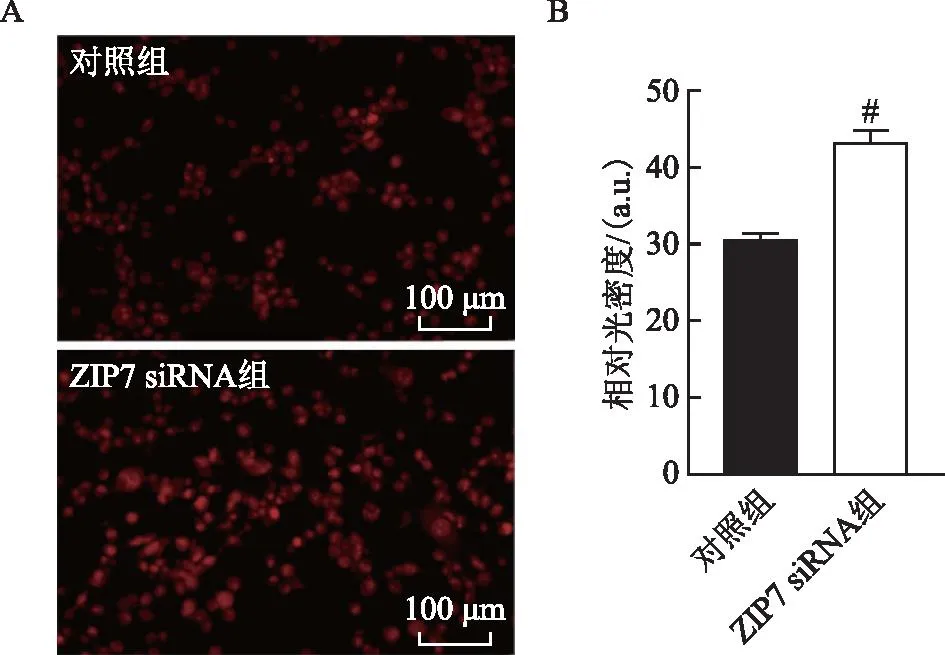
与对照组比较,ZIP7 siRNA组JNK蛋白水平表达无显著性差异(P>0.05),p-JNK蛋白表达显著升高(P<0.05),提示敲低ZIP7后TM4细胞内JNK蛋白磷酸化水平升高。与对照组比较,ZIP7 siRNA组ERK和p-ERK蛋白水平表达无显著性差异(P>0.05),提示ZIP7敲低不明显影响ERK的磷酸化水平(图6)。
A:Western blot法检测TM4细胞中JNK和p-JNK、ERK和p-ERK蛋白表达;B:两组TM4细胞中JNK和p-JNK、ERK和p-ERK蛋白表达水平的半定量分析:与对照组比较,*P<0.05。图6 敲低ZIP7对TM4细胞JNK、p-JNK、ERK和p-ERK蛋白的影响
讨 论
睾丸支持细胞是一种极化的上皮细胞,可从生精上皮的基底部延伸至生精小管管腔内。这类细胞可以分泌多种营养物质以供生殖细胞的正常发育成熟,为生殖细胞的运动提供结构性支持,并为精子发生构建了免疫屏障[12]。研究证实,细胞内的锌离子发挥着广泛的生物学作用,与细胞膜稳定、细胞内基因调控和物质代谢等过程关系密切[13]。因此,睾丸支持细胞内锌稳态的维持对其生理功能的正常发挥至关重要。内质网是细胞内重要的锌储存库,对于维持细胞质锌离子浓度至关重要[14]。研究发现ZIP7是内质网释放锌离子的关键“守门人”,可以将内质网中的锌离子转运到细胞质,使其在多种细胞生物学过程中发挥正常功能[15-16]。本研究通过细胞免疫荧光染色观察到ZIP7定位于TM4细胞的内质网上,这与之前的报道[15,17-18]一致。有文献报道锌离子对细胞分裂和增殖相关酶的活性至关重要,也可通过垂体生长激素(GH)-胰岛素样生长因子-I(IGF-I)轴的信号转导参与细胞增殖的调节[19]。本研究通过CCK8法分别检测了TM4细胞转染ZIP7 siRNA后24 h和48 h的增殖能力,结果显示敲低ZIP7后TM4细胞的增殖活性显著下降。推测敲低ZIP7可能通过抑制TM4细胞从内质网向细胞质释放锌离子的过程,破坏了细胞内的正常锌离子缓冲与平衡,从而抑制了细胞的正常增殖活性。
本研究发现ZIP7敲低后TM4细胞内ROS水平显著升高。既往研究显示高ROS水平可以激活下游的JNK通路和内质网应激等多种信号通路,从而诱导细胞氧化应激损伤和凋亡[20-21]。相关研究发现,ROS抑制剂N-乙酰-L-半胱氨酸可以显著抑制JNK的磷酸化,表明二者密切相关[22]。JNK是丝裂原活化蛋白激酶(MAPK)家族的重要成员,在细胞增殖、分化或死亡等多种细胞过程中发挥着关键作用[23]。研究证实,ZIP7在磷酸化后可以激活细胞内酪氨酸激酶以及JNK和细胞外信号调节激酶(ERK)磷酸化[24-25]。因此,为进一步阐明敲低ZIP7后抑制TM4细胞增殖的机制,本研究重点探究了ZIP7与JNK、ERK蛋白磷酸化之间的关系。结果显示,敲低TM4细胞的ZIP7表达可以激活JNK蛋白磷酸化,但不影响ERK蛋白的磷酸化水平表达。大量证据表明细胞内ROS水平增加与JNK通路的激活对于抑制细胞的生长和增殖至关重要。Li等[26]研究发现增加ROS和活化JNK的产生可以抑制肿瘤细胞增殖并促进凋亡。Wang等[27]研究表明Curcin C蛋白可能通过激活JNK信号通路从而促进细胞内ROS积累,诱导人骨肉瘤U2OS细胞周期阻滞、凋亡和自噬,抑制其增殖。因此,本研究推测敲低ZIP7能通过介导细胞内ROS水平升高和JNK磷酸化激活,抑制TM4细胞增殖能力。但是本研究尚存在一些不足之处,如缺乏挽救实验等。此外,由于没有检测其他ZIP家族的变化,本研究无法明确ZIP家族之间的综合作用或代偿平衡作用。未来可以尝试使用ROS抑制剂或JNK通路抑制剂干预细胞,深入挖掘ZIP7作用的相关上下游通路及分子机制。
综上所述,敲低ZIP7可以显著抑制TM4细胞增殖,该过程可能通过ROS水平的升高以及JNK通路的激活介导。本研究初步探索了锌转运蛋白ZIP7在小鼠睾丸支持细胞(TM4细胞)中的分子调控机制,为进一步阐明锌稳态在雄性生殖细胞中发挥的作用提供理论参考。
