二硫键桥Cys2nd-Cys6th 缺失对典型TIL类蛋白酶抑制剂抑制活性和特异性的影响
2024-02-29张照锋陈长清李游山
魏 梦,王 圆,张照锋,陈长清,李游山,4*
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723001;2.陕西理工大学 秦巴生物资源与生态环境省部共建国家重点实验室(培育),陕西 汉中 723001;3.陕西理工大学 陕西省资源生物重点实验室,陕西 汉中 7230012;4.陕西理工大学 陕南秦巴山区生物资源综合开发协同创新中心,陕西 汉中 723001)
蛋白酶抑制剂通过结合蛋白酶或介导蛋白酶受体清除信号,从而抑制蛋白酶的活性[1].蛋白酶的主要作用是催化蛋白质和多肽的水解,其活性受到严格的调控.蛋白酶抑制剂在许多生理过程中起重要的调控作用,例如消化、凝血、细胞迁移、免疫调节、细胞凋亡、细胞分化、酚氧化酶级联反应[2-7].蛋白酶抑制剂可分为丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂、天冬氨酸蛋白酶抑制剂和金属蛋白酶抑制剂[8-9].其中,丝氨酸蛋白酶抑制剂的种类最多,对胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶和组织蛋白酶有抑制作用[10-12].丝氨酸蛋白酶抑制剂分为Serpin,TIL,Kunitz,Kazal等几个家族[13],典型的TIL家族蛋白酶抑制剂代表有AmCI,AsATI,AsC/E-1,RmSI-7等,具有1个含10个半胱氨酸残基的TIL结构域,组成5个二硫键桥,二硫键桥位置为1-7,2-6,3-5,4-10和8-9[12].少数TIL家族蛋白酶抑制剂的TIL结构域仅含有8个半胱氨酸残基,组成4个二硫键桥,例如BmSPI38,BmSPI39,Cv T-TIL,MdbEgf0.4b,MdbEgf1.0,BmFPI-F等[14-17].TIL类蛋白酶抑制剂属于经典类丝氨酸蛋白酶抑制剂,经典类抑制剂由14~200个氨基酸残基组成,分子量为3~21 kDa.该类抑制剂均具有典型的结合环构象作用机制,抑制蛋白酶的作用片段称为蛋白酶结合环,它与酶的活性部位以非共价键方式形成类似酶-底物的米氏复合物[18-19].
Bania等[12,20]从蜜蜂幼虫血液中纯化出一种TIL类蛋白酶抑制剂AmCI,该抑制剂分子量为5 972 Da,核磁共振结果显示,AmCI的三级结构由2个近似垂直的β折叠片和无规则卷曲组成,其高级结构由5个二硫键来维持.AmCI不仅能强烈抑制胰凝乳蛋白酶,还能较强地抑制组织蛋白酶G,对弹性蛋白酶仅有微弱抑制活性[21].蛔虫产生的蛋白酶抑制剂,可以使胰凝乳蛋白酶、弹性蛋白酶、胰蛋白酶、胃蛋白酶和羧肽酶失活,这些蛋白酶抑制剂的生理作用是保护蛔虫不被宿主的消化酶降解[17,20-22].蛋白酶抑制剂可以在蛔虫和卵表面与宿主蛋白酶形成复合物,进而保护幼虫从肠道迁移到肝脏时可以免疫逃避[21-22].Goodman等[23]利用亲和层析法从蛔虫中分离纯化出一种胰蛋白酶抑制剂,将其命名为AsATI.Peanasky等[24]从蛔虫中纯化到一种新的蛋白酶抑制剂AsC/E-1,该抑制剂能够强烈抑制胰凝乳蛋白酶和弹性蛋白酶的活性,对枯草杆菌蛋白酶也有极微弱的抑制活性.进一步研究发现,AsATI和AsC/E-1皆含有1个TIL结构域,其高级结构由2个反向平行的β折叠片和无规则卷曲组成,其5个二硫键桥在维持抑制剂的三级结构中发挥着重要作用[25-26].
笔者研究发现,进化过程中家蚕蛋白酶抑制剂BmSPI38和BmSPI39中Cys2nd-Cys6th的缺失对其微生物蛋白酶抑制活性的获得至关重要[27].迄今为止,已有天然纯化的AmCI,AsATI和AsC/E-1对胰蛋白酶、胰凝乳蛋白酶和弹性蛋白酶具抑制活性的报道,受限于蛋白表达、纯化和活性检测手段,人们对上述抑制剂的活性和生理功能的认识还十分有限.Cys2nd-Cys6th对典型TIL蛋白酶抑制剂AmCI,AsATI和AsC/E-1的抑制活性和抑制特异性的影响尚不清楚.笔者拟通过原核表达、定点突变和蛋白酶抑制剂胶内活性染色技术分析AmCI,AsATI和AsC/E-1对不同蛋白酶的抑制活性,探讨Cys2nd-Cys6th对其抑制活性和抑制特异性的影响,以期为AmCI,AsATI和AsC/E-1的生理功能研究奠定基础,并为TIL类蛋白酶抑制剂活性和特异性的定向改造提供依据.
1 材料与方法
1.1 材 料
大肠杆菌EscherichiacoliDH5α购自上海昂羽生物技术有限公司;Origami 2(DE3)菌株、p28表达载体(pET28a改造而成)由陕西理工大学维生素D 生理与应用研究所保存;限制性核酸内切酶NdeI、NotI购自Takara公司;TransStartFastPfu,TransStartFastPfuFly DNA 聚合酶购自北京全式金生物技术有限公司.胰蛋白酶、胰凝乳蛋白酶、枯草杆菌蛋白酶、N-乙酰基-D,L-苯丙氨酸-β-萘酯(N-acetyl-D,L-phenylalanine-β-naphthylester,APNE)、N,N'-二甲基甲酰胺、Fast Blue B Salt等购自Sigma公司;弹性蛋白酶购自生工生物工程(上海)股份有限公司.
1.2 方 法
1.2.1AmCI,AsATI,AsC/E-1基因合成和表达载体构建
下载AmCI(GenBank ID:XM_006563359),AsATI(GenBank ID:BU585713),AsC/E-1(GenBank ID:U94499)的CDS.通过在线网站(www.genscript.com)对AmCI,AsATI,AsC/E-1的编码框进行密码子优化,在生工生物工程(上海)股份有限公司进行基因合成.基于AmCI,AsATI,AsC/E-1的编码区序列设计引物(表1),以AmCI-AsATI-AsC/E-1序列为模板,分别进行PCR扩增,扩增条件为:95℃预变性5 min;95℃变性30 s,61℃退火30 s,72℃延伸30 s,30个循环;72℃再延伸10 min.PCR产物经1.5%琼脂糖凝胶电泳分离、割胶、酶切回收后,将目的片段连接到p28表达载体中,转入大肠杆菌DH5α菌株,菌液PCR筛选获得阳性克隆后,送生工生物工程(上海)股份有限公司测序.

表1 AmCI,AsATI,AsC/E-1表达载体构建所需引物
1.2.2 突变体表达载体构建
为了将AmCI,AsATI,AsC/E-1的TIL 结构域中的Cys2nd,Cys6th分别替换为Asp,Leu,针对Cys2nd,Cys6th位点设计定点突变引物(表2).提取AmCI-p28,AsATI-p28,AsC/E-1-p28重组表达质粒,并以其为模板,利用对应的定点突变引物、TransStartFastPfuDNA聚合酶或TransStartFastPfuFly DNA聚合酶进行PCR扩增,诱导目的基因突变.扩增条件为:95℃预变性2 min;95℃变性30 s,52℃退火30 s,72℃延伸3 min,18个循环;72℃再延伸10 min.PCR产物经纯化和DpnI酶处理后,转化大肠杆菌DH5α菌株,利用菌液PCR技术筛选阳性克隆,送生工生物工程(上海)股份有限公司测序.将突变体表达载体分别命名为AmCI(C12D)-p28,AmCI(C32L)-p28,AsATI(C15D)-p28,AsATI(C33L)-p28,AsC/E-1(C14D)-p28,AsC/E-1(C33L)-p28.

表2 突变体表达载体构建所需引物
1.2.3 原核表达
将构建的重组表达载体转化至Origami 2(DE3)表达菌株,在37℃,220 r·min-1条件下培养至菌体OD600为0.6~1.0时,加入IPTG至终浓度0.2 mmol·L-1,在16℃诱导表达20 h.6 000 r·min-1离心30 min收集诱导表达后的菌体,用结合缓冲液(20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,p H 8.0)重悬.菌体经过超声破碎、离心,分离上清和沉淀,用16.5%SDS-PAGE进行分离,考马斯亮蓝染色.
1.2.4 蛋白酶抑制剂的胶内活性染色
将诱导表达的蛋白样品与4×Native PAGE上样缓冲液(40 mmol·L-1Tris-HCl,p H 8.0,40%甘油,0.032%溴酚蓝)混合后,利用10%Native PAGE进行分离,然后进行胶内活性染色.蛋白酶抑制剂的胶内活性染色可参照[28-29]报道的方法.将电泳后的凝胶置于蛋白酶溶液中,37℃,45 r·min-1避光振荡孵育30 min.回收蛋白酶溶液,用dd H2O清洗胶,然后37℃避光静置30 min.按照1∶10的体积比加入基质液(200 mg APNE溶于100 m L N,N'-二甲基甲酰胺)和染色液(100 mg Fast Blue B Salt溶于100 mL 含20 mmol·L-1CaCl2,p H 8.0的100 mmol·L-1Tris-HCl缓冲液)的混合液,37℃,45 r·min-1避光孵育15 min.弃掉染色液,加入dd H2O清洗胶面以终止反应.
1.2.5 三维结构模拟
在PDB中搜索AmCI(1ccv.1.A),AsATI(1atd.1.A)和AsC/E-1(1eai.1.C)序列作为模板,在SWISS-MODEL(https://swissmodel.expasy.org/)同源建模在线软件构建AmCI,AsATI和AsC/E-1突变体的三维结构模型,使用QMEANDisCo对模型进行评估[30-32],QMEANDisCo值在0~1之间,数字越高表示可靠性越高.利用分子视图软件Py MOL显示三维结构[33-34].
2 结果与分析
2.1 AmCI,AsATI,AsC/E-1的密码子优化与基因合成
将AmCI,AsATI和AsC/E-1成熟体蛋白对应的编码序列进行密码子优化后,合成在1条DNA序列AmCI-AsATI-AsC/E-1上(图1).AmCI成熟体蛋白含有56个氨基酸,理论分子量为5 972.81 Da,等电点为4.77;AsATI成熟体蛋白含有62个氨基酸,理论分子量为6 797.82 Da,等电点为7.7;AsC/E-1成熟体蛋白含有63个氨基酸,分子量为6 861.74 Da,等电点为5.22.

图1 AmCI,AsATI,AsC/E-1的密码子优化与基因合成
2.2 AmCI,AsATI,AsC/E-1表达载体构建
为了获得AmCI,AsATI和AsC/E-1重组蛋白用于后续的研究,对这3个基因进行了载体构建.以合成序列AmCI-AsATI-AsC/E-1为模板,扩增出含限制性核酸内切酶识别位点的目的片段.利用琼脂糖凝胶电泳对PCR产物进行检测,结果显示分别扩增出192,210,213 bp的目的条带(图2(a)).将扩增出的目的片段连接至p28表达载体中,得到重组表达质粒AmCI-p28,AsATI-p28,AsC/E-1-p28.菌液PCR检测结果显示,均出现1条单一的目的条带,与预期大小一致(图2(b)).经测序,重组表达载体构建成功.
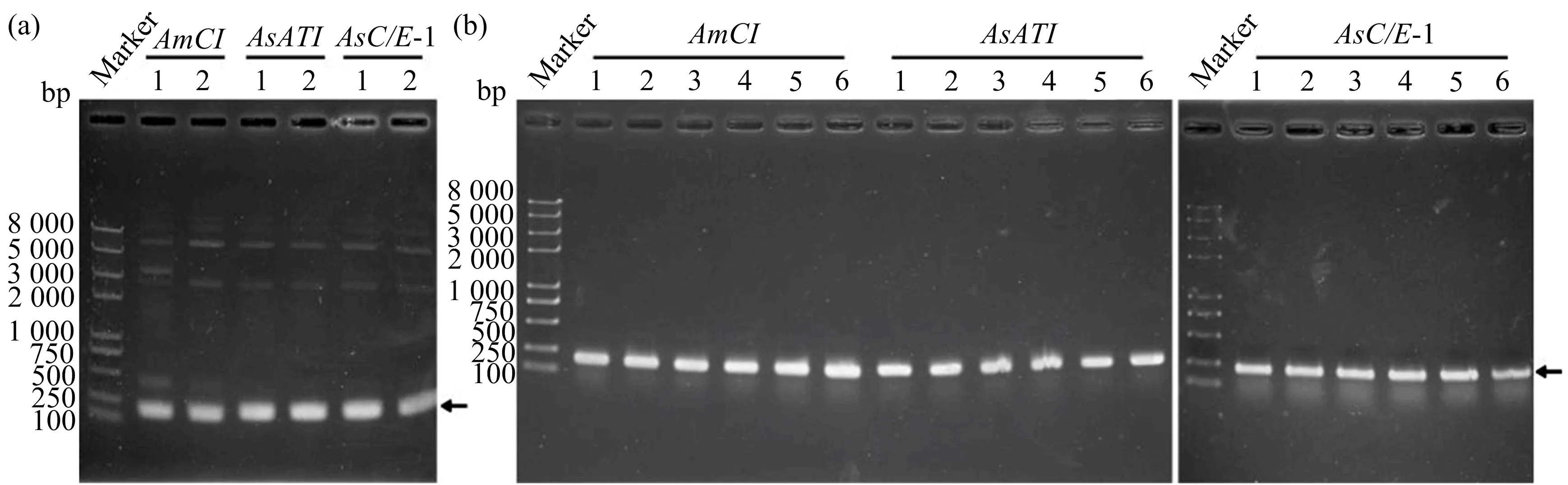
图2 AmCI,AsATI,AsC/E-1的原核表达载体构建
2.3 AmCI,AsATI,AsC/E-1的突变体表达载体构建
将AmCI(GenBank ID:XP_006563422),AsATI(GenBank ID:P19398),AsC/E-1(GenBank ID:P07851)蛋白与家蚕BmSPI38(GenBank ID:KP987266)和BmSPI39(GenBank ID:KP987267)的TIL结构域进行多序列比对.多序列比对结果表明,AmCI,AsATI,AsC/E-1的TIL结构域中都具有10个保守的Cys残基,形成5个二硫键桥(图3(a)).家蚕BmSPI38和BmSPI39的TIL结构域只有8个Cys残基,缺失的Cys2nd,Cys6th残基分别被Asp,Leu替代.为了探究Cys2nd-Cys6th对典型TIL类蛋白酶抑制剂AmCI,AsATI,AsC/E-1的抑制活性及特异性的影响,利用点突变技术,分别将AmCI中Cys2nd(Cys12)、AsATI中Cys2nd(Cys15)、AsC/E-1中Cys2nd(Cys14)突变为Asp;AmCI中Cys6th(Cys32)、AsATI中Cys6th(Cys33)、AsC/E-1中Cys6th(Cys33)突变为Leu(图3(b)).提取AmCI-p28,AsATIp28和AsC/E-1-p28重组表达质粒,进行琼脂糖凝胶电泳检测,结果显示质粒状态良好,可作为模板用于后续定点突变PCR(图3(c)).对AmCI(C12D),AmCI(C32L),AsATI(C15D)、AsATI(C33L),AsC/E-1(C14D)和AsC/E-1(C33L)的点突变PCR产物进行电泳分析,在表观分子量约5 400 bp处检测到单一的目的条带,与预期大小基本一致(图3(d)).经测序验证,AmCI,AsATI,AsC/E-1的突变体表达载体构建成功.
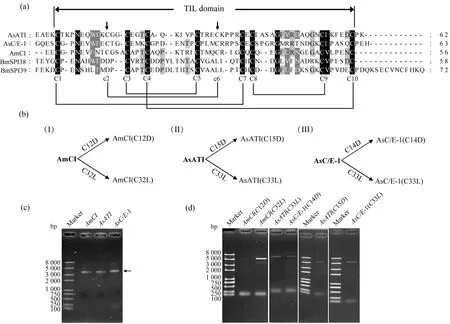
图3 AMCI,ASATI,ASC/E-1突变体的表达载体构建
2.4 AmCI,AsATI,AsC/E-1及其突变体的原核表达
为了获得AmCI,AsATI,AsC/E-1及其突变体蛋白,将构建的重组表达载体转入大肠杆菌细胞中进行诱导表达.重组表达的AmCI,AsATI,AsC/E-1蛋白理论分子质量分别为7 115.10,7 940.10,8 004.02 Da.SDS-PAGE结果表明,AmCI及其突变体蛋白在上清中低量表达,表观分子量约7 k Da,与单体大小一致(图4(a)).AsATI及其突变体蛋白以单体形式在上清中高量表达,包涵体中低量表达,表观分子量约为8 kDa(图4(b)).AsC/E-1及其突变体蛋白在上清中高量表达,在包涵体中低量表达,表观分子量约为16 kDa,与其二聚体大小基本一致(图4(c)).上述结果表明,AmCI,AsATI,AsC/E-1及其突变体蛋白在Origami 2(DE3)菌株中成功表达.
2.5 AmCI,AsATI,AsC/E-1对不同蛋白酶的抑制活性
除了已报道的活性之外,为了探究AmCI,AsATI,AsC/E-1是否还具备对其他蛋白酶的抑制活性,选取胰凝乳蛋白酶、胰蛋白酶、弹性蛋白酶和枯草杆菌蛋白酶进行抑制活性分析.蛋白酶抑制剂胶内活性染色结果表明(图5),AmCI不仅能够抑制胰凝乳蛋白酶活性,还能强烈抑制弹性蛋白酶和枯草杆菌蛋白酶活性,但对胰蛋白酶没有抑制活性;AsATI仅能抑制胰蛋白酶活性,对胰凝乳蛋白酶、弹性蛋白酶和枯草杆菌蛋白酶没有抑制活性;AsC/E-1不仅能够抑制强烈胰凝乳蛋白酶和弹性蛋白酶活性,还能强烈抑制枯草杆菌蛋白酶活性,而对胰蛋白酶无抑制活性.

图5 AmCI,AsATI,AsC/E-1的胶内活性染色分析
2.6 AmCI,AsATI,AsC/E-1突变体的胶内活性染色分析
为了探究Cys2nd-Cys6th对典型TIL 类蛋白酶抑制剂抑制活性和抑制特异性的影响,对AmCI,AsATI,AsC/E-1中Cys2nd和Cys6th进行替换,分析突变前后的蛋白酶抑制剂的抑制活性和特异性的变化.胶内活性染色结果表明,与AmCI相比,AmCI(C12D),AmCI(C32L)对胰凝乳蛋白酶、胰蛋白酶和枯草杆菌蛋白酶的抑制活性完全丧失(图6(a));与AsATI相比,AsATI(C15D)对胰蛋白酶的抑制活性完全丧失,AsATI(C33L)对胰蛋白酶的抑制活性大大降低,AsATI(C15D)和AsATI(C33L)均获得了微弱的枯草杆菌蛋白酶抑制活性(图6(b));与AsC/E-1相比,AsC/E-1(C14D),AsC/E-1(C33L)对胰凝乳蛋白酶、胰蛋白酶和枯草杆菌蛋白酶的抑制活性完成丧失(图6(c)).上述结果表明,二硫键桥Cys2nd-Cys6th对典型TIL类蛋白酶抑制剂AmCI,AsATI,AsC/E-1的固有活性的维持极为重要,对其抑制特异性的改变也有一定的影响.

图6 AmCI(a),AsATI(b),AsC/E-1(c)及其突变体对不同蛋白酶的抑制活性
2.7 AmCI,AsATI,AsC/E-1及其突变体的三维结构分析
为探究二硫键桥(Cys2nd-Cys6th)对蛋白三维结构的影响,利用SWISS-MODEL同源建模软件对AmCI,AsATI,AsC/E-1突变体蛋白进行了三维结构预测,QMEANDisCo>0.6说明结果是可靠的,QMEANDisCo值越高,结构预测越可靠.预测结果:AmCI(C12D)和AmCI(C32L)三维结构的QMEANDisCo值分别为0.85,0.86;AsATI(C15D)和AsATI(C33L)三维结构的QMEANDisCo值分别为0.79,0.82;AsC/E-1(C14D)和AsC/E-1(C33L)三维结构的QMEANDisCo值分别为0.89,0.88.AmCI,AsATI,AsC/E-1及其突变体的三维结构中皆有2个反平行的β折叠片和无规则卷曲结构.AmCI三维结构中,第1个β折叠片由β1(E7~N10)和β2(I34~C38)组成,第2个由β3(L43~N45)和β4(G48~V51)组成,α螺旋由P53~N55组成(图7(a));AmCI(C12D)和AmCI(C32L)的三维结构中,第1个β折叠片由β1(E7~N10)和β2(G35~C38)组成,第2个由β3(L43~N45)和β4(G48~V51)组成(图7(a)).AsATI,AsATI(C15D)和AsATI(C33L)三维结构中,第1个β折叠片由β1(Q11~T13)和β2(R37~E39)组成,第2个由β3(F46~D49)和β4(G52~K56)组成,α螺旋由A42~A44组成(图7(b)).AsC/E-1,AsC/E-1(C14D)和AsC/E-1(C33L)三维结构中,第1个β折叠片由β1(V10~T12)和β2(S37~E39)组成,第2个由β3(M46~T49)和β4(G52~P56)组成(图7(c)).AmCI,AsATI,AsC/E-1突变前整个结构包含5个二硫键桥,保持了蛋白质的刚性结构和稳定性,突变后仅有4个二硫键桥.AmCI突变后,β2有区别,AmCI中β2由5个氨基酸残基组成,AmCI(C12D)和AmCI(C32L)中β2由4个氨基酸残基组成,而且没有α螺旋.AsATI和AsC/E-1突变前后,都具有2个反向平行的β折叠片,碳链主链骨架基本一致.需要指出的是,AmCI,AsATI,AsC/E-1突变前后突变氨基酸残基的R侧链长度不同,突变后二硫键桥Cys2nd-Cys6th无法形成.突变后功能丧失,推测是二硫键桥缺失导致其高级结构的柔性增加,P1残基位于中间,这可能会增加反应中心的灵活性,并影响其抑制特异性和活性.

图7 AmCI,AsATI,AsC/E-1及其突变体蛋白叠加后的三维结构比较
3 讨论
前人从蜜蜂、蛔虫中分离纯化到TIL类蛋白酶抑制剂AmCI,AsATI和AsC/E-1,并对其抑制活性进行了初步分析,受限于纯化工艺和活性检测手段,人们对上述抑制剂的活性和生理功能的认识还十分有限,限制了该类抑制剂的功能研究与开发利用.笔者通过基因工程手段,成功获得了有活性的AmCI,AsATI和AsC/E-1及其突变体蛋白,并结合蛋白酶抑制剂胶内活性染色技术,探讨了其结构中二硫键桥Cys2nd-Cys6th对典型TIL 类蛋白酶抑制剂的抑制活性和抑制特异性的影响.研究发现AmCI和AsC/E-1除了已报道活性之外,还具有对其他蛋白酶的强抑制活性,并证实了二硫键桥Cys2nd-Cys6th对典型TIL类蛋白酶抑制剂AmCI,AsATI,AsC/E-1的固有活性的维持和抑制特异性改变极为重要.
之前的研究皆是利用层析技术从生物体中直接纯化AmCI,AsATI,AsC/E-1蛋白[10,12,23],不仅纯化工艺复杂,而且还会受到内源蛋白酶和抑制剂等诸多因素干扰,很大程度上影响了上述抑制剂的活性测定和生理功能探究.笔者首次利用原核表达系统获得有生物活性的AmCI,AsATI和AsC/E-1及其突变体蛋白,并结合蛋白酶抑制剂胶内活性染色技术分析了AmCI,AsATI和AsC/E-1的抑制活性,这不仅为典型TIL类抑制剂的高效获得开辟了新途径,还可以避免内源蛋白污染、纯化过程中引入的不利因素对测定结果的影响.值得注意的是,AsC/E-1及其突变体蛋白的单体分子量约为8 kD,而SDSPAGE检测结果显示其表观分子量约为16 kD,与二聚体大小一致(图4(c)),推测AsC/E-1及其突变体蛋白发生多聚化现象,活性染色结果也证实了这一点(图5(a)和图5(d)).TIL蛋白酶抑制剂富含半胱氨酸残基,在还原剂和SDS 存在条件下倾向形成多聚体,这在其他TIL 类家族中存在类似现象[27,35].
Bania等[12]利用天然纯化的技术,发现AmCI不仅能强烈抑制胰凝乳蛋白酶,还能较强地抑制组织蛋白酶G的活性,对弹性蛋白酶仅有微弱抑制活性.笔者采用胶内活性染色技术,证实AmCI也能够强烈抑制胰凝乳蛋白酶活性,这与前人研究结果一致.需要指出的是,AmCI还能强烈抑制弹性蛋白酶和枯草杆菌蛋白酶活性(图5),与Bania的研究存在差异,这可能与Bania的AmCI获取方式和检测手段不同有关.胶内活性染色证实,AsATI能抑制强烈胰蛋白酶活性(图5(b)),这与Goodman等[23]的研究结果一致.笔者的研究发现,AsC/E-1能够强烈抑制胰凝乳蛋白酶和弹性蛋白酶活性(图5(a)和图5(c)),与Peanasky等[24]的研究结果一致;而AsC/E-1对枯草杆菌蛋白酶有强烈抑制活性的研究结果(图5(d))却与Peanasky等的研究结果有差异.
多数TIL家族蛋白酶抑制剂的TIL结构域中含有10个保守的Cys残基,形成5对二硫键桥[10,18],并对组织蛋白酶、胰蛋白酶、胰凝乳蛋白酶和弹性蛋白酶等有抑制活性.已有的研究结果表明,TIL类蛋白酶抑制剂的抑制活性和特异性可能由Cys2nd和Cys6th及反应中心的P1和P1'氨基酸残基的理化性质共同决定[16,27,36].家蚕TIL类蛋白酶抑制剂BmSPI37,BmSPI38和BmSPI39的TIL结构域中缺少第2位和第6位Cys残基,上述蛋白酶抑制剂对微生物蛋白酶有强烈抑制作用,但对胰蛋白酶和胰凝乳蛋白酶无抑制作用[27,37].破坏AmCI,AsATI和AsC/E-1的二硫键桥Cys2nd-Cys6th后,它们原有的抑制活性都极大降低,提示Cys2nd-Cys6th对AmCI,AsATI和AsC/E-1的固有活性维持至关重要.值得注意的是,AsATI突变后产生了微弱的枯草杆菌蛋白酶抑制活性.家蚕蛋白酶抑制剂BmSPI38和BmSPI39的TIL结构域仅有4个二硫键桥,缺少二硫键桥Cys2nd-Cys6th,该抑制剂能够强烈抑制枯草杆菌蛋白酶活性,但不能抑制胰蛋白酶和胰凝乳蛋白酶活性,提示Cys2nd-Cys6th二硫键桥对TIL类蛋白酶抑制剂的抑制特异性也有重要影响[28].笔者课题组前期研究发现,家蚕蛋白酶抑制剂BmSPI38和BmSPI39的TIL结构域Cys2nd和Cys6th缺失,它们抑制了微生物蛋白酶和白僵菌孢子的萌发.引入Cys2nd和Cys6th后,BmSPI38和BmSPI39显著降低了对微生物蛋白酶的抑制活性,Cys2nd-Cys6th的缺失对BmSPI38和BmSPI39微生物蛋白酶抑制活性的获得至关重要[27].用Arg或Lys取代P1残基不仅降低了BmSPI38和BmSPI39的内在活性,而且还获得更强的胰蛋白酶抑制活性和较弱的胰凝乳蛋白酶抑制活性,提示蛋白酶抑制剂抑制活性和抑制特异性受到P1残基和Cys2nd-Cys6th二硫键桥的影响[38].
4 结束语
笔者成功实现了AmCI,AsATI,AsC/E-1及其突变体蛋白在大肠杆菌中的表达,证实了二硫键桥Cys2nd-Cys6th的缺失能改变TIL类蛋白酶抑制剂的活性和抑制特异性,对TIL类蛋白酶抑制剂至关重要.该研究不仅为AmCI,AsATI和AsC/E-1的生理功能研究奠定基础,还可为TIL类蛋白酶抑制剂活性和特异性的定向改造提供依据.
