FSHR基因多态性、BMI及性激素与多囊卵巢综合征发病风险的相关性分析
2024-02-29昝志芳土增荣王淇蓉段毓刘建兵李莉
昝志芳,土增荣,王淇蓉,段毓,刘建兵,李莉*
1山西医科大学基础医学院医学细胞生物与遗传学教研室,山西太原 030001;2山西医科大学第一医院生殖医学科,山西太原 030001
多 囊 卵 巢 综 合 征(polycystic ovary syndrome,PCOS)是育龄妇女常见的内分泌及代谢疾病[1‐3],全球患病率为4%~18%[4‐5],我国的患病率约为5.6%[6],占无排卵性不孕症的75%[7],且发病率呈逐年上升趋势。PCOS临床表现为月经稀发或闭经、无排卵性不孕、肥胖、痤疮和多毛等[8‐9]。远期并发症有代谢性疾病、子宫内膜癌、糖尿病、高血压及不良的妊娠结局等[9‐10],严重危害女性的生活质量和生育能力,是生殖领域面临的巨大挑战之一[11]。目前普遍认为,PCOS的发生与遗传、环境、生活习惯及心理健康等密切相关,但其发病机制及影响因素至今尚未完全阐明、诊断标准尚未统一[12],因此,进一步探讨PCOS的易感基因及多态性对于更好地了解该疾病具有重要意义。PCOS的临床表现具有高度异质性,其发生发展与机体紊乱的激素水平密切相关[13],肥胖也会增加特定妊娠和分娩并发症的风险[14]。越来越多的证据表明,PCOS是一种多基因复杂病[15‐16],而卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)基因异常在PCOS 发病中扮演了重要角色。FSHR基因的rs2268361和rs2349415是与PCOS具有显著关联的单核苷酸多态性(single nucleotide polymorphism,SNP)位点[17],目前国内外已针对FSHR基因SNP位点的多态性进行了广泛研究,但结论存在一些矛盾[18],主要体现在FSHR基因多态性与PCOS是否具有相关性及其机制方面。本研究通过分析PCOS 患者与健康对照者的外周血及卵泡液、检测体重指数(body mass index,BMI)及血清性激素指标,探究FSHR基因rs2268361 和rs2349415 位点的多态性分布,以及该基因不同基因型个体卵巢颗粒细胞中FSHRmRNA 的表达水平及其与PCOS 发病的关系,以期为PCOS 的早期诊断及治疗提供相关分子标志。
1 资料与方法
1.1 研究对象 本研究为病例对照研究。选择2021年3—8月在山西医科大学第一医院生殖医学科诊治的213 例PCOS 患者作为PCOS 组。纳入标准:(1)PCOS 诊断符合2003 年《鹿特丹共识》[19];(2)年龄20~40 岁女性;(3)非妊娠育龄期;(4)近3 个月内未服用过影响激素变化的药物。排除标准[20]:(1)其他原因导致的高雄激素表现或月经异常;(2)临床确诊为高泌乳素血症、甲状腺功能障碍、糖尿病等疾病;(3)严重脏器功能不全、恶性肿瘤等疾病;(4)伴有子宫疾病、反复流产、染色体异常等。同期纳入同一医院中身体健康、由于输卵管因素或男方因素来院检查的207名健康非PCOS女性作为对照组。采用随机号码表法(即利用随机号码表抽取样本的方法)从上述PCOS 组与对照组中随机收集实施体外受精‐胚胎移植者的卵泡液各32例(选择取卵日穿刺的第1个直径≥16 mm 的卵泡,尽量减少卵泡液中混入血液,拾卵后收集废弃的卵泡液),比较两组FSHRmRNA相对表达量。本研究已获山西医科大学伦理委员会审批(批准号:2021GLL87),所有研究对象均已签署知情同意书。
1.2 研究方法
1.2.1 指标检测与外周血DNA提取 测量所有受试者的身高、体重,计算BMI。所有受试者于月经周期第2~5 天(月经稀发或闭经者在B 超检查无优势卵泡时),清晨空腹静息10 min后采集外周静脉血。非抗凝管采血5 ml,EDTA 抗凝管采血2 ml。非抗凝血于30 min 内4000 r/min 离心10 min,取上清液,采用免疫化学发光全自动生化分析仪及配套试剂盒(日本东曹株式会社)检测血清性激素六项[卵泡刺激素(follicle stimulating hormone, FSH)、 黄 体 生 成 素(luteinizing hormone,LH)、雌 二 醇(estradiol,E2)、睾酮(testosterone,T)、孕酮(progesterone,P)、泌乳素(prolactin,PRL)]的水平。抗凝血采集后放置于4 ℃冰箱保存,并在3 d内采用全血DNA提取试剂盒(美国OMEGA 公司)抽提全血DNA,利用微量核酸测定仪测定样本浓度与纯度,选择吸光度值A260/A280比 值 为1.8~2.1,A260/A230>1.5 的DNA 样 本,置 于-20 ℃低温冰箱备用。
1.2.2 DNA扩增与基因分型 利用Primer 5.0软件和NCBI 数据库进行FSHR基因SNP 位点rs2268361 和rs2349415 的引物设计。引物序列:rs2268361,上游5'‐TGGCTTTGATGCTGTGAGAC‐3',下游5'‐CAACA‐TCCACCAATGAAAGATC‐3';rs2349415,上游5'‐AA‐ACTTTATTCATAAAAACAGGTG‐3',下游5'‐ATCTA‐GGACAGTGTCACTGAACTAC‐3'。采用聚合酶链式反应(PCR)扩增DNA:10 µl 的PCR 反应体系中2×TaqMaster Mix 5 µl,模 板DNA 1 µl,上下 游 引物(10 µmol/L)各0.1 µl,高低温内标MIX 0.2 µl,LC Green 0.8 µl,去离子水2.8 µl补充至10 µl;热循环参数:95 ℃ 5 min;95 ℃ 30 s、52 ℃ 30 s、72 ℃ 7 s,循环35 次;72 ℃ 7 min,95 ℃ 30 s,25 ℃ 2 min,94 ℃30 s,24 ℃ 4 min。使用高分辨熔解曲线分析(HRM)系统(美国Idaho Technology 公司)进行基因分型,所有结果均经双人核对并对有疑问的样本进行测序验证。为保证准确的基因分型结果,每个SNP 位点的基因型随机选择3 个样本,对PCR 产物进行测序验证。测序由北京华大基因科技有限公司完成。
1.2.3 外周血总RNA提取与实时定量聚合酶链反应(qRT‐PCR) Trizol 法提取总RNA,利用琼脂糖凝胶电泳分析RNA完整性及是否存在污染,利用微量核酸测定仪测定样本浓度和纯度,选择吸光度值A260/A280比值在1.8~2.1,A260/A230>1.5 的RNA 样本,置于-80 ℃低温冰箱保存,检测合格的样本采用反转录试剂盒(日本TaKaRa 公司)反转录为cDNA。FSHR基因引物序列:上游5'‐GTGCATTCAATGGAACCCAAC‐TAGA‐3', 下 游5'‐TCCGTGGAAAACATCATTAGGC‐3'。用SYBR Green® Premix Ex TaqTMⅡ试剂盒(日本TaKaRa公司)进行qRT‐PCR 反应,每个样本设置3 个复孔。采用实时定量PCR 仪(美国Thermo Fisher Scientific 公司)检测FSHRmRNA的表达水平。用内参β-actin、目的基因FSHR基因相对拷贝数,计算2-ΔΔCt,比较PCOS组与对照组FSHR基因mRNA相对表达量。
1.2.4 卵巢颗粒细胞总RNA 提取与qRT‐PCR 收集受试者取卵日穿刺的第1个直径≥16 mm的卵泡(尽量减少血液混入),并将卵泡液混匀后置于15 ml 离心管中,1500 r/min离心10 min,将红细胞层上方的白色絮状物吸出,置于1.5 ml EP 管中,添加红细胞裂解液500 μl,充分震荡,冰上静置5 min。加1 ml PBS重悬沉淀,1500 r/min离心5 min,弃上清,重复2~3次至沉淀为白色。使用Trizol法提取卵泡液中颗粒细胞总RNA,反转录为cDNA,进行qRT‐PCR 反应,并计算FSHR基因mRNA相对表达量。
1.3 指标分析 比较两组间各临床指标的差异,并分析各指标之间的相关关系;比较两组FSHR基因rs2268361和rs2349415位点的基因型和等位基因频率分布;在探究单一变量与PCOS 发病的关系时,因无法消除其余指标对PCOS 发病的影响,本研究以年龄、BMI、E2、P、PRL、LH、FSH、LH/FSH为自变量,以是否发生PCOS 为因变量,构建多因素logistic回归方程分析性激素、BMI、SNPs与PCOS发生的相关性;采用qRT‐PCR 检测PCOS 组与对照组外周血和部分受试者卵泡液中卵巢颗粒细胞中FSHRmRNA 水平,探究rs2349415 位点不同基因型是否影响FSHRmRNA的表达水平。
1.4 统计学处理 采用SPSS 26.0 和R 语言对数据进行统计分析。计量资料以±s表示,组间比较采用独立样本t检验;计数资料以例(%)表示,组间比较采用χ2检验。采用多因素logistic回归分析PCOS发生易感的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床指标间的关系 Pearson 相关分析显示,LH 与LH/FSH 呈明显正相关(r=0.88,P<0.05),FSH 与LH/FSH 呈弱负相关(r=-0.30,P<0.05);其他指标之间两两相关系数均较低(中位数0.06),且差异无统计学意义,表明各指标间相互独立(图1)。
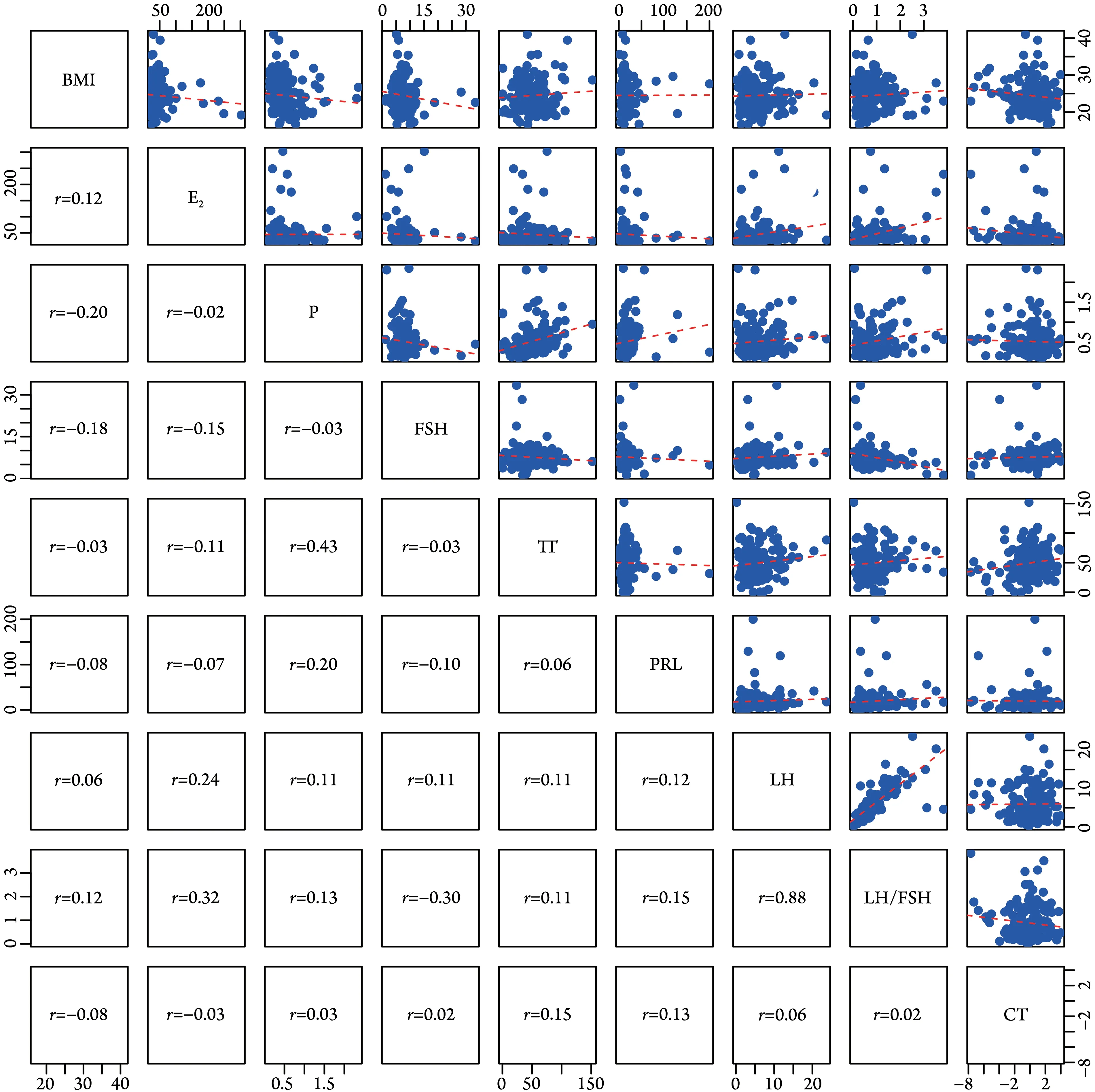
图1 临床指标间散点图及其Pearson相关系数Fig.1 Scatter diagram of clinical indicators and Pearson correlation coefficient
2.2 两组临床指标比较 PCOS 组体重、BMI、E2、LH、T 及LH/FSH 均明显高于对照组(P<0.05),而FSH 水平明显低于对照组(P<0.001);两组年龄、身高、PRL、P 水平比较差异无统计学意义(P>0.05,表1)。
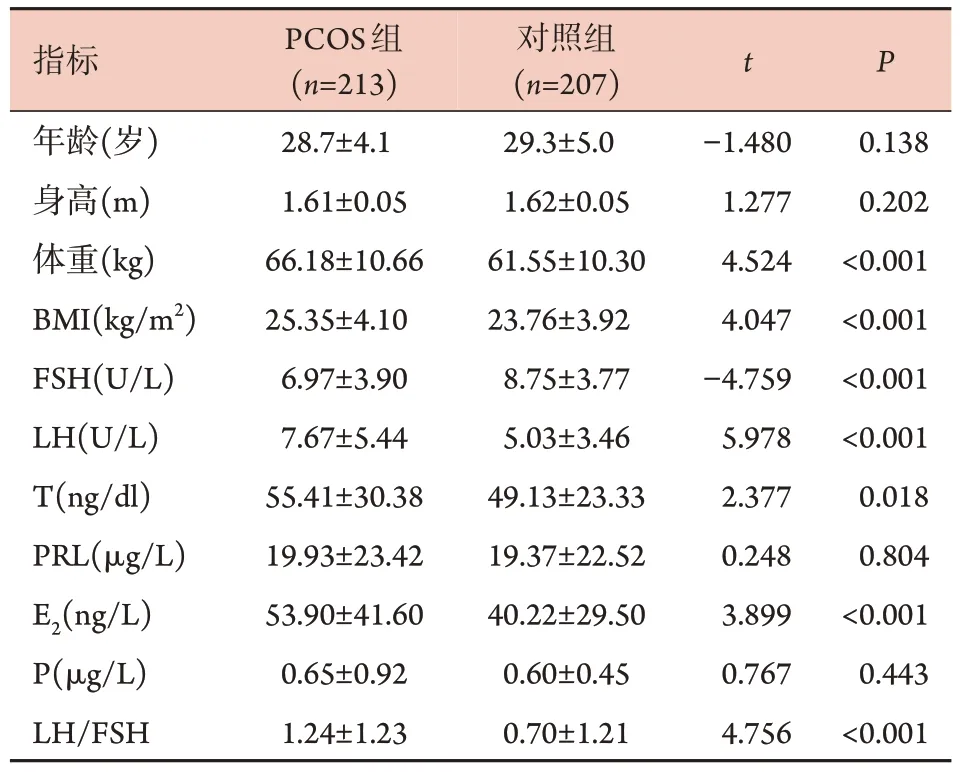
表1 PCOS组与对照组临床指标比较(x±s)Tab.1 Comparison of clinical indicators between the PCOS and control groups (x±s)
2.3 两组FSHRSNP 位点基因型和等位基因频率分布比较 HRM 检测结果显示,对照组FSHR基因rs2268361 和rs2349415 多态性位点符合Hardy‐Weinburg 平 衡。PCOS 组 与 对 照 组rs2268361 位 点 的CC、CT、TT 3种基因型频率及C、T等位基因频率差异均无统计学意义(P>0.05);两组rs2349415 位点的CC、CT、TT 基因型频率(χ2=7.529,P=0.023)及C、T 等位基因频率(χ2=6.044,P=0.014)差异有统计学意义(表2)。
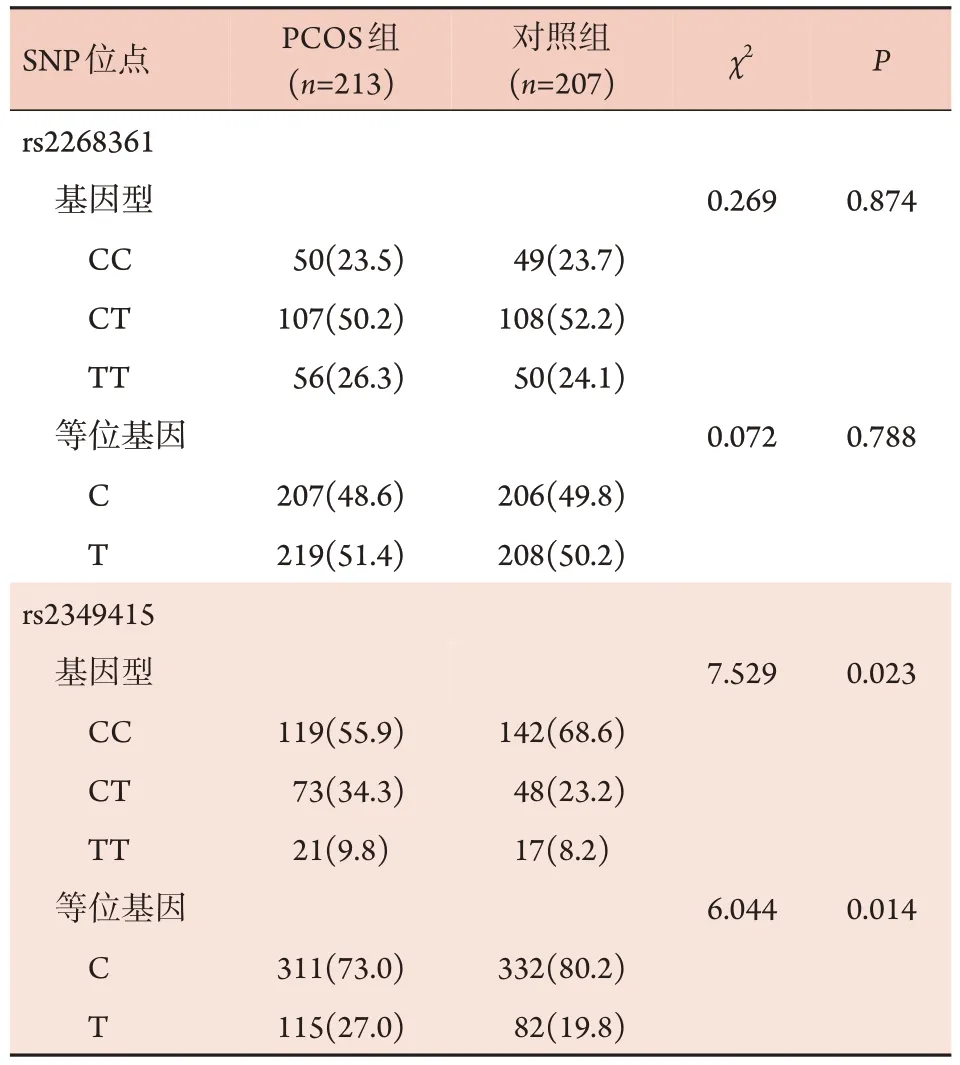
表2 PCOS组与对照组FSHR基因型和等位基因频率分布比较[例(%)]Tab.2 Comparison of frequency distribution of FSHR genotypes and alleles between PCOS and control groups [n(%)]
2.4 多因素logistic回归分析PCOS发生的相关因素多因素logistic 回归分析显示,高水平的BMI(OR=1.112, 95%CI 1.059~1.167)、 E2(OR=1.009, 95%CI 1.003~1.014)、LH(OR=1.178,95%CI 1.114~1.247)均 为PCOS 发生的独立危险因素,而相对高水平的FSH(OR=0.832,95%CI 0.768~0.901)则可降低PCOS 的发生风险(P<0.05);与rs2349415 位点CC 基因型相比,携带CT 基因型可增加PCOS 的发生风险(P=0.009);经校正年龄、BMI后,rs2349415位点CT基因型仍为PCOS发生的独立危险因素(OR=1.933,95%CI 1.275~2.932)(图2)。
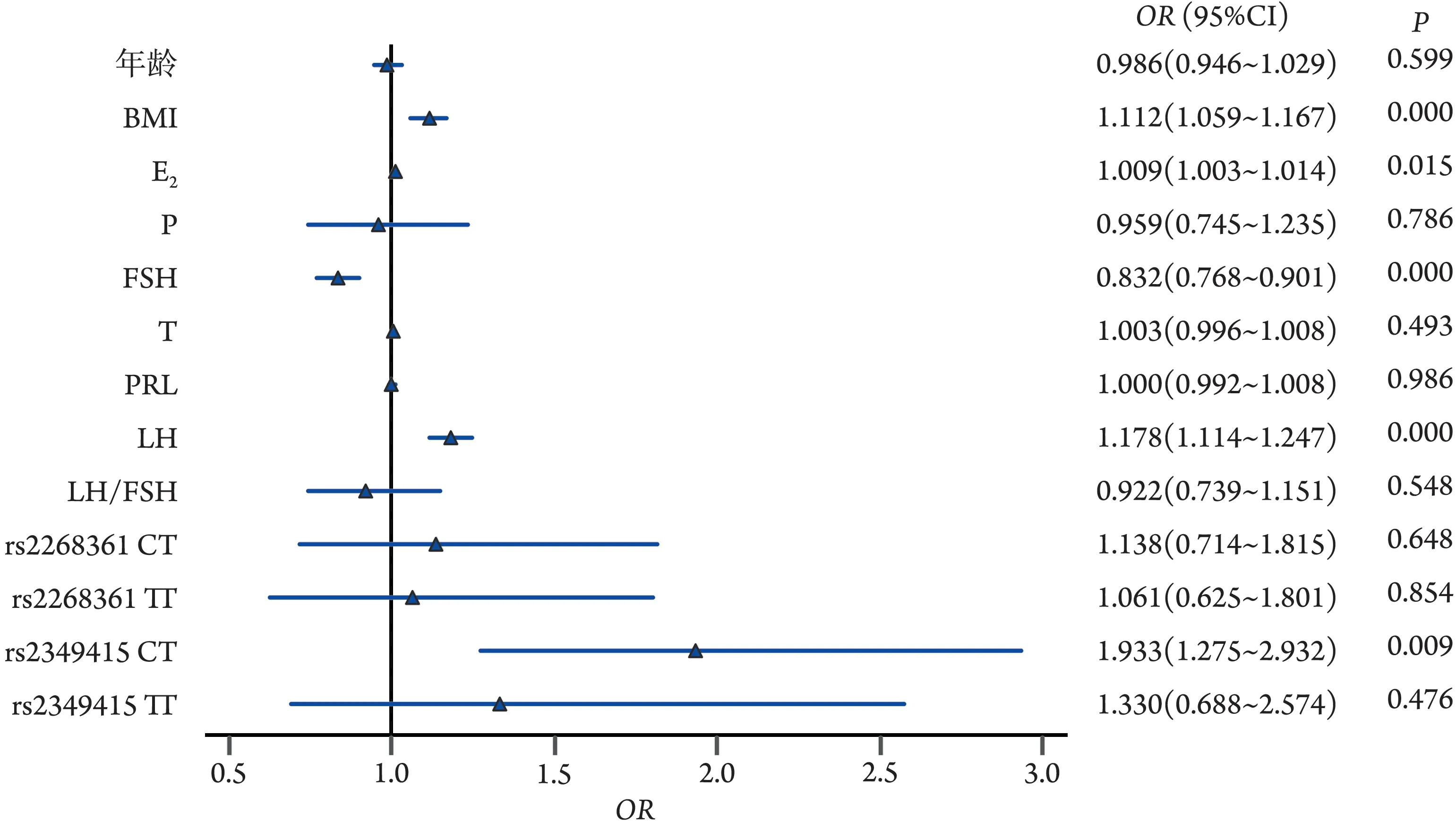
图2 Logistic回归分析临床指标和SNP位点比值比(OR)的森林图Fig.2 Logistic regression analysis of odds ratio (OR) of clinical indicators and genotypes of SNP
2.5 两组rs2349415 位点的多态性及FSHRmRNA 表达水平 在外周血中,FSHRmRNA 水平在PCOS 组与对照组间、在rs2349415 位点CC、CT、TT 3 个基因型间差异均无统计学意义(图3A、B);在卵巢颗粒细胞中,PCOS 组FSHRmRNA 水平明显高于对照组(P=0.004),rs2349415 位 点 上TT 基 因 型 的FSHRmRNA 表达水平高于CC 和CT 基因型,差异有统计学意义(P=0.002;P=0.035;图3C、D)。
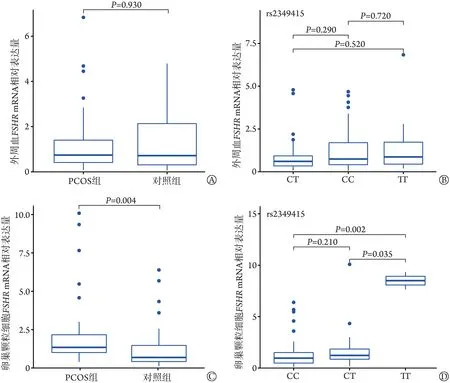
图3 两组间及rs2349415位点不同基因型个体的外周血及卵巢颗粒细胞中的FSHR mRNA表达水平Fig.3 FSHR mRNA expression levels in peripheral blood and ovarian granulosa cells of PCOS and control groups and individuals with different genotypes at rs2349415
3 讨 论
调整生活方式已逐渐被公认为是PCOS 的一线治疗方法,可缓解患者的代谢功能紊乱并改善生殖障碍[21]。在PCOS 的发生发展过程中,肥胖既是临床特征,又参与PCOS病理机制形成的各个环节[22]。肥胖女性性激素结合球蛋白水平下降[23],可使雄激素水平升高,进而破坏排卵功能[24]。本研究PCOS组的BMI 明显高于对照组,进一步提示肥胖是导致PCOS易感性增高的原因之一,建议肥胖PCOS患者通过减重来达到有效的干预。PCOS组LH、LH/FSH及T水平较对照组明显升高,而FSH水平明显下降,与以往的研究结果基本一致[25]。雄激素为卵泡发育与成熟所必需的条件,但PCOS 患者异常增高的雄激素水平反而阻碍了优势卵泡的发育,雄激素过量也可能提示PCOS 的潜在易感性增加[26]。本研究中PCOS患者E2水平明显升高,除与患者体内雌酮(E1)明显增多,与E2相互转化外,也可能与PCOS 患者基础窦卵泡数量较多、所分泌的雌激素增加有关。LH和FSH属于糖蛋白激素,可直接作用于卵巢,提高颗粒细胞活性进而加速卵泡发育。PCOS患者垂体对促性腺激素释放激素的敏感性增加,分泌过量的LH,临床上LH/FSH≥2,可辅助诊断PCOS[27]。本研究各临床指标间相关性分析显示,LH与LH/FSH 呈明显的正相关,而FSH 与LH/FSH 呈弱负相关,提示高LH水平紊乱对于协助PCOS诊断更具敏感性。
遗传因素在PCOS 发病中的作用越来越受到关注。最近的全基因组关联研究(genome‐wide association studies,GWAS)发现了18种与PCOS明显相关的遗传变异[18],包括DENND1、INSR、FSHR、LHCGR等基因或附近的变异。FSHR基因位于2p16.3,由10个外显子和9 个内含子组成,是促卵泡激素和性腺发育功能的受体。一项跨种族的Meta 分析结果显示,FSHR的SNP位点rs2268361 T等位基因和rs2349415 T等位基因增加了PCOS 的发病风险[28];针对泰国妇女的大多数研究并未证实FSHR多态性增加PCOS的易 感 性[28];中 国 女 性 的GWAS‐Meta 研 究 发 现,rs2268361 与中国妇女PCOS 易感性明显相关[29];一项针对中国南方汉族的研究发现,在卵巢多囊样变与非多囊样变组间SNP 位点rs2268361 GG 基因型的等位基因分布存在明显差异,而在rs2349415位点上则未发现明显差异[30]。在本研究人群中,FSHR基因rs2268361 位点的等位基因型分别为CC、CT 和TT,PCOS 组中最小等位基因频率C 为48.6%,该位点多态性与PCOS 易感性无明显相关,与一项涉及中国和澳大利亚的跨种族Meta分析发现不一致[28],提示可能在不同人群、种族、民族和地域间存在一定的遗传互作;rs2349415 位点的等位基因组成CC、CT和TT 3 种基因型,PCOS 组中最小等位基因频率T为27.0%,明显高于对照组的19.8%(P=0.014),提示在本研究人群中,rs2349415‐T 等位基因增加了PCOS的发病风险。
FSHR主要由卵巢颗粒细胞分泌,颗粒细胞在原始卵泡的启动和生长发育中起着重要的调控作用[31]。本研究发现,两组外周血中FSHRmRNA表达水平差异无统计学意义,而在卵巢颗粒细胞中PCOS 组FSHRmRNA 表达水平明显高于对照组(P=0.014)。此外,本研究检测了rs2349415位点不同基因型个体卵巢颗粒细胞中FSHRmRNA 的表达水平,结果发现TT 基因型个体FSHRmRNA 表达水平高于CC 和CT基因型,提示不同的基因型可影响FSHR的表达。FSHR基因的多态性一方面影响PCOS 的易感性,另一方面也影响了促排卵治疗时FSHR 对外源性FSH的敏感性[18],FSH‐FSHR相互作用可促进卵巢颗粒细胞分化及卵泡成熟[32‐33],可能影响PCOS的发生,因此,在辅助生殖促排卵用药中,有望依据患者FSHR基因rs2349415位点不同基因型使用不同剂量的外源性FSH,从而指导临床用药。
综上所述,本研究发现,高水平的BMI、E2、LH 以及rs2349415 T 等位基因是PCOS 发生的危险因素,不同的基因型可影响卵巢颗粒细胞FSHRmRNA的表达,为PCOS 的早期筛查与治疗提供了潜在分子标志,对阐明PCOS 的发病机制,以及早期识别与管理提供理论基础。本研究仍存在局限性:纳入的样本量偏小,且为单一的医疗中心。但是本研究为PCOS 的早期筛查提供了一定的科学依据,未来应联合多中心以扩大样本量及地域范围,以期获得更全面的研究结果,对PCOS 患者乃至整个家庭及社会均有重要意义。
