抗核抗体谱对AIH-PBC OS及单纯AIH患者激素应答的影响
2024-02-29李琼田爱平毛永武王富春毛小荣
李琼,田爱平,毛永武,王富春,毛小荣*
1兰州大学第一临床医学院,甘肃兰州 730000;2兰州大学第一医院感染科,甘肃兰州 730000
自身免疫性肝炎(autoimmune hepatitis,AIH)及原发性胆汁性胆管炎(primary biliary cholangitis,PBC)均是因自身免疫系统紊乱引起的慢性肝胆炎性疾病,二者在临床特征及疾病预后方面各有特征[1‐3]。部分患者可同时出现AIH 合并PBC 的生化及病理特征,诊 断 为AIH‐PBC 重 叠 综 合 征(AIH‐PBC overlap syndromes,AIH‐PBC OS)[4]。AIH‐PBC OS 是最常见的肝内自身免疫性疾病的重叠类型。由于遗传背景与致病机制之间存在交叉,自身免疫性肝病(autoimmune liver disease,AILD)也可合并不同的肝外自身免疫系统疾病[5],特别是风湿免疫性疾病。抗核抗体谱(antinuclear antibodies,ANAs)对于风湿系统疾病的病情判断有一定意义,由于免疫共存,其在不同AILD中表达也不同。
AIH发病隐匿,30%的患者诊断时即进展为肝硬化,目前主要通过给予糖皮质激素等行免疫调节治疗。对于确诊的AIH,一般优先推荐泼尼松(龙)[6]。对于AIH‐PBC OS 的治疗,多数学者建议泼尼松(龙)联合熊去氧胆酸(ursodeoxycholic acid,UDCA),既往研究也发现糖皮质激素对此类疾病有一定疗效[7‐9]。但关于表达ANAs 的AIH‐PBC OS 及单纯AIH 患者半年内激素应答情况目前尚未明确。本研究探讨ANAs对AIH‐PBC OS与单纯AIH患者半年内激素应答情况的影响,以协助临床评估ANAs 阳性的AIH‐PBC OS及单纯AIH 患者激素应答情况,早期发现对激素应答不佳的患者,避免患者肝脏损害持续加重或长期大剂量使用激素,从而改善患者预后。
1 资料与方法
1.1 一般资料 选取2018年1月-2021年12月于兰州大学第一医院感染科确诊的AIH‐PBC OS 及单纯AIH 患者为研究对象。纳入标准:(1)行肝穿刺活检及肝病理组织学检查,证实符合AIH‐PBC OS 或AIH病理学损伤模式;(2)给予糖皮质激素治疗,AIH‐PBC OS 患者同时给予UDCA 药物治疗。排除标准:(1)合并病毒性肝炎、药物性肝损伤、酒精性肝病、代谢性肝病及肝豆状核变性等;(2)临床资料及检验检查指标不完整;(3)治疗过程中更换激素为其他免疫抑制剂;(4)使用糖皮质激素半年内自行停用;(5)既往使用糖皮质激素。AIH‐PBC OS诊断参照巴黎标准[10],单纯AIH 诊断参照2021 版亚太肝脏研究协会临床实践指南[4]。所有患者均签署肝脏穿刺活检知情同意书及激素使用知情同意书。
1.2 研究指标及定义 收集入组患者行肝脏穿刺活检确诊时的基本资料,包括年龄、性别、身高、体重及血压,计算体重指数(body mass index,BMI)=体重(kg)/身高2(m2);平均动脉压=舒张压+1/3×(收缩压-舒张压)。同时收集确诊时ANAs 中部分抗体及使用激素时初始、1 个月、3 个月及6 个月时的肝功能、免疫球蛋白等指标,根据谷丙转氨酶(alanine aminotransferase, ALT)、 谷 草 转 氨 酶(aspartate aminotransferase,AST)、免疫球蛋白G(IgG)、免疫球 蛋 白M(IgM)、碱 性 磷 酸 酶(alkaline phosphatase,ALP)及γ‐谷氨酰转移酶(γ‐glutamyl transferase,GGT)水平评估患者半年内激素应答情况。
入组患者糖皮质激素(泼尼松)初始剂量按0.5~1.0 mg/(kg.d)计算(甲泼尼龙剂量根据以下公式确定:1.6 mg 甲泼尼龙=2 mg 泼尼松),激素减量遵循个体化原则。AIH‐PBC OS患者UDCA剂量按照13~15 mg/(kg.d)计算。生物化学指标应答情况参照国际自身免疫肝炎小组的共识[9],并结合本研究的观察指标,激素完全应答定义为:ALT、AST、IgG 水平降至正常范围,ALP、GGT水平下降>40%或降至正常范围。应答不充分定义为:AST、ALT及IgG水平较前下降但未复常。不应答定义为:治疗启动后4 周内血清转氨酶水平下降<40%。
本研究中ANAs包括抗平滑肌抗体(SMA)、抗SS‐A抗体、抗Ro‐52抗体、着丝点B蛋白抗体(CNEP‐B)、抗中性粒细胞浆抗体(PANCA)及抗双链DNA 抗体(dsDNA),以上任意抗体阳性均定义为ANAs阳性。
1.3 研究方法 分析ANAs 阳性及阴性AILD 患者特点,以及ANAs 阳性与阴性不同类型AILD 患者激素应答情况。采用多因素有序logistic 分析AIH‐PBC OS及单纯AIH 患者激素应答结果的影响因素。由于患者GS分期中包含病理损伤模式的因素,为避免共线性影响,病理损伤模式的因素未纳入logistic分析。
1.4 统计学处理 采用SPSS 24.0 软件进行统计分析。正态分布的计量资料以xˉ±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用Mann‐WhitneyU检验;计数资料以例(%)表示,两组间比较采用χ2检验,三组比较采用Kruskal‐WallisH检验;多因素分析采用多因素有序logistic 回归方法。P<0.05 为差异有统计学意义。
2 结 果
2.1 A N A s阳性及阴性A I L D患者特点 共筛选出157 例经肝脏穿刺活检术后确诊为AILD 的患者,根据纳入及排除标准,最终纳入77 例经激素治疗的AILD 患者,分为AIH‐PBC OS 组46 例,单纯AIH 组31 例,其中AIH‐PBC OS 组中ANAs 阳性及阴性者分别有25 例及21 例,单纯AIH 组中ANAs 阳性及阴性者分别有20 例及11 例(图1)。77 例AILD 患者中,ANAs 阳性组中女性患者所占比例高于ANAs 阴性组(P<0.05)。两组患者年龄、平均动脉压、IgG、IgM及AILD 类型方面的差异均无统计学意义(P>0.05,表1)。

表1 ANAs阳性及阴性自身免疫性肝病患者一般资料比较Tab.1 Comparison of general information between ANAs‐positive and negative patients with autoimmune liver disease
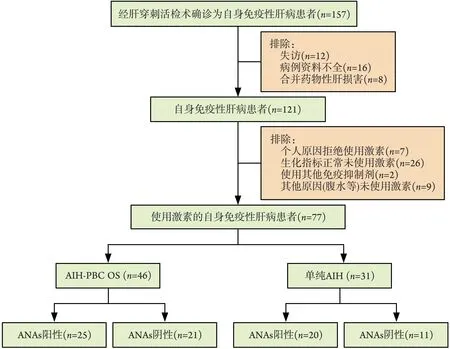
图1 入组患者筛选流程图Fig.1 Flow chart of enrolled patients
2.2 ANAs 阳性与阴性不同类型AILD 患者激素应答情况 46例AIH‐PBC OS患者按ANAs表达情况分为两组,其中ANAs 阳性组25 例,ANAs 阴性组21 例。ANAs 阳性组半年内激素完全应答率低于ANAs 阴性组(44.0%vs.76.2%),而激素不应答率高于ANAs阴性组(20.0%vs.0),差异有统计学意义(P<0.05)。31 例单纯AIH患者按ANAs表达情况分为两组,其中ANAs阳性组20 例,ANAs 阴性组11 例。ANAs 阳性及阴性组激素应答结果差异无统计学意义(P>0.05,图2)。

图2 ANAs阳性与阴性的AIH‐PBC OS(A)及单纯AIH患者(B)激素应答情况Fig.2 Hormonal response in AIH‐PBC OS (A) and AIH‐only (B) patients with positive and negative ANAs
2.3 AIH‐PBC OS及单纯AIH 患者激素应答结果的影响因素 AIH‐PBC OS 患者中,ANAs 的表达对于半年内激素应答结果具有一定影响,ANAs阳性患者激素不应答的可能性为ANAs 阴性患者的8.073 倍,差异有统计学意义(P<0.05,表2)。而单纯AIH患者中,所纳入的因素对激素应答结果的影响差异无统计学意义(P>0.05,表3)。

表2 AIH‐PBC OS患者中不同因素对激素应答结果的影响Tab.2 Influence of different factors on the outcome of hormone response in patients with AIH‐PBC OS

表3 单纯AIH患者中不同因素对激素应答结果的影响Tab.3 Influence of different factors on the outcome of hormone response in patients with AIH‐only
3 讨 论
AILD患者容易出现炎症反应及肝功能损伤,同时由于遗传背景与致病机制之间存在交叉,AILD也可与其他类型自身免疫性疾病合并发生,且种类繁多[5,12]。不同类型AILD 合并肝外自身免疫性疾病的类型不同,以风湿免疫性疾病最为常见[13]。AIH 常合并系统性红斑狼疮等[14],而在AIH‐PBC OS 患者中,干燥综合征的发生率较高[15]。与自身免疫病共存是否影响AILD的自然进程及预后目前尚不明确。
有研究发现,免疫病共存的现象可能会加重炎症反应[16],目前AILD的主要治疗策略为通过糖皮质激素减轻炎症反应。激素应答结果包括生化应答及组织学应答,在临床上,AILD的缓解通过组织学诊断最精确,需要进行肝脏活检,但这与当前的临床实际不符。目前,临床实践中肝脏活检仅在诊断时进行,患者很少接受后续活检。正如本研究中,仅有少数患者行二次肝脏穿刺以评估肝脏炎症及纤维化程度,故无法进行组织学应答的评估,仅进行生化应答评估。国际专家根据血清转氨酶及免疫球蛋白水平的变化,就AILD 的生化应答结果达成共识,包括完全生化应答、应答不充分、无应答[11,17]。在临床上,治疗应答效果在很大程度上取决于患者相关因素及AILD的严重程度。应答不充分并不一定意味着治疗方案应该改变,但可能对预后评估有部分价值,而对于无应答的患者,应探讨其依从性,对AILD的诊断提出质疑,并由肝脏病理学家重新评估组织学。由于合并其他类型自身免疫性疾病后的免疫共存原因,AILD 患者可不同程度表达ANAs,但免疫共存时ANAs阳性是否影响患者激素应答目前尚未明确。本研究发现,ANAs阳性对于单纯AIH的激素应答无明显影响。
本研究结果显示,ANAs 对于AIH‐PBC OS 患者的激素应答有一定影响,ANAs阳性患者半年内激素完全应答率明显低于ANAs阴性患者,激素不应答率明显高于ANAs阴性患者。AIH‐PBC OS 是AILD中最常见的重叠综合征类型,虽然目前发病机制尚未完全明确,但存在潜在的免疫功能障碍,遗传、免疫、环境与激素之间的相互作用在疾病的发展中起一定作用。表达ANAs 的AIH‐PBC OS 患者可被视为肝内及肝外自身免疫性疾病的多重重叠患者,上述因素之间的多重相互作用可能导致肝外自身免疫性疾病患病率的可变性及病情变化的不确定性,对患者的病程及激素应答可能产生不良影响。来自韩国的研究显示,AIH‐PBC OS 患者的激素生化应答较单纯AIH 患者差[5],并且与单纯AIH 患者相比,AIH‐PBC OS患者发生肝硬化的速度可能更快,预后更差[5,18]。同时,在不同的HLA‐DR 等位基因中,HLA-DR7在AIH‐PBC OS 中较在AIH 患者中更常见[19]。HLA‐DR7增多反映T 细胞增殖活跃,提示炎症反应加重。综上,AIH‐PBC OS 患者炎症反应较单纯AIH患者可能加重,当此类患者出现ANAs阳性时,免疫系统可能遭受进一步破坏,一定程度上会影响激素的应答结果。
本研究存在以下局限性:首先,为回顾性研究,未对患者进行长期随访,且目前仅少量患者完成整个疗程,同时行二次肝脏穿刺活检评估肝脏炎症及纤维化程度,故无法大样本比较激素长期应答的效果。其次,为单中心研究,选取的单纯AIH 应用激素患者样本量较少。因此,未来仍需大样本、前瞻性及长期随访研究加以证实。
综上所述,在AIH‐PBC OS 患者中,ANAs 阳性者半年内激素应答效果欠佳。而单纯AIH 患者中,ANAs对激素应答结果无明显影响。因此,在临床实践中,若AIH‐PBC OS 患者具有明确的激素使用指征,临床医师应关注患者的ANAs,对于ANAs 阳性的患者,应密切随访并严格评估激素应答结果;对治疗反应不佳、转氨酶反应与IgG 反应不一致的患者,应及时调整诊治方案,必要时建议患者再次进行随访活检,以再次确认疾病的组织学情况,避免患者肝脏损害持续加重或长期大剂量使用激素,从而改善患者预后。
