瓜蒌皮注射液治疗稳定型心绞痛作用机制的网络药理学研究*
2024-02-29李文洁洪国君吴连平
魏 龙,李文洁,洪国君,陶 洋,吴连平
(江苏大学附属高淳医院,江苏 南京 211300)
心脑血管疾病严重危害人类健康,患者数达3.3亿,其中冠状动脉粥样硬化性心脏病(简称冠心病)患者数为1 139万例[1]。冠心病属中医“胸痹”范畴,主要证型包括气滞血瘀、痰阻热蕴、痰瘀互阻、气虚血瘀、气阴两虚等[2]。稳定型心绞痛(SAP)为冠心病的常见类型,治疗原则为改善冠状动脉的血液供应,降低心肌耗氧量,预防冠状动脉粥样硬化的发生、发展,提高患者的生活质量,并延长其生存期[3]。SAP的基本病机为“阳微阴弦”,属本虚标实之证,发生与饮食不节、寒邪内侵、劳倦内伤等因素有关[4]。目前,临床多以经皮冠状动脉介入术治疗冠心病,术后以阿司匹林联合氯吡格雷或替格瑞洛等治疗[5]。但部分患者在药物治疗过程中会出现出血等并发症[6],故需探寻更安全有效的治疗药物。瓜蒌皮为葫芦科植物栝楼Trichosanthes kirilowiiMaxim.或双边栝楼Trichosanthes rosthorniiHarms.的干燥成熟果皮,具有清热化痰、利气宽胸功效,用于治疗痰热咳嗽、胸闷胁痛[7]。瓜蒌皮注射液有行气除满、开胸除痹等功效,治疗冠心病的疗效显著、安全性良好[8]。有研究表明,瓜蒌皮水提物可通过相关信号通路保护缺血缺氧的大鼠心肌细胞[9],但其成分作用于相关疾病靶点和通路的机制还有待进一步揭示。HOPKINS 在2007 年首次提出网络药理学的理念[10],契合了中医药的整体理论。我国学者也先后向中医药领域进行探索,为中医药理论发展奠定了基础[11]。本研究中通过网络药理学技术预测瓜蒌皮注射液治疗SAP的活性成分和潜在作用靶点,探究其对SAP的作用机制。现报道如下。
1 材料与方法
1.1 制剂活性成分与靶点收集
通过检索中国知网自建库起至2023年2月的相关重点文献[12-14]获取制剂的活性成分,并将其在PubChem数据库(https:// pubchem. ncbi. nlm. nih. gov/)中通过SMILES 号统一名称。使用SwissTargetPrediction 数据库(http://old.swisstargetprediction.ch/)对活性成分进行靶点预测,剔除无法获得SMILES 号且无法预测靶点的活性成分,预测出的智人靶点评分需大于0。
1.2 SAP 疾病靶点与共有靶点
使用GeneCards 数据库(https:// www. genecards.org/),以“stable angina pectoris”为检索关键词收集相关性得分大于8 分的疾病靶点。以Venny 2.1 平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html)分析制剂活性成分靶点与SAP 疾病靶点,挑选出制剂中作用于SAP的靶点作为共有靶点[15]。
1.3 富集分析与成分-靶点-通路网络构建
将活性成分的靶点和SAP疾病靶点导入MetaScape(https://metascape.org/gp/index.html#/main/step1)在线软件进行基因本体论(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,结果以柱状图展示。将制剂中成分、靶点和和涉及的通路进行一一映射,采用Cytoscape 3.9.1 软件对映射结果进行拓扑计算,构建成分-靶点-通路网络。
1.4 蛋白相互作用(PPI)网络构建与数据验证
将共有靶点导入String数据库(https://www.stringdb.org/)。利用Cytoscape 3.9.1 软件构建PPI 网络并分析。通过基因表达综合(GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/)选定GSE19339微阵列数据集作为研究对象(该数据集包含8 个样本,本研究中通过采集急性冠状动脉综合征患者冠状动脉闭塞处血栓并通过GPL570 平台进行分析)。通过GEO 数据库中的基因芯片,以“coronary heart disease”为检索词检索数据,利用R 4.2.2 软件进行差异分析,并绘制火山图,从而检验制剂治疗SAP 的靶点是否存在于冠心病的差异基因中。差异基因通过R软件的limma包分析,设定|log2FC|>1且adj.P<0.05(FC为差异倍数)。
1.5 分子对接验证
通过PPI 网络选择度值较高的靶点作为分子对接的受体,通过成分- 靶点- 通路网络分析出分子对接的配体,从而通过预测活性小分子之间的结合能来预测其亲和力(亲和力越低,结合越稳定)。通过RCSB PDB 数据库(https://www.rcsb.org/)下载关键靶点结构,采用PyMOL 2.3.0 软件处理靶点。将处理后的关键靶点文件录入AutoDockTools 1.5.6 软件进行结构修饰,利用AutoDock Vina 软件进行分子对接,得到的最佳构象采用PyMOL 2.3.0 软件进行可视化分析。
2 结果
2.1 制剂活性成分与靶点
共获得57种活性成分,包括氨基酸类、黄酮类、多肽类、核苷类、唾液酸类、生物碱类、葡萄糖。预测出517个靶点。
2.2 SAP 疾病靶点与共有靶点
共获得SAP 疾病靶点139个,分析后得到制剂作用于SAP的靶点26个,包括NOS2,NOS3,EGFR,MMP-9,ICAM1,ITGB3,ACE,REN,F2,ITGA2B,JAK2,MPO,MAPK1,MMP3,TERT,SERPINE1,CETP,TTR,TNF,IL-2,APP,PIK3CA,ALDH2,SELP,SELE,FGF2。
2.3 富集分析与成分-靶点-通路网络
共富集到GO 功能条目37 个,包括生物过程(BP)20 个,分子功能(MF)9 个,细胞组成(CC)8 个,以及KEGG通路9条,详见图1、图2。
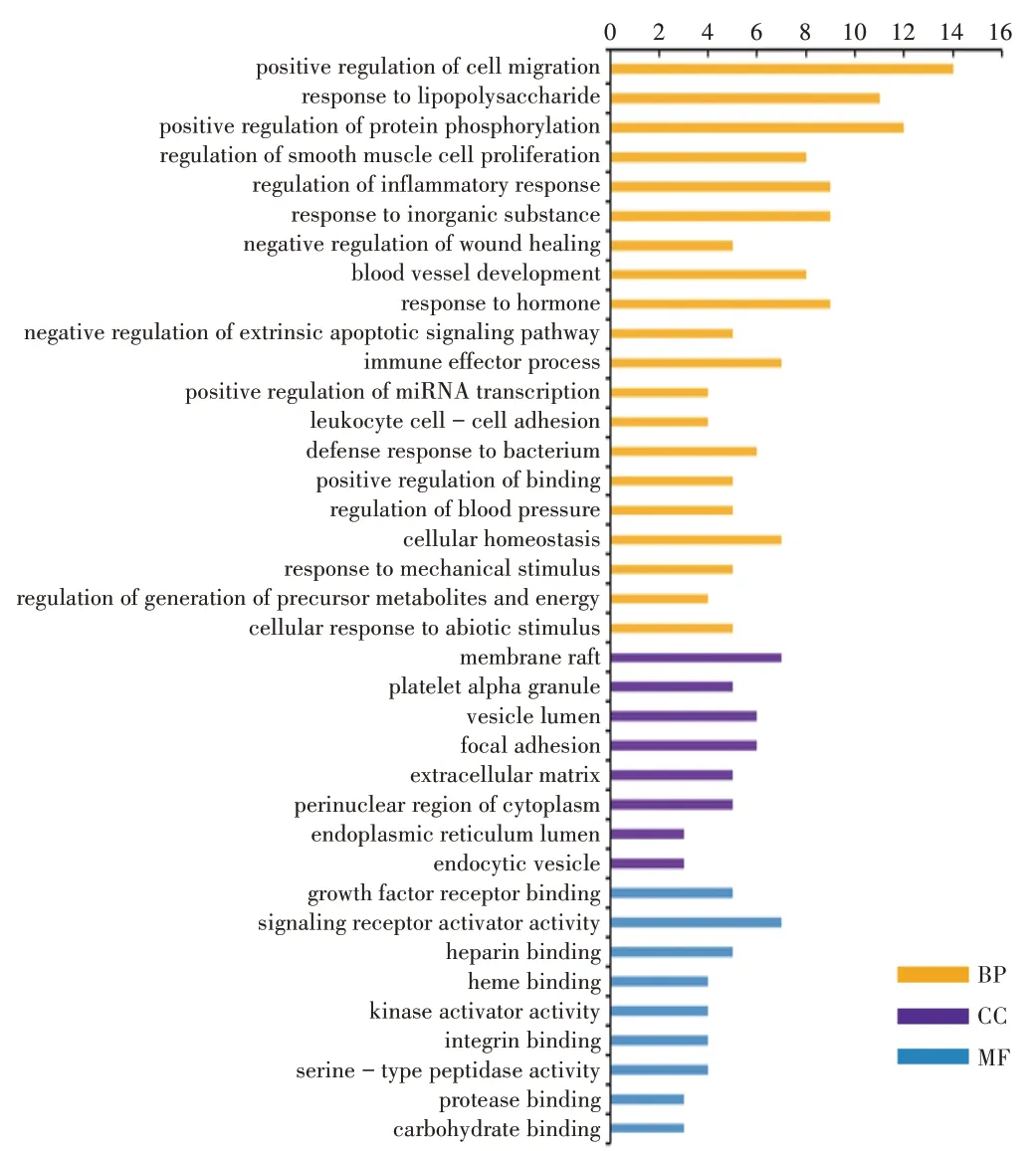
图1 GO功能富集分析柱状图Fig.1 Histogram of GO functional enrichment analysis

图2 KEGG通路富集分析柱状图Fig.2 Histogram of KEGG pathway enrichment analysis
成分- 靶点- 通路网络包含66 个节点和153 条边,详见图3,其中黄色表示活性成分,红色表示作用靶点,蓝色表示KEGG 通路。活性成分名称及具体KEGG通路见表1。

表1 活性成分与KEGG通路名称Tab.1 Names of active ingredients and KEGG pathways

图3 成分-靶点-通路网络图Fig.3 Network of ingredients - targets - pathways
2.4 PPI 网络构建与数据验证
PPI 网络见图4,其中度值最高的5 个节点分别是TNF,FGF2,MMP-9,ICAM1,EGFR。PPI网络具有25个节点和164 条边,其中ALDH2 与其他靶点无关联,属游离靶点,故隐藏。PPI 网络说明制剂中活性成分与SAP疾病靶点相互作用,共同发挥治疗作用。冠心病差异表达基因火山图见图5。共筛选出384个差异基因,其中红色表示P值和log2FC均符合要求,属差异表达基因,蓝色表示P值符合要求,绿色表示log2FC符合要求,灰色表示无显著差异的靶点。从TNF,FGF2,MMP - 9,ICAM1,EGFR 这5 个靶点中,显示出制剂治疗SAP 的靶点也部分存在于冠心病的差异基因中。

图4 蛋白相互作用网络Fig.4 PPI network
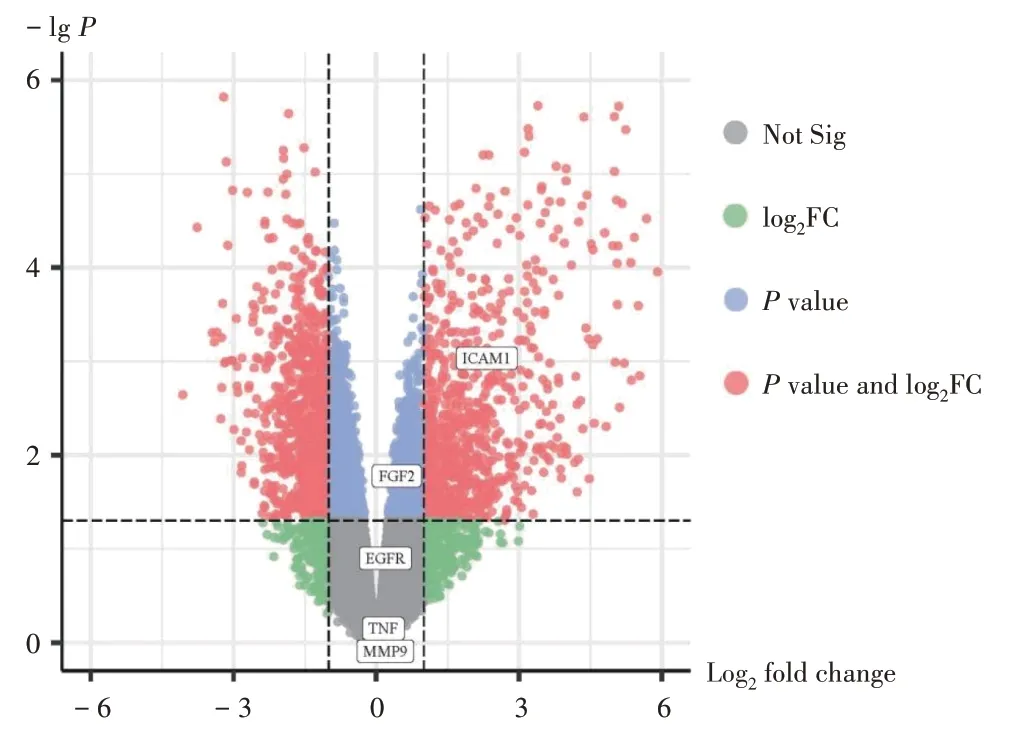
图5 差异表达基因火山图Fig.5 Volcano plot of the differentially expressed genes
2.5 分子对接
以TNF和EGFR作为分子对接的受体;TNF和EGFR主要与分子MOL052(木犀草苷)、MOL053(芹菜素-7-O-β-D-葡萄糖苷)、MOL054(香叶木素-7-O-β-葡萄糖苷)发生相互作用,选做本次分子对接的配体。通过RCSB PDB 数据库选定TNF(PDB ID:7KPA)和EGFR(PDB ID:6JOL)作为受体,其固有配体为D84 和STI(见表2)。3 种配体与TNF 和EGFR 均有较好的结合能,说明3 种黄酮类化合物均能较好地结合在受体TNF和EGFR 上,发挥治疗作用。活性成分与EGFR/TNF 的结合模式见图6,活性成分均可落入受体的口袋中,MOL052 与EGFR 的836 位天门冬氨酸残基形成氢键(见图6 A);MOL053 与EGFR 的658 位缬氨酸残基和836位天门冬氨酸残基形成氢键(见图6 B);MOL054与EGFR 的836 位天门冬氨酸残基形成氢键(见图6 C);MOL052 与TNF 的A 链60 位丝氨酸残基、B 链121 位甘氨酸残基、120位亮氨酸残基及C 链60位丝氨酸残基和151 位酪氨酸残基形成氢键(见图6 D);MOL053 与TNF的A链60位丝氨酸残基及B链119位酪氨酸残基、121位甘氨酸残基形成氢键(见图6 E);MOL054 与TNF 的A链60 位丝氨酸残基、120 位亮氨酸残基、151 位酪氨酸残基和B 链121 位甘氨酸残基及C 链60 位丝氨酸残基形成氢键(见图6 F)。
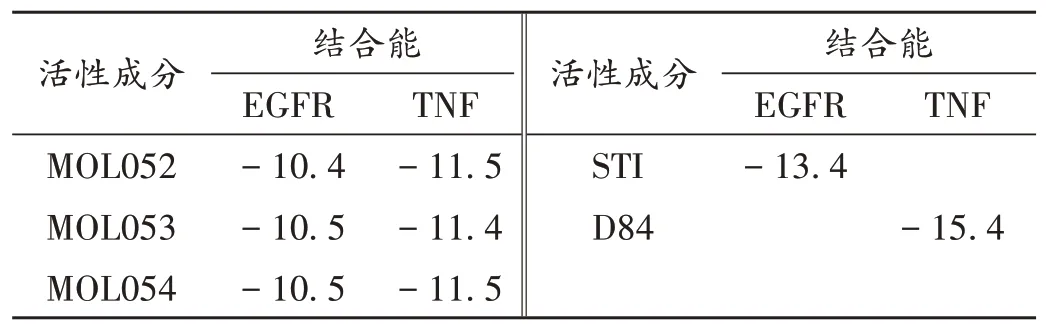
表2 活性成分与受体间的结合能(kcal/mol)Tab.2 Binding energies between the active ingredients and the receptors(kcal / mol)
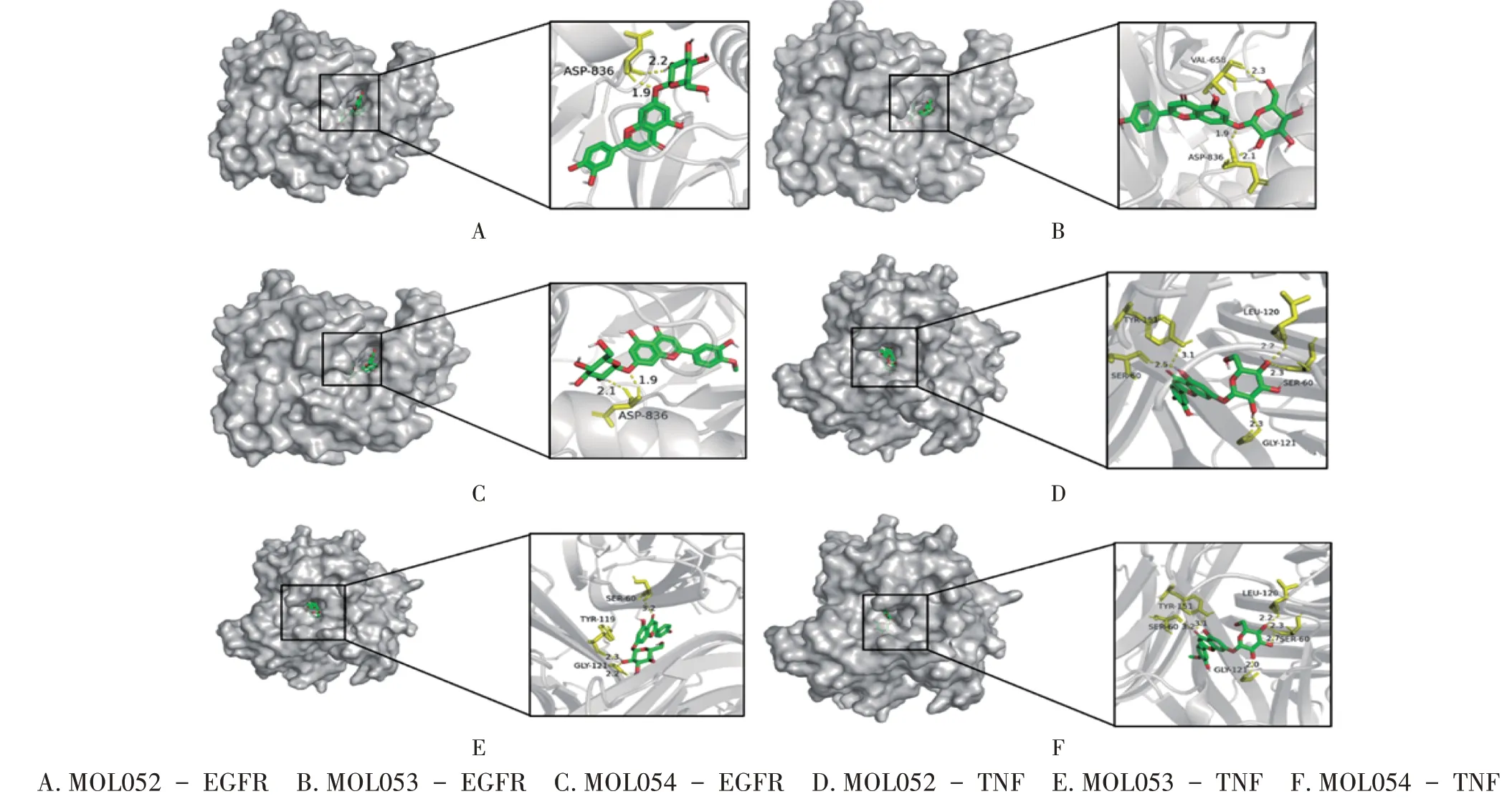
图6 活性成分与EGFR/TNF结合模式图A.MOL052 - EGFR B.MOL053 - EGFR C.MOL054 - EGFR D.MOL052 - TNF E.MOL053 - TNF F.MOL054 - TNFFig.6 Binding patterns of active ingredients and EGFR / TNF
3 讨论
SAP属中医学“胸痹”“心痛”范畴,其主要证候要素组合可分为痰瘀互结、气虚血瘀、气滞血瘀等,其中痰瘀互结证在心血管疾病研究中具有重要意义[16]。SAP病机为气虚,由于气的推动作用不足,水液运行不畅,产生痰浊,进而血液阻滞,而瓜蒌皮注射液有行气除满、开胸除痹之功效,可用于治疗痰浊阻络型冠心病。临床研究表明,该制剂与瑞舒伐他汀联合治疗心肌梗死,可降低心血管不良事件发生率,改善心脏和内皮舒张功能[17]。同时,瓜蒌皮提取物对受损的心肌细胞可产生显著的保护作用[18],还可通过激活PI3K/Akt通路从而增加NO 含量,产生抗凋亡作用,进而保护受损的心肌细胞[19]。
本研究结果表明,氨基酸类、多肽类、核苷类、生物碱类、黄酮类、唾液酸类等为瓜蒌皮注射液的主要活性成分。黄酮类活性成分主要为木犀草素、芦丁、芹菜素、香叶木素等。木犀草素可通过抑制氧化应激反应,进而降低血管紧张素Ⅱ对心肌细胞的肥大作用,其机制可能为通过激活Nrf2/Gpx4 通路,从而抑制铁死亡[20]。木犀草素可激活SIRT1抑制炎性反应,进而减少脓毒性心脏损伤[21]。芦丁为天然黄酮类活性成分,具有抗心肌损伤、抗氧化能力、抗炎反应、抗菌等作用[22];可通过激活SIRT1蛋白减轻心肌细胞的损伤,也可通过调控RAP1/ERK 信号通路来治疗抗肿瘤药物所致心肌损伤[23-24]。芹菜素可抑制血管内皮炎症,改善血管内皮功能,对心肌细胞有一定保护作用,其可能的机制为抑制核因子(NF)- κB 活化,进而影响下游细胞间黏附分子1(ICAM1)mRNA 的表达,发挥抗炎作用[25]。此外,芹菜素还可通过激活PI3K/Akt 通路抑制线粒体凋亡,从而减轻心肌缺血再灌注的损伤[26]。香叶木素可产生抗炎、抗氧化、抗凋亡等作用,通过加强射血功能、心室重构等达到对心肌缺血模型大鼠心脏的保护作用[27]。通过对比香叶木素和香叶木素-7-O-β-葡萄糖苷发现,香叶木素-7-O-β-葡萄糖苷更有可能成为一种保护血管内皮细胞的药物,其可通过抑制细胞凋亡、自噬和下调ROS 水平来保护血管内皮细胞[28]。SAP 引发心肌细胞缺血、缺氧,而瓜蒌皮注射液含有的主要黄酮类成分可通过影响氧化应激、细胞凋亡等途径改善心肌缺血再灌注损伤。
瓜蒌皮注射液主要通过26个靶点作用于SAP 发挥治疗作用。由基因富集的生物过程可见,主要富集于脂质与动脉粥样硬化通路、COVID-19 通路、癌症信号通路、恰加斯病通路、PI3K-Akt信号通路、糖尿病性心肌病通路、肥厚性心肌病通路、IL - 17 信号通路、精氨酸和脯氨酸代谢通路等9条KEGG通路。BP功能主要包括对细胞迁移的正向调控、对脂多糖的反应、蛋白质磷酸化的正向调控、平滑肌细胞增殖的调控、炎性反应的调控、血管的发育及外源性凋亡细胞信号通路的负向调控等。PI3K-Akt信号通路参与多种细胞过程,可通过抑制炎性因子白细胞介素6和肿瘤坏死因子-α 的表达进而发挥心脏保护作用;还可通过作用于下游靶点Bad,发挥抗凋亡作用而发挥保护作用[29]。PI3K-Akt信号通路也可调控下游NF-κB信号通路,其可调控血管内皮生成、促进缺血再灌注心肌细胞的修复而发挥重要作用[30]。NOS3 作为一氧化氮合酶之一,在血管生成中可诱导释放内皮型一氧化氮,从而促进血管生成和血小板聚集等,当表达受限时会造成血管内皮功能紊乱,进而导致SAP等疾病的发生、发展[31]。
PPI 网络显示了关键作用靶点相互作用,共同调控发挥治疗SAP 作用,其度值最高的5 个节点分别是TNF,FGF2,MMP - 9,ICAM1,EGFR。通过对冠心病差异表达基因的分析,仅ICAM1 为差异表达基因,但数据集GSE19339 主要研究对象为急性冠状动脉综合征患者,存在一定差异。同样说明瓜蒌皮注射液作用靶点可特异性地作用于SAP差异表达基因。EGFR为酪氨酸激酶受体家族成员之一,可通过调控MAPK信号通路、PI3K/Akt 信号通路和JAK/STAT 信号通路参与细胞增殖、分化和转移[32]。MMP-9 为锌依赖基质金属蛋白酶,可导致心肌细胞的过度增殖引发纤维化,引起心肌细胞的受损和重构[33]。FGF2 为成纤维细胞生长因子多肽家族成员,调节内皮细胞的增殖、分化和凋亡,在炎性反应中起到重要作用[34]。ICAM1作为经典的细胞黏附分子,是白细胞黏附蛋白LFA-1 的配体,对细胞间炎性反应及血管内皮细胞活化起重要作用,从而对心肌细胞产生炎性反应,进而产生纤维化和血栓[35-36]。制剂作用靶点说明其可通过PI3K/Akt信号通路进而抑制心肌细胞凋亡,作用于MMP-9,ICAM1,EGFR防止心肌细胞纤维化和过度增殖,进而逆转心肌细胞的受损和重构。
分子对接结果表明,瓜蒌皮注射液中黄酮类活性成分木犀草苷、芹菜素-7-O-β-D-葡萄糖苷和香叶木素- 7 -O-β- 葡萄糖苷可和受体TNF 与EGFR 间相互作用,其亲和力均低于- 6 kcal/mol,但与原始配体相比亲和力仍有一定差距,可通过结构修饰开发出更好的活性成分,为治疗SAP 提供更多选择。目前,多款TNF 抑制剂如阿达木单抗已投入临床使用,其主要抑制细胞因子TNF,从而导致促细胞生长和程序性细胞死亡,用于治疗免疫系统疾病[37]。目前已开发出多种小分子酪氨酸激酶抑制剂用于靶向EGFR,EGFR - 酪氨酸激酶抑制剂的不断研发将对肺癌患者的预后和生存期的改善产生影响[38]。
综上所述,本研究中发现瓜蒌皮注射液含有多种活性成分,其中所含黄酮类化合物为主要活性成分。其可能特异性作用于NOS3,EGFR,MMP - 9 等靶点进而影响脂质与动脉粥样硬化通路、PI3K-Akt信号通路和精氨酸和脯氨酸代谢通路等通路,通过Akt 和SIRT1 表达,诱导NO 释放产生抗氧化应激、抗凋亡、松弛血管平滑肌等作用,改善冠状动脉的血液供应和降低心肌耗氧量,进而治疗SAP。但本研究尚处于模拟预测其作用机制阶段,为预防与治疗SAP 及新药研发提供了参考,仍有待进一步验证。
