电针对慢传输型便秘大鼠肠道运动及促炎性因子表达影响
2024-02-29刘跟莉李晓宁管淑敏
刘跟莉,李晓宁*,师 帅,李 艳,管淑敏,付 瑶
(1.黑龙江中医药大学,哈尔滨 150040;2.黑龙江中医药大学附属第二医院针灸科,哈尔滨 150001)
慢传输型便秘(slow transit constipation,STC)临床特点是排便困难、次数减少,伴有大便干硬,其有别于其他类型便秘主要的特点为结肠传输能力减弱以及速度减缓等[1-2]。作为临床常见的功能性便秘类型,STC 在功能性便秘中占比约为45.5%[3]。本病主要的发病原因是结肠动力减弱,从而导致胃肠内容物推进缓慢、排空延迟。长期的肠道传输功能下降会导致肠梗阻、内痔、肛裂等发生,甚至会诱发脑血管病及心血管病,严重者可危及生命。因此,积极寻找STC 有效的治疗手段具有重要的临床意义。
近年来,针灸疗法广泛应用于STC 及各种原因引起的便秘治疗,取得了满意的疗效[4-6]。针灸治疗能够改善STC 患者每周自发排便次数、首次排便时间、粪便性状等,然而其作用机制仍不明确。巨噬细胞在胃肠动力紊乱性疾病中发挥了重要作用。胃肠道中成熟巨噬细胞在一定条件下活化成:经典活化型巨噬细胞(M1 型)和选择活化型巨噬细胞(M2型),2 种形态可以相互转变[7-8]。研究[9]证明,STC 大鼠巨噬细胞发生活化,相关因子如肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、CD68 表达明显上调,提示STC 大鼠结肠组织中巨噬细胞活化。然而其是否为针灸治疗STC 的内在机制有待进一步阐明。因此,本研究拟建立STC 大鼠模型,给予电针及药物治疗,观察治疗后各组大鼠肠道推进率、结肠组织病理形态学变化及CD68、TNF-α、IL-1β促炎性因子蛋白表达,以期为阐明电针治疗STC 作用机制提供参考。
1 材料与方法
1.1 实验动物及分组
清洁级Sprague-Dawley(SD)雌性大鼠24 只,体质量(220±10)g,购自辽宁长生生物技术有限公司,实验动物生产许可证号:SCXK(辽)2015-0001。饲养条件:大鼠分笼饲养于清洁级动物房,自由进食水,室温(25±1.0)℃,空气湿度50%左右,光照12 h 昼夜循环。所有大鼠自进入实验室起适应性饲养1 周,随机分为空白组与造模组,其中空白组6 只,造模组18 只,造模组在模型制备成功后随机分为模型组、电针组与药物组,每组各6 只。实验过程中对大鼠的处置均按照国际最新的实验动物使用和关怀指南进行。本研究已通过黑龙江中医药大学附属第二医院伦理委员会审批(审批号:2021-K-181)。
1.2 主要试剂及仪器
微量移液器(Proline,BIOHIT,苏州),酶标仪(ELX-800,BIOTEK,美国),电热恒温培养箱(DH36001B,天津泰斯特,天津),转移槽(DYCZ-40D,北京六一,北京),双垂直蛋白电泳仪(DYCZ-24DN,北京六一,北京),超速冷冻离心机(H-2050R,湖南湘仪,长沙),显微镜(BX53,OLUMPUS,日本),显微镜拍照系统(DP73,OLUMPUS,日本),电针治疗仪(KWD-808-Ⅱ型,常州英迪电子医疗器械有限公司,常州),针灸针(0.35 mm ×13 mm ,苏州医疗用品厂有限公司,苏州)。
苏木素-伊红试剂盒、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE 凝胶快速制备试剂盒、SDS-PAGE 蛋白上样缓冲液、ECL 发光液、IL-1β antibody、CD68 antibody、TNF-α antibody、羊抗兔IgG-HRP、内参抗体β-actin(沈阳万类生物科技有限公司,批号分别为 WLA051a、WLA019、WLA004、WLA013、WLA005、WLA003、WL00891、WL04839、WL01581、WLA023、WL0137200,沈阳),PVDF 膜(批号:IPVH00010, Millipore 公司,美国)。复方地芬诺酯片(常州康普药业有限公司,国药准字:H32022716,批号:2004017,规格:盐酸地芬诺酯25 mg,硫酸阿托品25 μg),枸橼酸莫沙必利分散片(鲁南制药有限公司,国药准字:H19990317,批号:14202018283,规格:5mg)。
1.3 造模方法
按照前期研究方法[10],将复方地芬诺酯片用研钵研至极细的粉末,然后配置成混悬液。用蒸馏水将上述药粉按照10 mg·kg-1·d-1配置混悬液,随用随配。使用时将混悬液用水浴箱加热至25℃,按照上述剂量灌胃,每天1 次,连续14 d,以建立STC大鼠模型。
灌胃结束后,以首粒黑便排出时间延长作为模型制备成功标准。复方地芬诺酯混悬液连续灌胃14 d结束后,大鼠禁食不禁水24 h,将活性炭混悬液提前加热至25℃,按照每只3 mL剂量灌胃后单笼饲养。记录灌胃结束的时间T1 及大鼠排出首粒黑便的时间T2,首粒黑便排出时间= T2 - T1,以其较空白组大鼠平均值延长为成功标准。
1.4 干预分组
1.4.1 空白组 给予与模型组相同剂量、相同温度的生理盐水灌胃,连续给予14 d。大鼠正常捆绑。
1.4.2 模型组 给予上述造模方法,模型制备成功后均单独饲养。大鼠正常捆绑。
1.4.3 电针组 按照上述造模方法成功后,正常捆绑并给予电针治疗。取穴:足三里(双侧)、上巨虚(双侧)。穴位定位参照《实验针灸学》(新世纪第4 版,全国中医药行业高等教育十三五规划教材),足三里位于大鼠后肢膝关节外下方当腓骨小头下约5 mm 处;上巨虚位于大鼠后肢膝关节外下方当腓骨小头下约10 mm 处。操作方法:选择0.35 mm×13 mm 无菌针灸针,穴位局部消毒后将针刺入相应深度,同侧足三里、上巨虚分别接1 组电针,选择疏密波,频率2/50 Hz,电流大小以局部肌肉轻微抖动为度。时间20 min,每天1 次,连续治疗14 d[11]。
1.4.4 药物组 参照前期研究及《药理实验方法学》[12-13],大鼠麻醉后,将枸橼酸莫沙必利片溶解后,按照1.37 mg·kg-1,1 mL·100 g-1灌胃治疗,每天1次,连续治疗14 d。
1.5 观察指标及检测方法
1.5.1 首粒黑便排出时间 参照何昭璇等[14]研究方法,14 d 治疗结束后,大鼠禁食不禁水24 h,将活性炭混悬液提前加热至25℃,按照1 mL·100 g-1剂量灌胃后单笼饲养。记录灌胃结束的时间T1 及大鼠排出首粒黑便的时间T2,首粒黑便排出时间= T2-T1。
1.5.2 小肠推进率 大鼠麻醉后脱颈椎处死,快速分离小肠,以幽门为L0,活性炭推进的最终点为L1,小肠回盲部为L2。小肠总长度= L2 - L0,小肠推进率=(L1 - L0)/(L2 - L0)×100%[15]。
1.5.3 HE 染色观察结肠组织形态 大鼠麻醉后脱颈椎处死,快速取出直径约5 cm 结肠组织,将所取结肠组织分成2 段,生理盐水清洗去除残留物后,分别置于液氮快速冻存,置-80℃冰箱保存;另一段置于4%多聚甲醛溶液固定备用[16]。
取多聚甲醛固定的结肠组织进行石蜡包埋、切片,后经脱蜡、梯度乙醇水化、苏木精染色、1%盐酸酒精分化、弱碱性水溶液返蓝、伊红染色、二甲苯透明、中性树胶封片等步骤,在显微镜下观察结肠组织形态学变化。
1.5.4Western-blot法检测肠道 TNF-α、IL-1β、CD68 蛋白表达 取置于-80℃保存备用的结肠组织。提取总蛋白,BCA 法测定蛋白浓度,经相应浓度SDS-PAGE 分离后,转膜,相继加入相应的一抗和二抗进行免疫反应,加入 ECL 发光液曝光。采用quantityone分析软件以检测条带灰度值(OD),最后计算目的蛋白/β-actin 的相对表达量[17-18]。
1.6 统计学方法
所有数据采用 SPSS 26.0 统计学软件进行数据分析。若数据符合正态分布,组间比较采用onewayANOVA,方差齐时选用LSD,方差不齐时采用Tamhane'sT2进行多重比较;若数据不符合正态分布,采用Kruskal-Wallis检验,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组大鼠首粒黑便排出时间比较
各组大鼠首粒黑便排出时间比较,模型组排出时间显著加长,与空白组比较,差异具有统计学意义(P<0.05);药物组和电针组大鼠经治疗后,首粒黑便排出时间显著减少,与模型组比较差异具有统计学意义(P<0.05)。见表1。
表1 各组大鼠首粒黑便排出时间比较(±s ,n = 6)min
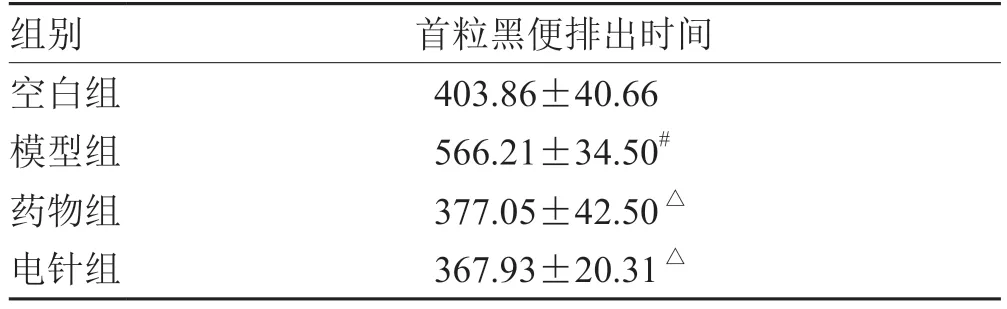
表1 各组大鼠首粒黑便排出时间比较(±s ,n = 6)min
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别 首粒黑便排出时间空白组 403.86±40.66模型组 566.21±34.50#药物组 377.05±42.50△电针组 367.93±20.31△
2.2 各组大鼠小肠推进率比较
各组大鼠小肠推进率比较,模型组大鼠显著降低,与空白组比较,差异具有统计学意义(P<0.05);药物组和电针组大鼠经治疗后,小肠推进率显著提高,与模型组比较,差异具有统计学意义(P<0.05)。见表2。
表2 各组大鼠小肠推进率比较(±s ,n = 6) %
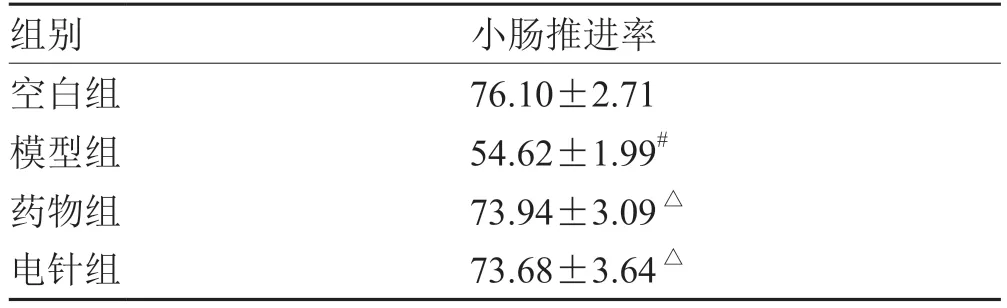
表2 各组大鼠小肠推进率比较(±s ,n = 6) %
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别 小肠推进率空白组 76.10±2.71模型组 54.62±1.99#药物组 73.94±3.09△电针组 73.68±3.64△
2.3 各组大鼠结肠组织病理形态学检测
采用HE 染色检测各组大鼠结肠组织病理形态学变化,空白组大鼠未见组织形态学变化,结肠黏膜组织黏膜层结构完整,细胞排列整齐,无出血及过度炎性细胞浸润;模型组大鼠结肠黏膜组织出血,组织形态学结构破坏,可见上皮细胞变性坏死,炎性细胞浸润;药物组和电针组大鼠结肠黏膜组织出血明显改善,组织形态学破坏较模型组改善,可见少量炎性细胞浸润。见图1。

图1 各组大鼠结肠组织病理形态学变化(HE,×200)
2.4 各组大鼠结肠组织TNF-α、IL-1β、CD68 蛋白表达
各组大鼠结肠组织TNF-α、IL-1β、CD68 蛋白表达比较,模型组大鼠TNF-α、IL-1β、CD68 蛋白表达显著升高,与空白组比较,差异具有统计学意义(P<0.05);药物组和电针组大鼠经治疗后,结肠组织TNF-α、IL-1β、CD68 蛋白表达显著降低,与模型组比较,差异具有统计学意义(P<0.05)。见表3,图2。

图2 各组大鼠结肠组织TNF-α、IL-1β、CD68 蛋白表达情况(n= 6)
表3 结肠组织TNF-α、IL-1β、CD68 蛋白表达(±s ,n= 6)

表3 结肠组织TNF-α、IL-1β、CD68 蛋白表达(±s ,n= 6)
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别 TNF-α IL-1β CD68空白组 25.93±3.13 22.00±2.95 637.48±79.11模型组 63.22±9.96# 51.54±8.72# 1 208.50±194.77#药物组 35.13±6.36△ 28.48±3.93△ 775.73±104.38△电针组 40.28±6.52△ 30.99±5.92△ 836.99±118.53△
3 讨论
STC 属于中医学“便秘”范畴[19-20],早在《黄帝内经》中就有“大便干燥”“大肠结”等记载,《伤寒杂病论》也有“大便坚”等文字记载,与现代的便秘症状类似。隋代《诸病源候论》总结了便秘的病因病机,为后世医家论治本病提供了依据。宋元时期亦有“大便燥结”“大便滞涩”“燥结”等诸多记载,但其内容也与既往记载类似,都描述了本病的症状。民国时期才有“便秘”的病名。针灸治疗便秘积累了丰富的经验,也取得较好的临床疗效,但多数研究所选穴位组成不一,较少有研究者对其进行系统的归纳整理及深度分析。本研究选择足三里、上巨虚并配合电针治疗。电针通过在毫针刺激的基础上配合电流刺激,已经被证实能够加强疗效[21-23]。“合治内府”理论是中医针灸重要的配穴方法之一,《灵枢·邪气脏腑病形》曰:“荥俞治外经,合治内府……治内府奈何? 岐伯曰:取之于合。”这里的“合”指的是下合穴,“合治内府”意即运用下合穴来治疗六腑病症。足三里和上巨虚分别是胃和大肠的下合穴,是胃和大肠腑之气向下输注的部位。研究[24]证实,对于针刺刺激诱导迷走神经-肾上腺抗炎通路,存在躯体部位的选择性(如下合穴足三里优于腹部天枢)、穴位特异性(如足三里优于其旁边的非穴点)。这些发现充实了针灸等体表刺激疗法的现代科学内涵,同时揭示了“合治内府”理论指导下的下合穴治疗腹部病证的科学依据。临床实践中,电针足三里也可缩短肠道手术病人的肠动力恢复时间[25-27]。上巨虚也被广泛应用于调理肠腑、理气和胃,用于治疗便秘、腹泻及痢疾等[28-29]。
STC 的发病机制目前尚不明确,部分学者认为可能与肠神经系统变化、肠道肌病、Cajal 间质细胞(ICC)减少相关,肠道菌群变化、内分泌因素、自身免疫性疾病、长期使用泻剂、精神心理因素、饮食结构因素和运动缺乏是引起慢性传输型便秘的发生或加重的原因。肠道动力紊乱引起的胃肠蠕动减弱是导致 STC 发生发展的主要因素,而肠道动力的大小主要受肠神经系统(enteric nervous system,ENS)的调控。ENS 广泛分布于食管至肛门的整个消化道,现代有研究将ENS 称为“肠脑”,因为其被发现是独立于中枢神经系统而存在的神经系统,能够独立调节胃肠道的运动、分泌、新陈代谢等功能,在肠道的正常蠕动过程中发挥了重要的作用[30]。
目前,首粒粪便排出时间、胃排空率、小肠推进率等是动物实验中评价胃肠传输功能常用的几种方法,通过规范操作、严格测量,能够从客观量化且全方位的角度判断胃肠动力功能。本研究采用首粒粪便排出时间及小肠推进率来观察STC 大鼠肠道运动情况,以及药物和电针的干预作用。本研究结果发现,造模后大鼠首粒黑便排出时间显著加长,而小肠推进率显著降低,说明STC 大鼠存在明显的胃肠道动力异常。针灸治疗能够改善STC 大鼠的胃肠道动力,缩短STC 大鼠首粒粪便排出时间、提高小肠推进率,与模型组比较,差异具有统计学意义(P<0.05)。钟峰等[31]采用电针“天枢”“大肠俞”治疗STC,结果显示与空白组比较,模型组大鼠胃排空率、小肠推进率显著降低(P<0.01);给予电针治疗后,电针组大鼠胃排空率、小肠推进率较模型组显著升高(P<0.01),说明电针“天枢”“大肠俞”能改善STC 大鼠胃肠道传输功能。曹洋等[32]采用大肠俞募穴“天枢”“大肠俞”,给予电针治疗观察其对STC 大鼠肠道传输功能的改善情况,结果显示,与正常组、盐水组比较,模型组大鼠24 h排便量和小肠推进率下降(P<0.01)。与模型组比较,电针组大鼠24 h 排便量增多(P<0.01),小肠推进率明显升高(P<0.01)。上述结果与本研究结果基本一致。
研究[9]证实STC 大鼠巨噬细胞发生活化,并且发现STC 大鼠肠道动力减弱,而其机制可能与M1巨噬细胞源性外显体miR-34c-5p 降低ICC 细胞活力有关。ICC 是胃肠道内部一种具有独立功能且极其特殊的间质细胞,是胃肠道的起搏细胞,对维持胃肠道动力至关重要[33-34]。本研究通过HE 染色可见,造模后大鼠结肠黏膜组织出血,组织形态学结构破坏,伴上皮细胞变性坏死及炎性细胞浸润;可见肠道组织炎症反应可能在STC 发病机制中占据了重要的地位,而胃肠道动力减弱伴随着炎性反应。给予电针治疗后,大鼠结肠黏膜组织出血明显减少,组织形态学破坏较模型组改善,可见少量炎性细胞浸润。崔长升等[35]观察到小鼠STC 便秘模型伴随着结肠形态结构的改变,给予药物治疗改善其结肠形态能够提高小鼠小肠的炭末推进率。
上述研究证实,STC 大鼠肠道炎性细胞浸润明显增加,伴随着肠道动力减弱,给予药物及电针治疗能够逆转上述改变,但其具体的作用机制尚不明确。正如前文所述,巨噬细胞活化介导的炎症反应可能在其过程中发挥重要作用。巨噬细胞分布广泛,在疏松结缔组织内数量较多。巨噬细胞形态多样,因其功能状态不同而变化,一般为圆形或椭圆形,并有短小突起,功能活跃者常伸出较长伪足而呈不规则形,胞核较小,呈圆形或椭圆形,着色较深。CD68 是巨噬细胞的特异性标志分子,而TNF-α、IL-1β 是由活化的巨噬细胞产生的炎性细胞因子,因此可以通过检测CD68 表达情况来观察STC 大鼠肠道巨噬细胞活化。本研究通过检测促炎性因子TNF-α、IL-1β 以及巨噬细胞的标记物CD68 蛋白表达发现,造模后大鼠结肠组织TNF-α、IL-1β、CD68蛋白表达显著升高,说明发生巨噬细胞活化及炎性反应,这与HE 染色的结果一致。电针治疗能够降低结肠组织TNF-α、IL-1β、CD68 蛋白表达。郭振科等[36]研究益气健脾通便方对慢传输型便秘患者体内胃饥饿素(ghrelin)、TNF-α 的影响,2 组治疗前TNF-α 比较,差异无统计学意义(P>0.05)。给予中药治疗2 周后,益气健脾通便组患者体内TNF-α水平低于对照组(P<0.05),提示随着STC 症状改善伴随着TNF-α 等炎性细胞因子表达的变化,而通过药物治疗降低其表达能够改善结肠传输功能。研究[37]也证实,通过降低促炎因子IL-1β 的表达能够修复STC 肠道炎症和肠道屏障损伤,与本研究结果相似。
综上所述,本研究结果证实电针治疗能够改善STC 大鼠肠道运动功能,修复结肠组织病理形态学改变,其机制可能与下调TNF-α、IL-1β、CD68 蛋白表达,抑制炎性反应有关。但其具体的作用机制及对巨噬细胞活化的调节有待进一步深入揭示,后续研究可以通过观察M1 和M2 型巨噬细胞在STC不同阶段活化情况,揭示巨噬细胞活化及炎症反应在其发病机制中发挥的作用以及电针干预的效果。
