常用皮肤科生物制剂治疗中的矛盾性反应及机制
2024-02-29陈尚申徐明圆刘业强
陈尚申,徐明圆,刘业强
[作者单位]1.南昌大学焕奎书院,江西 南昌330036;2.上海市皮肤病医院,同济大学附属皮肤病医院病理科,上海 200443
近年来,生物制剂在慢性炎症性皮肤病的治疗中发挥了重要的作用,特别是在银屑病、特应性皮炎等疾病的治疗中;这些疾病的产生多是依赖于细胞因子、淋巴细胞和组织细胞之间的相互作用。而生物制剂通过阻断病理过程中起关键作用的细胞因子发挥治疗疾病的作用,但是治疗过程中可能会出现新发炎症或原发部位的炎症加剧等不良现象,即矛盾性反应。目前国内皮肤科常用的生物制剂包括几大类:肿瘤坏死因子 α (tumor necrosis factor-α,TNF-α) 抑制剂、白细胞介素-17A(interleukin-17A,IL-17A)抑制剂、IL-12/23(IL-12/23p40) 抑制剂、IL-23 (IL-23p19) 抑制剂、IL-4受体α (IL-4Rα) 抑制剂。本文将对上述生物制剂临床应用过程中的矛盾性反应以及可能的机制进行阐述。
1 生物制剂治疗出现矛盾性反应的表现
1.1矛盾性银屑病 矛盾性银屑病是指生物靶向治疗诱导的、免疫失调的、非感染性、非肿瘤性炎症性损害,多种生物制剂都可诱导此种反应的发生。在TNF-α诱导的矛盾性银屑病中,英夫利昔单抗诱导的病例最多,超过一半以上[1]。多数病例表现为新发银屑病样损伤。当使用TNF-α抑制剂治疗银屑病时,发生的病变常表现为掌跖脓疱病[2],反向型银屑病也可见,有时银屑病关节炎也伴随发生。出现的斑块状银屑病可表现为其他部位的新皮损,而不仅仅是原有皮损的恶化。新生的掌跖脓疱病在风湿病和肠道慢性炎症性疾病的治疗中也较为常见。IL-4Rα抑制剂(度普利尤单抗)诱导的银屑病样反应中,有研究调查显示其发生率约为3.3%[3]。对已发表病例的系统性回顾显示,从开始使用度普利尤单抗到该反应发生的平均潜伏期为 3.7 个月[4]。大多数患者出现斑块状银屑病样改变,但也有红皮病、点滴状银屑病样损伤的报道。大多数报告的病例在停用度普利尤单抗或开始外用糖皮质激素后得到缓解。IL-17A抑制剂也可引起矛盾性银屑病,但相对较为少见,有关报道以司库奇尤单抗多见。乌司奴单抗(IL-12/23p40 抑制剂)的有关报道最少,目前仅有9例[1]。矛盾性银屑病临床表现如图1所示。

Purple red patches on the abdomen,with clearly defined border;Visible scratches and pigmentation on thickened thigh skin
1.2矛盾性湿疹 文献显示,接受 TNF-α 抑制剂治疗各种炎症性疾病的患者中有 5%~20% 出现湿疹,其中英夫利昔单抗关联性最强[5]。接受度普利尤单抗治疗的患者有时也可能出现湿疹样矛盾性反应,最常见的是局部出现湿疹、皮炎样损伤,且面部、眼周区域或颈部(图2)最常受累。尽管其确切的发病率尚不明晰,但一项回顾性研究显示,在接受度普利尤单抗治疗的特应性皮炎患者中,23%出现新的局部皮损,其中大部分面部受累[6]。
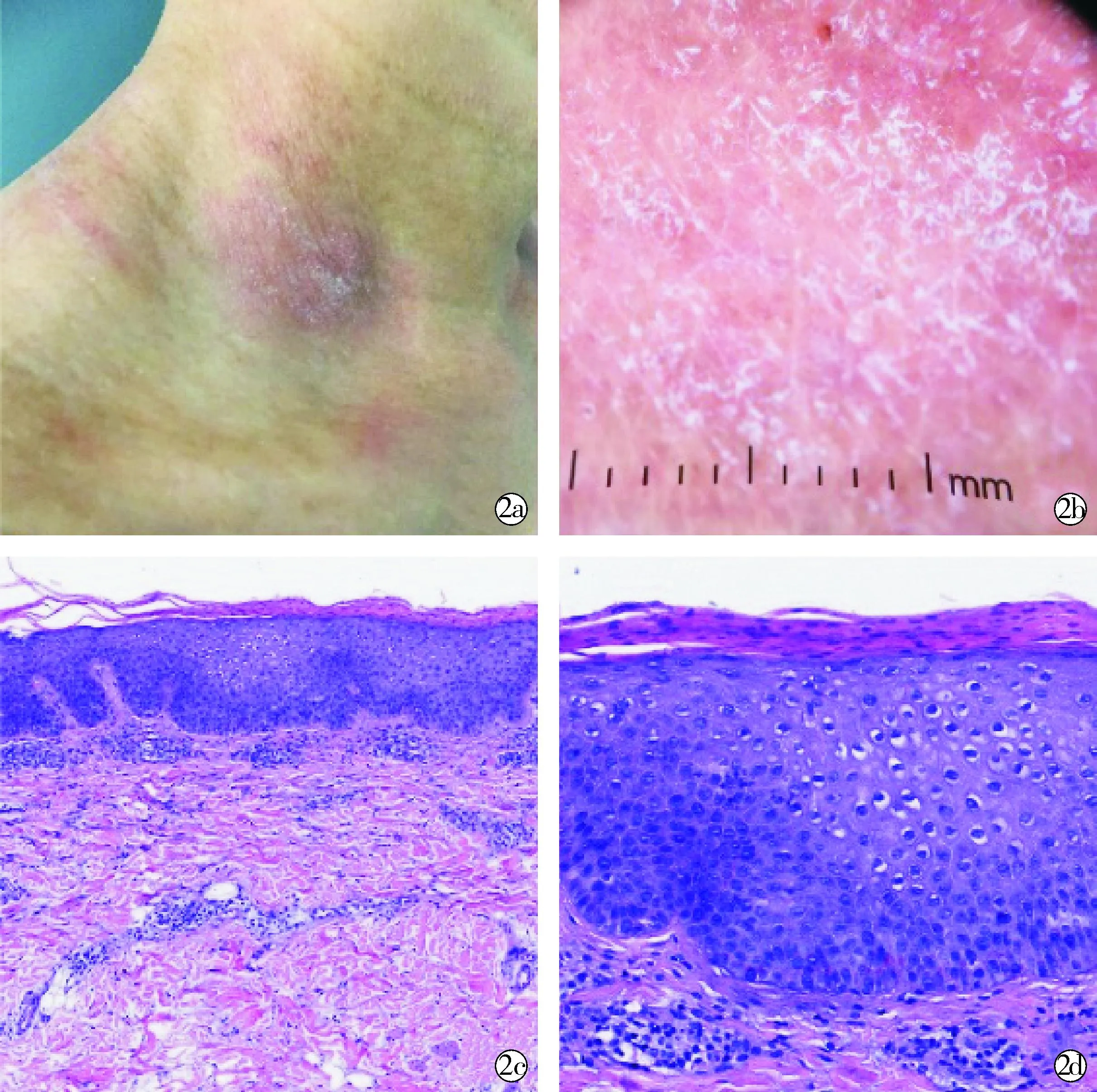
HE×4;HE×10
湿疹样矛盾性反应是IL-17A抑制剂最常见的矛盾性反应,而其中司库奇尤单抗是诱导此类反应最常见的生物制剂,其治疗银屑病出现的湿疹样反应如图3所示。值得注意的是,由布罗达单抗引起的湿疹样反应似乎非常罕见[7],而布罗达单抗能结合 IL-17A受体阻断IL-17信号通路(不仅仅只是IL-17A),这表明其他 IL-17 家族成员可能在湿疹样矛盾性反应的发展中发挥作用。通常,湿疹样矛盾性反应发生在治疗开始后的4个月内,可表现为典型的全身性特应性皮炎 (atopic dermatitis,AD) 样皮疹、面部皮炎、汗疱疹等[1]。

~ Scattered purple red patches on limbs and buttocks; Continuous insufficiency of keratosis,formation of plasma crusts,psoriatic hyperplasia of the epidermis,local spongy formation,telangiectasia,infiltration of superficial perivascular lymphocytes and a small number of eosinophils (HE×10); Scattered eosinophils around superficial dermal vessels (HE×20)
IL-23抑制剂上市使用较晚,引起的皮肤矛盾性反应报道较少。研究报道了4例银屑病患者接受IL-23p19抑制剂治疗后出现湿疹样反应,其中3例可能是由古塞奇尤单抗诱导,1例可能由瑞莎珠单抗产生,涉及替拉珠单抗的湿疹样矛盾性反应报道尚未见到[8]。乌司奴单抗引起的湿疹样反应也很少,第1例报告是掌跖脓疱性银屑病患者治疗中出现湿疹样变[9],此外还有10例的报道[10]。
1.3矛盾性银屑病和矛盾性湿疹的临床特点与区别 因矛盾性银屑病和矛盾性湿疹可同时出现,所以鉴别存在挑战,需要临床与病理结合共同加以判断。临床上,矛盾性湿疹还是具有湿疹“皮损多形、有一定渗出性”的特点;病理上,角质层可有更多浆液渗出,颗粒层不消失、甚至增厚,棘层内可见程度不等的海绵水肿,真皮浅层血管周围炎,可伴嗜酸性粒细胞增多。而矛盾性银屑病临床上更易表现为典型的银屑病,皮损相对单一,相对干燥;病理上,角质层角化不全、浆液渗出少,颗粒层变薄,甚至消失,棘层海绵形成少,真皮乳头血管扩张扭曲,真皮浅层血管浸润淋巴细胞为主,嗜酸性粒细胞少见。以IL-17A抑制剂诱导的矛盾性湿疹为例,临床上可表现为以下3种:典型的急性湿疹、特应性皮炎样皮疹和银屑病样湿疹。其组织学上共同的特征是不同程度的棘细胞间水肿即海绵形成,但仍存在一定的差异:严重的海绵形成和淋巴细胞浸润提示急性湿疹;不规则棘层增厚且保留颗粒层以及仅轻度海绵形成提示特应性皮炎样皮疹;表皮规则增生、角化不全、角质层中性粒细胞增多、真皮乳头毛细血管扩张等变化提示银屑病样湿疹的诊断[11]。
1.4其他矛盾性反应 TNF-α抑制剂还可能诱导矛盾性炎症性肠病、矛盾性化脓性汗腺炎、矛盾性葡萄膜炎、结节病样矛盾性反应和矛盾性肉芽肿样变;IL-12/23p40抑制剂乌司奴单抗可引起狼疮样反应、结节病样反应和白癜风;IL-17A抑制剂可诱导结节病样反应、斑秃、狼疮样反应、化脓性汗腺炎[1]。此外,研究者发现司库奇尤单抗还可能导致坏疽性脓皮病的发生[12]。目前TNF-α抑制剂相关的矛盾性反应最多,而其他药物相关的报道较少,其可能的原因为TNF-α抑制剂临床使用最早,而其他相关生物制剂近年来才逐渐开始上市使用。
2 不同生物制剂治疗出现矛盾性反应的机制
生物制剂在治疗过程中可能打破细胞因子之间的平衡,导致矛盾性反应的发生。不同生物制剂引起细胞因子失衡的机制也不尽相同,目前研究相对清楚的几种机制见表1。

表1 皮肤科常用生物制剂的矛盾性反应及可能机制
2.1TNF-α抑制剂引起矛盾性银屑病的机制 目前的研究已经提出了几种可能的假说(图4)。首先,研究发现矛盾性银屑病皮损中Ⅰ型干扰素的表达显著高于经典银屑病。因此有学者认为,TNF-α抑制剂引起的矛盾性银屑病与Ⅰ型干扰素、浆细胞样树突状细胞 (pDC)有关。TNF-α的阻断会抑制pDC的成熟,造成pDC累积及高水平Ⅰ型干扰素产生。在经典银屑病中,pDC产生的 IFN-α会驱动经典树突状细胞(conventional dendritic cell,cDC) 产生 IL-23,并随后激活辅助性T细胞 17 (Th17)。而在矛盾性银屑病患者中,研究发现cDC和T细胞数量明显减少(但仍然少量存在),这提示尽管Ⅰ型干扰素表达增加,但cDC缺乏成熟且无Th17细胞的活化。说明此过程中Ⅰ型干扰素抗原特异性 Th17 反应不存在,不再诱导适应性免疫的发生,而是使得先天免疫加强,其通过诱导趋化因子CXCL10、CXCL9募集DC、非特异性T细胞等先天免疫细胞,进而维持和放大矛盾性反应中皮肤局部的炎症反应,这可能导致IL-22过度表达,引起角质形成细胞过度增殖和去分化,导致矛盾性银屑病的发生[13-14]。其次,研究发现,INF-α增加可诱导趋化因子受体(如CXCR3)过度表达,该受体诱导T细胞迁移到银屑病真皮,随后使得细胞归巢到表皮,减少了Th1细胞向炎症起始部位的转运,从而使炎症相关细胞转移至其他部位或器官,尤其是皮肤,这或许也是一种潜在机制。

图4 TNF-α抑制剂引起矛盾性银屑病的潜在机制
研究人员推测矛盾性银屑病反应也可能与Th17细胞/调节性 T 细胞 (Treg) 比例失衡,导致IL-17A、IL-23表达增加有关[15-16]。另外,Th17 细胞产生的 IL-21也发挥着至关重要的作用。IL-21可以促进Th17相关炎症细胞因子的产生以及在TGF-β 的存在下抑制Treg的产生,进而通过抑制FoxP3促进Treg向Th17分化,从而加重炎症[17-18]。TNF-α的阻断也直接抑制皮肤中FoxP3的表达,促进银屑病样皮肤炎症[19]。
2.2TNF-α抑制剂引起矛盾性湿疹的机制 AD被认为是一种T细胞驱动的疾病,在急性期以Th2细胞因子为主,在慢性期Th1、Th17和相关细胞因子的表达增加,是一种“多轴”免疫疾病。TNF-α抑制剂引起湿疹的确切机制仍不清楚,可能与细胞因子平衡的改变和 Th17/Th1 细胞的抑制有关。多篇研究发现,使用TNF-α抑制剂后Th1/Th17 亚群显著下调,Th2 和 Treg 亚群随之上调[20-22]。这提示 TNF 拮抗作用可能会诱导从 Th1/Th17 表型向 Th2 表型的免疫漂移,并且 CD4+T 细胞的调节可有效改变银屑病表型,导致湿疹样矛盾性反应的发生。
2.3IL-4Rα抑制剂引起银屑病样矛盾性反应的机制 AD 患者在度普利尤单抗(IL-4Rα抑制剂)治疗期间发生银屑病的机制尚不清楚。一种解释是患银屑病样矛盾性反应的 AD 患者可能存在遗传倾向[23]。另外一种推测,也是目前最清楚的一种解释是由于免疫漂移,即度普利尤单抗对 Th2 途径的拮抗作用可能导致向 Th1 和 Th17 途径的转变,导致 Th1/Th17 介导的疾病,例如银屑病。有研究认为,IL-4 充当调节性细胞因子,可以选择性阻止抗原呈递细胞中的 IL-23 转录和分泌来消除 Th17 反应[24]。事实上,在用度普利尤单抗治疗期间出现银屑病样反应的 AD 患者皮损显示 IL-23A 表达增加,表明 Th17 通路被激活[25]。另一项实验中,发现使用度普利尤单抗治疗后,银屑病样皮损部位IL-13表达减少,而IL-17A从无到有,表达增加[26],这同样表明了Th17 通路的激活,有可能导致银屑病样矛盾性反应的发生。
2.4IL-17A抑制剂引起湿疹样矛盾性反应的机制 IL-17A抑制剂引起湿疹的机制仍不清楚。可能与IL-17A抑制剂阻断IL-17A相关通路,对 Th1/Th17 通路的抑制导致Th2 通路活化有关。但对于IL-17A受体抑制剂布罗达单抗而言,其会阻断由IL-17RA/IL-17RB 复合物介导的IL-17E 信号。由 IL-17RA/IL-17RE 复合物介导的 IL-17C 信号传导;前者对Th2 介导的炎症至关重要,后者与特应性湿疹的发病机制有关[27]。这解释了为什么由布罗达单抗诱导的矛盾性湿疹病例更少见。
2.5其他两种生物制剂引起的矛盾性反应的机制 IL-23p19 抑制剂和IL-12/23p40抑制剂乌司奴单抗是新兴的生物制剂,临床应用较晚,机制尚不清楚。IL-23p19抑制剂相关的湿疹样矛盾性可能与 Th1/Th17 轴向 Th2 轴转换有关[10,28]。乌司奴单抗诱导的AD湿疹中,有研究认为免疫球蛋白 E 参与其中,也可能与Th1/Th17 的阻断诱导向 Th2 反应的转变发生有关。而诱导的矛盾性银屑病可能由于 Th17 (IL-23) 和 Th1 (IL-12) 反应的阻断导致 IFN-α 的过度表达[8]。
3 生物制剂治疗出现的矛盾性反应对策
治疗矛盾性反应的首要任务是保持对基础疾病的控制,同时减轻矛盾性反应。对于中度和重度皮肤矛盾性反应,通常建议停用当前药物,改用其他靶点生物制剂或者使用传统疗法[29],也可以使用JAK(Janus kinase)抑制剂治疗,笔者团队曾使用JAK1选择性抑制剂乌帕替尼和阿布昔替尼成功治疗矛盾性湿疹和矛盾性银屑病,也曾有报道JAK1和JAK3非选择性抑制剂托法替布成功治疗中重度斑块状银屑病1例[30]。
对于严重反应,可能还需要额外治疗。大多数(但不是全部)矛盾性反应会随着停用刺激药物而缓解。但是,对于立即停用药物的适当时间以及需要停止治疗症状的严重程度,却并没有一个共识与规范。此外,还有研究人员报道了在发生矛盾性银屑病后,仍然继续使用TNF-α抑制剂一段时间后,症状居然得到了缓解[31]。这提示立即终止治疗或改用其他生物制剂可能不是唯一的选择。
4 总结
临床上矛盾性反应的发生率较低,但是随着新生物制剂的使用日益增加,矛盾性反应病例数量和临床表现也随之增加。对主要的矛盾性反应的种类和机制进行归纳总结,可以提高临床医生对矛盾性反应的意识,能够帮助临床医生更加规范合理地运用生物制剂。此外,对矛盾性反应发生机制的研究能够增加临床医生对原发病变的认识,为治疗皮肤慢性炎症性疾病提供新的方法与思路。未来仍需要对此类矛盾性反应进行大规模的持续监测,以全面评估生物制剂治疗带来的风险和益处,并更好地指导其临床应用。
