基于钆塞酸二钠增强肝胆期MRI 构建影像组学模型评估肝纤维化临床病理分期
2024-02-28任毓凡胡根文钟淑媛吕嘉淇卢浩钧邹锦森李欣明全显跃
任毓凡,胡根文,钟淑媛,吕嘉淇,卢浩钧,邹锦森,李欣明,全显跃
[1.南方医科大学珠江医院影像诊断科,广东 广州 510200;2.深圳市人民医院(暨南大学第二临床医学院)放射科,广东 深圳 518000]
肝纤维化(hepatic fibrosis, HF)是慢性肝脏疾病发展至肝硬化、甚至肝癌的重要环节,及早治疗可望逆转[1-2]。根据组织学分期,HF 分为S0~S4;对S0~S1 期以病因治疗及抗炎、保肝等对症治疗为主,而对S2~S4 期需积极抗HF 治疗。临床病理分期将HF S1~S4 期定义为HF,S2~S4 期为显著HF,S3~S4为进展期HF,S4 期为早期肝硬化[3]。本研究观察基于钆 塞 酸 二 钠 (gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid, Gd-EOB-DTPA)增强肝胆期(hepatobiliary phase, HBP)MRI 构建的影像组学模型评估HF 临床病理分期的价值。
1 资料与方法
1.1 研究对象 回顾性分析2016 年4 月—2023 年5月240 例于南方医科大学珠江医院及深圳市人民医院接受Gd-EOB-DTPA 增强MR 检查患者,男183 例、女57 例,年龄20~81 岁、平均(54.3±13.7)岁;203 例经病理学明确HF 分期,其中肝细胞癌(hepatocellular carcinoma, HCC)165 例、胆管癌14 例、良性肿瘤9 例、炎性增生性病变15 例,37 例排除慢性肝胆系统疾病及病毒性肝炎、临床诊断为HF S0 期。纳入标准:①接受Gd-EOB-DTPA 增强MR 检查,并于其后1 个月内接受肝穿刺活检/部分肝切除术;②MRI 质量佳;③检查前未接受抗HF 治疗或肝脏手术治疗。按照8∶2 比例将患者分为训练集(n=192)及验证集(n=48),训练集男143 例、女49 例,年龄20~81 岁、平均(54.6±13.5)岁,HF S0 期51 例、S1 期27 例、S2 期36 例、S3 期32 例及S4期46 例;验证集男40 例、女8 例,年龄28~80 岁、平均(52.9±14.5)岁,HF S0 期12 例、S1 期9 例、S2 期8 例、S3 期8 例及S4 期11 例。本研究经院伦理委员会批准(2017-YXZDK-002、LL-KY-2021059)。检查前患者均签署知情同意书。
1.2 仪器与方法 采用GE Voyager/Siemens Avanto/Philips Multiva/联影uMR 660 型1.5T MR 仪或Philips Ingenia/Philips Elition X/Siemens Skyra 3.0T超导型MR 仪及多通道腹部线圈行全肝脏扫描,采集脂肪抑制T1WI、脂肪抑制T2WI 及弥散加权成像。之后经肘静脉以流率1 ml/s 注射对比剂Gd-EOB-DTPA(拜尔)0.1 ml/kg 体质量,分别延迟18~23 s、45~60 s、120~180 s 及20 min 行动脉期、门静脉期、平衡期及肝胆期HBP 扫描,选取HBP 图像。1.5T MR 仪扫描参数:TR 4.29~5.90 ms,TE 1.96~2.50 ms,FOV(350~400)mm×(280~300)mm,矩阵(143~192)×(236~272),层厚3~5 mm,FA 10°~15°;3.0T MR 仪扫描参数:TR 3.20~3.50 ms,TE 1.12~1.34 ms,FOV(320~380)mm×(280~293)mm,矩阵(156~196)×(236~320),层厚4~6 mm,FA 10°~20°。
1.3 图像分析 由1 名具有5 年影像学诊断经验的医师(医师1)采用RadiAnt DICOM Viewer 软件于肝门水平层面HBP 图像中避开大血管、胆管、图像伪影、病灶及肝脏边缘,分别于肝左内叶、左外叶、右前叶及右后叶手动勾画面积1~3 cm2类圆形ROI,以各ROI 信号强度(signal intensity, SI)平均值为SI肝脏;于双侧竖脊肌各勾画1 个、于脾脏勾画3 个面积1~3 cm2类圆形ROI,分别测算其SI 平均值并记为SI竖脊肌及SI脾脏;计算肝脏-肌肉SI 比值(SI ratio, SIR)(SIR1)及肝脏-脾脏SIR(SIR2):SIR1=SI肝脏/SI竖脊肌,SIR2=SI肝脏/SI脾脏。由1 名具有20 年腹部MRI 诊断经验的医师(医师2)对ROI 进行复核,意见不一致时经协商决定。见图1A。
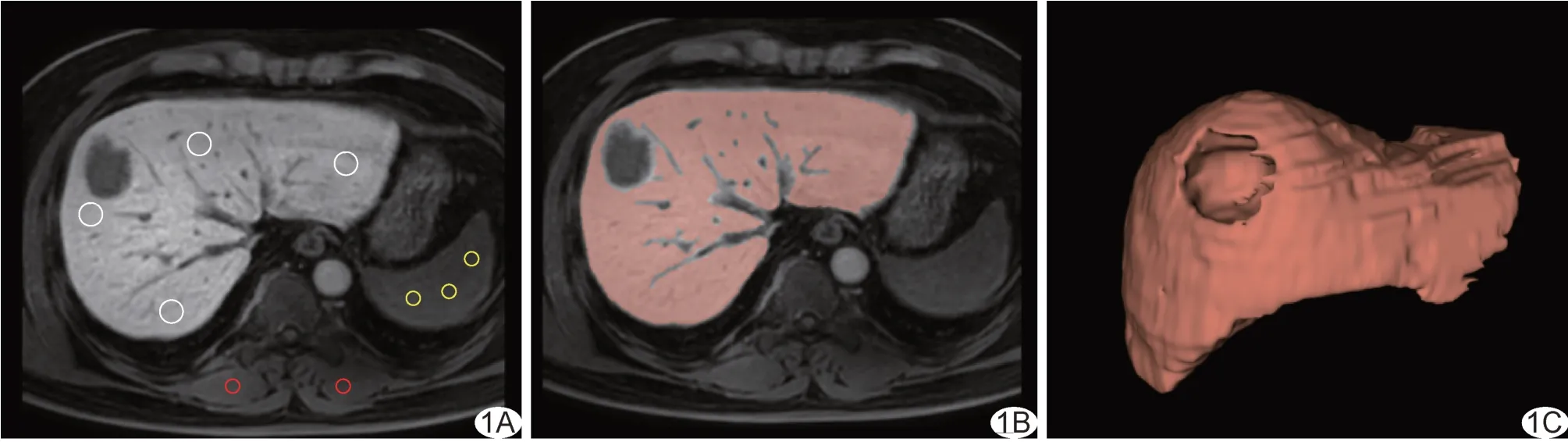
图1 勾画ROI 示意图 A.选取肝门水平层面HBP 图像,分别于肝左内叶、左外叶、右前叶及右后叶(白圈),双侧竖脊肌(红圈)及脾脏(黄圈)勾画ROI; B、C.于预处理后的HBP 图中勾画全肝组织所获二维ROI(B)及三维VOI(C)示意图
1.4 提取及筛选特征 采用Python 3.7 对HBP 图像进行重采样及灰度归一化,并导入ITK-SNAP 软件。由医师1 避开大血管、胆管、图像伪影、病灶及肝脏边缘,逐层手动勾画全肝组织作为ROI 及感兴趣容积(volume of interest, VOI)(图1B、1C);由医师2 进行复核,意见不一致时经讨论决定。采用PyRadiomics软件包提取HBP 图中ROI 及VOI 的影像组学特征,主要包括一阶特征、形状特征、二阶特征及高阶特征;以Z-score 法行归一化处理;分别以t检验、Spearman 相关分析及最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法筛选训练集特征,获得最优影像组学特征。
1.5 构建模型与统计学分析 采用Python 3.7 及SPSS 25.0 统计分析软件。以表示正态分布计量资料,以单因素方差分析行多组间比较,以LSD-t法行两两比较。以χ2检验比较计数资料。基于最优影像组学特征,分别构建评估HF、显著HF、进展期HF 及早期肝硬化的机器学习(machine learning, ML)模型,包括逻辑回归(logistic regression, LR)、支持向量机(support vector machine, SVM)、K 邻近法(K-nearest neighbor, KNN)、随机森林(random forest, RF)、极限梯度提升(eXtreme gradient boosting, XGBoost)、轻量梯度提升机(light gradient boosting machine, LightGBM)及多层感知器(multilayers perceptron, MLP)模型,筛选诊断效能最高ML 模型并计算其影像组学标签。以SIR1及SIR2中单因素方差分析显示差异有统计学意义者构建上述ML 模型并计算SIR 标签;采用多因素logistic 回归模型基于影像组学标签及SIR 标签构建SIR-影像组学联合模型。采用受试者工作特征(receiver operating characteristic, ROC)曲线分析各模型评估HF 临床病理分期的效能;以决策曲线评估各模型的临床获益。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较 训练集与验证集患者年龄、性别及HF分期差异均无统计学意义(t=0.78、χ2=1.66、χ2=0.71,P均>0.05)。
2.2 SIR 评估HF 临床病理分期 240 例S0~S4 期HF 患者SIR1及SIR2差异均有统计学意义(P均<0.05);两两比较,S0 期SIR1与S1~S4 期的SIR1、S0 期SIR2与S2~S4 期的SIR2、S1 期与S4 期的SIR2差异有统计学意义(P均<0.05)。SIR1评估HF、显著HF、进展期HF 及早期肝硬化的曲线下面积(area under the curve, AUC)分别为0.70、0.67、0.63 及0.64,SIR2分别为0.71、0.69、0.65 及0.65。见表1、2。
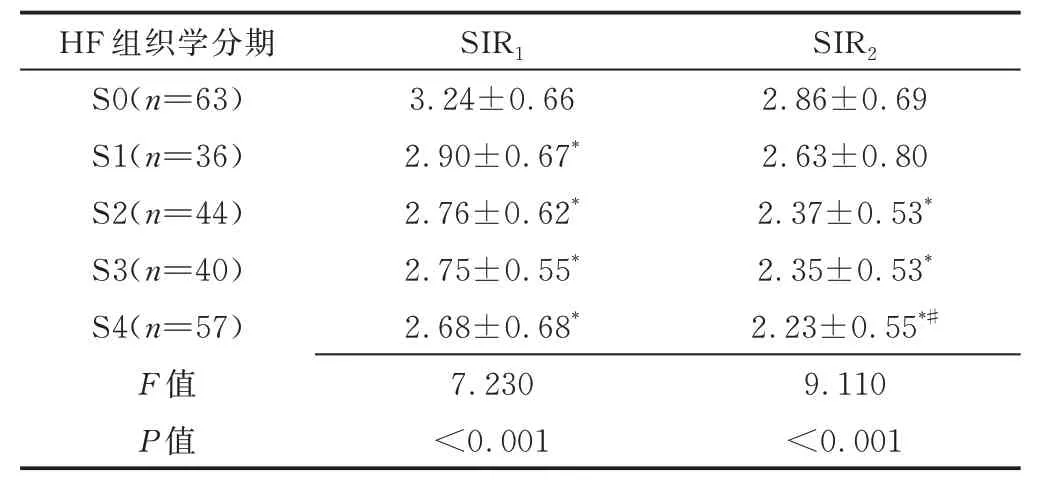
表1 240 例S0~S4 期HF 患者SIR1与SIR2比较
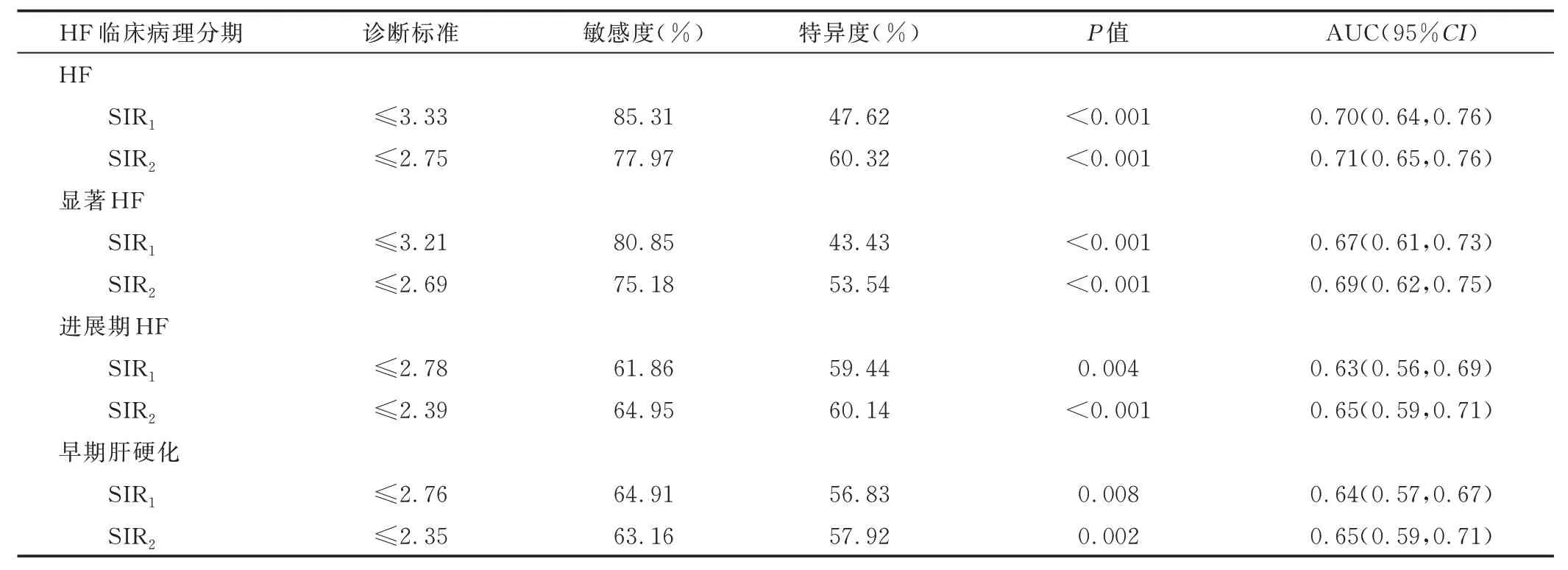
表2 SIR1及SIR2诊断240 例不同临床病理分期HF 患者的效能
2.3 影像组学模型评估HF 临床病理分期 基于HBP 图共提取1 835 个影像组学特征;评估HF、显著HF、进展期HF 及早期肝硬化的ML 模型分别纳入10、11、22 及11 个影像组学特征。
SVM 模型评估HF 效能最高,其在验证集的敏感度、特异度、准确率、F1 值及AUC 分别为75.00%、100%、81.25%、0.86 及0.87;SVM 模型评估显著HF效能最高,其在验证集的敏感度、特异度、准确率、F1值及AUC 分别为88.89%、80.95%、85.41%、0.87 及0.82;LightGBM 模型评估进展期HF 效能最高,其在验证集的敏感度、特异度、准确率、F1 值及AUC 分别为89.47%、75.86%、81.25%、0.79 及0.81;KNN 模型评估早期肝硬化效能最高,其在验证集的敏感度、特异度、准确率、F1 值及AUC 分别为63.64%、86.49%、81.25%、0.61 及0.80。见表3。
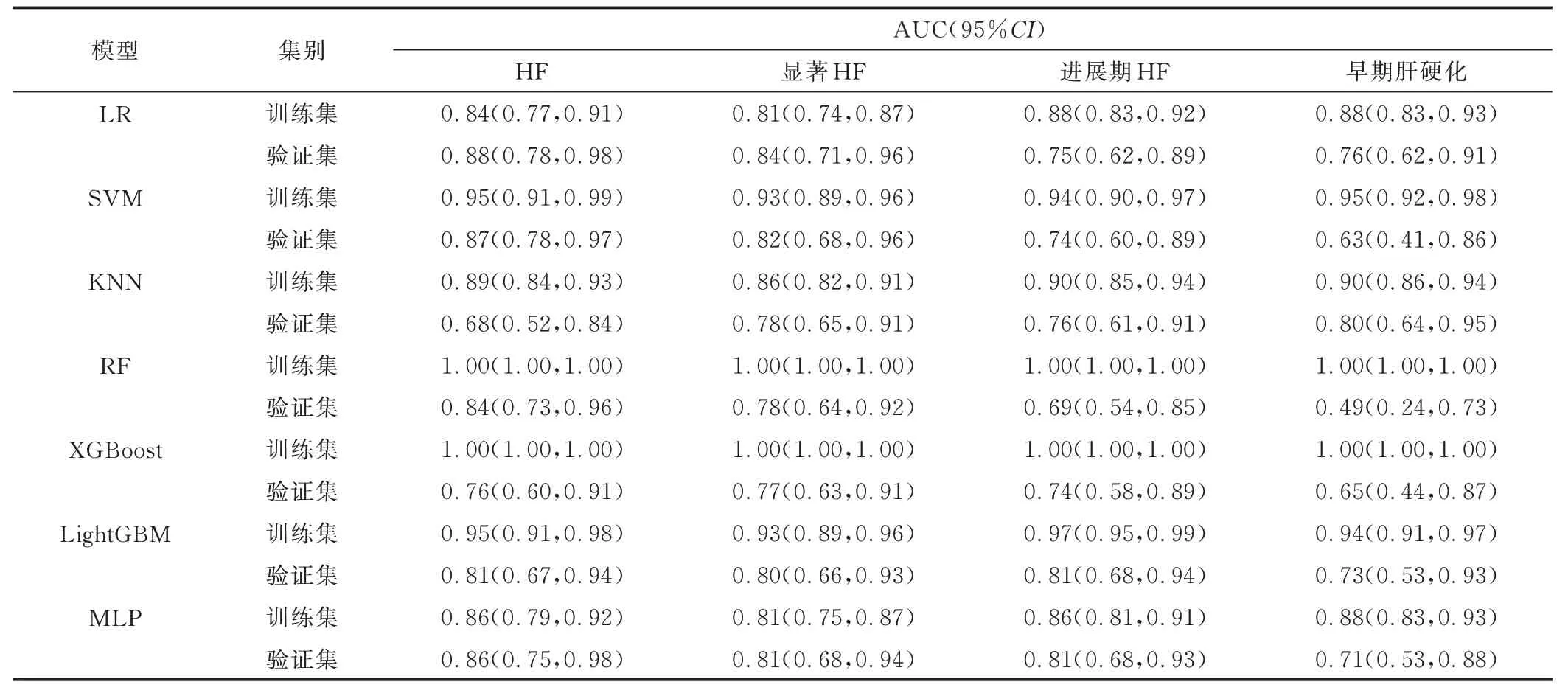
表3 各模型评估训练集与验证集HF 临床病理分期效能
2.4 SIR-影像组学联合模型评估HF 临床病理分期 SIR-影像组学联合模型评估训练集HF、显著HF、进展期HF 及早期肝硬化的AUC 分别为0.98、0.93、0.99 及0.91,评估验证集分别为0.88、0.82、0.82 及0.81。决策曲线显示,SIR-影像组学联合模型可在较大范围内获得临床收益。见表4 及图2、3。

表4 SIR-影像组学联合模型评估训练集与验证集HF 临床病理分期效能

图2 SIR-影像组学联合模型评估不同临床病理分期HF 的ROC 曲线 A.HF;B.显著HF; C.进展期HF; D.早期肝硬化 图3 SIR-影像组学联合模型评估不同临床病理分期HF 的决策曲线A.HF; B.显著HF; C.进展期HF; D.早期肝硬化
3 讨论
Gd-EOB-DTPA 增强HBP MRI 的SI 与HF 严重程度呈负相关,但SI 易受射频放大器功率、脉冲序列参数、患者胆红素水平及肝铁沉积等因素影响,而引入竖脊肌、脾脏信号可对SI 值进行校正[4]。既往研究[5]报道, S3~S4 期HF 患者HBP SIR1显著低于S0~S2期者。基于Gd-EOB-DTPA 增强MRI SIR2诊断S1~S2 期与HF S3~S4 期HF 的准确率分别为91% 及96%[6]。本研究发现S0~S4 期HF 患者SIR1及SIR2差异均有统计学意义(P均<0.05),但以SIR1与SIR2评估HF临床病理分期的效能欠佳,AUC仅为0.63~0.71。
影像组学可提取医学图像中的高通量特征,但由于算法不同,各影像组学模型评估效能存在差异。PARK 等[7]基于Gd-EOB-DTPA 增强MRI 构建的LR模型评估验证集HF 组织学分期的AUC 为0.89~0.91。本研究通过提取HBP 图特征构建多个ML 模型,包括LR、SVM、KNN、RF、XGBoost、LightGBM 及MLP 模型,除RF 及XGBoost 模型存在过拟合现象外,其余模型评估HF 临床病理分期效能为良好/中等,其在训练集的AUC 为0.81~0.97,在验证集为0.63~0.87。本研究结果显示,SVM 模型评估HF 及显著HF 的效能最高(AUC 分别为0.87 及0.82),LightGBM 模型评估进展期HF 效能最高(AUC 为0.81),KNN 模型评估早期肝硬化效能最高(AUC 为0.80),提示对于SVM 模型诊断早期HF 具有一定优势,支持NI 等[8]观点;而以单一分类器模型评估HF 进展程度可能导致结果偏差。
本研究将影像组学方法与HBP SIR 相结合而构建的SIR-影像组学联合模型评估HF 临床病理分期效能良好,在训练集的AUC 为0.91~0.99,而在验证为0.81~0.88,均高于单一影像组学模型。
综上所述,基于Gd-EOB-DTPA 增强HBP MRI构建的影像组学模型有助于评估HF 临床病理分期,联合肝胆期SIR 可进一步提高其评估效能。但本研究为单中心回顾性观察,S0~S4 期HF 样本分布不均,仅关注HBP 图像数据,未探讨多序列影像的价值,亦未能进行外部验证,有待后续加以完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:任毓凡研究设计和实施、数据分析、撰写和修改文章;胡根文指导、研究设计和实施、经费支持;钟淑媛研究实施、统计分析;吕嘉淇、卢浩钧和邹锦森研究实施、图像分析;李欣明指导、修改文章;全显跃指导、经费支持。
