肝动脉灌注化疗联合仑伐替尼治疗巴塞罗那临床肝癌 B 或C 期肝细胞癌
2024-02-28于海东郭应兴雷振武杨海明孙世蒙马存凯
于海东,郭应兴,雷振武,杨海明,孙世蒙,马存凯
(青海大学附属医院介入诊疗科,青海 西宁 810000)
肝细胞癌(hepatocellular carcinoma, HCC)在世界范围内发生率位居第七,每年新增病例超过84 万、死亡病例超过78 万[1]。TACE 是目前治疗不宜手术HCC的重要手段之一,但效果仍不够满意[2-3]。相比TACE,肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)可在带给HCC 患者明显生存获益的同时减少并发症发生率[4]。仑伐替尼是一种酪氨酸酶受体抑制剂,可抑制血管内皮生长因子激活,对HCC 等多种肿瘤具有生长抑制作用[5]。本研究观察HAIC 联合仑伐替尼治疗巴塞罗那临床肝癌(Barcelona clinic liver cancer, BCLC)B 或C 期HCC 效果,以及患者总生存期(overall survival, OS)影响因素。
1 资料与方法
1.1 研究对象 回顾性分析2019 年6 月—2021 年6月青海大学附属医院收治的104 例BCLC B 或C 期HCC 患者资料,其中46 例接受HAIC 联合仑伐替尼治疗(观察组)、58 例接受单一HAIC(对照组)。HAIC 均由具有5 年及以上介入治疗肝癌经验的医师采用FOLFOX 方案完成。对观察组予口服甲磺酸仑伐替尼胶囊,每次8 mg(体质量≥60 kg 时每次12 mg),4次/日。 本研究经院伦理委员会审核批准(SL-2022113);治疗前患者均签署知情同意书。
1.2 评估不良反应及疗效 于HAIC 后1个月内观察不良反应。于HAIC后3、6个月及1年,根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST)[6]针对存活患者评估临床疗效(图1),分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD);记录患者无进展生存期(progression free survival, PFS)和OS。

图1 观察组患者,女,55 岁,HCC A.治疗前腹部平扫CT 图示肝内多发不均匀密度占位; B.HAIC 中经肝动脉造影图示肿瘤由多支动脉供血,可见肿瘤染色; C.治疗后6 个月腹部平扫CT 图示肿瘤较前显著缩小,mRECIST 评价为PR
1.3 统计学分析 采用 SPSS 26.0 统计分析软件。以描述正态分布计量资料,组间行独立样本t检验;以中位数(上下四分位数)描述偏态分布计量资料,组间行Mann-WhitneyU检验。以例描述计数资料,组间二分类资料行χ2检验或Fisher 精确概率法比较,等级资料行等级资料秩和检验。生存资料分析采用Kaplan-Meier 曲线及log-rank 检验,并采用Cox 回归分析评估影响OS 的因素,计算风险比(hazard ratio,HR)。P<0.05 为差异有统计学意义。
2 结果
2.1 基本资料 2 组患者性别、年龄等一般资料及治疗前检查结果差异均无统计学意义(P均>0.05)。见表1。
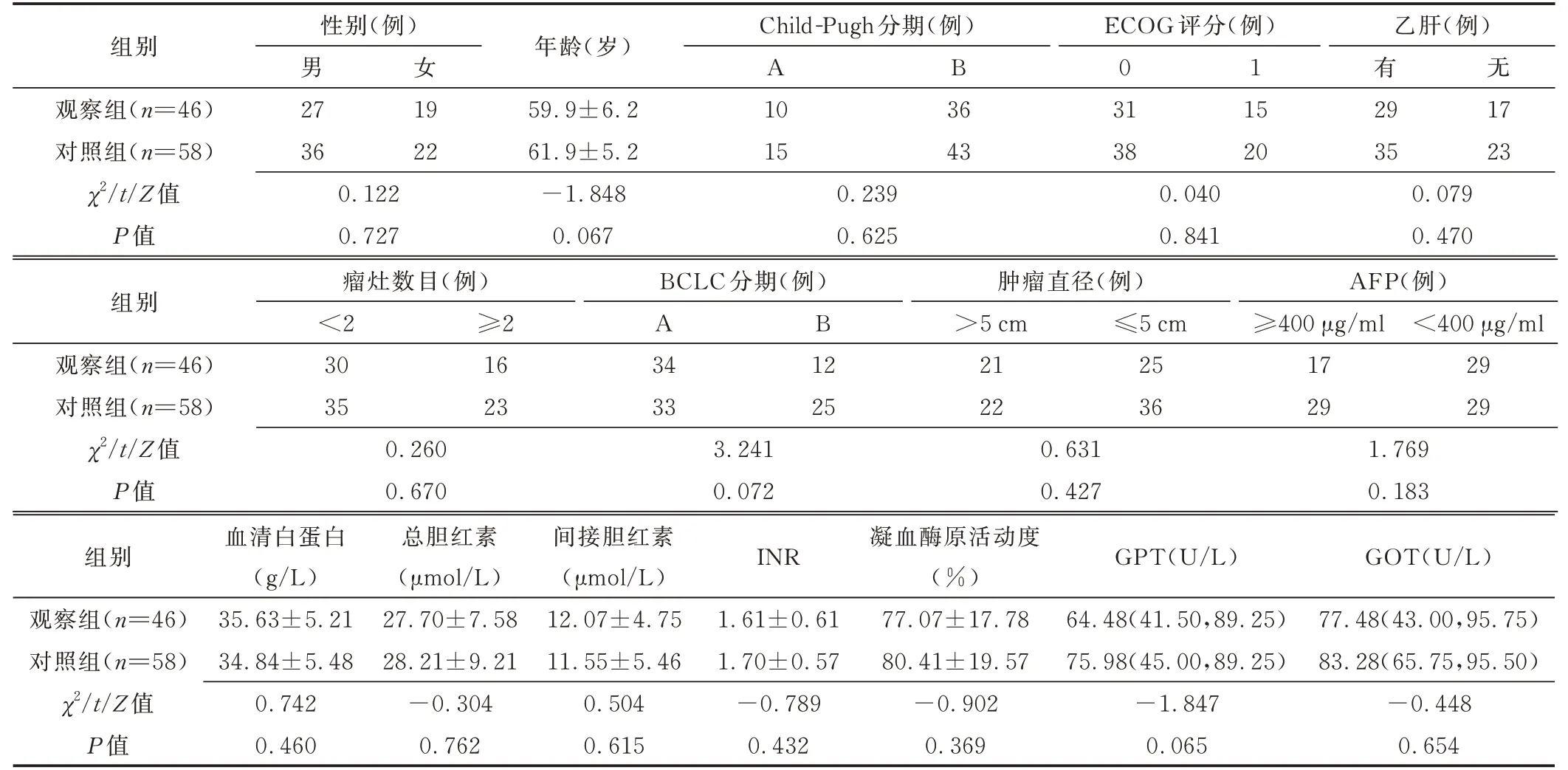
表1 BCLC B 或C 期HCC 患者一般资料及治疗前检查结果比较
2.2 随访 总随访时间为2 年。第1 年内观察组患者死亡16 例、失访3 例,包括治疗后3~5 个月死亡2 例、失访1 例,以及6 个月~1 年死亡14 例、失访2 例;对照组死亡22 例、失访5 例,包括治疗后3~5 个月死亡8例、失访4 例,以及6 个月~1 年死亡14 例、失访1 例。
2.3 不良反应 治疗后1 个月内不良反应包括手足综合征、腹泻、白细胞减少、总胆红素升高及皮疹等。观察组皮疹发生率高于对照组(P<0.05),其余不良反应发生率组间差异无统计学意义(P均>0.05)。见表2。
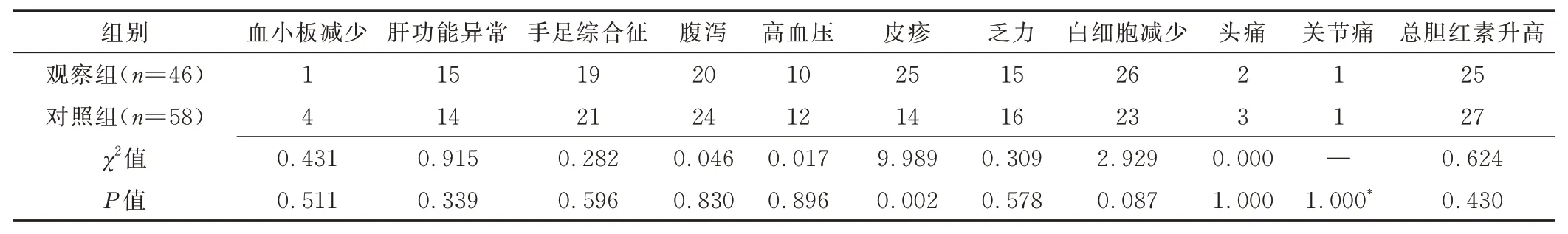
表2 治疗后1 个月BCLC B 或C 期HCC 患者不良反应(例)
2.4 疗效 HAIC 治疗后3、6 个月,观察组mRECIST 评估结果均优于对照组(P均<0.05);治疗后1 年,组间mRECIST 评估结果差异无统计学意义(P>0.05)。见表3。
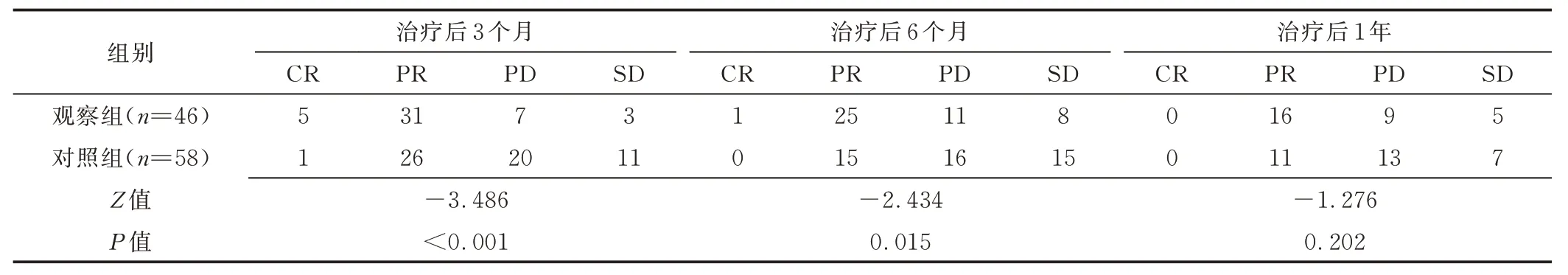
表3 BCLC B 或C 期HCC 疗效比较(例)
2.5 生存曲线 观察组中位OS 为14 个月、对照组为11 个月,观察组总生存率高于对照组(P<0.05),见图2;相比对照组,观察组HR为0.61[95%CI(0.37,0.99)]。观察组中位PFS 为9 个月、对照组为8 个月,组间无进展生存率差异无统计学意义(P>0.05),见图3;相比对照组,观察组HR为0.93[95%CI(0.60,1.45)]。
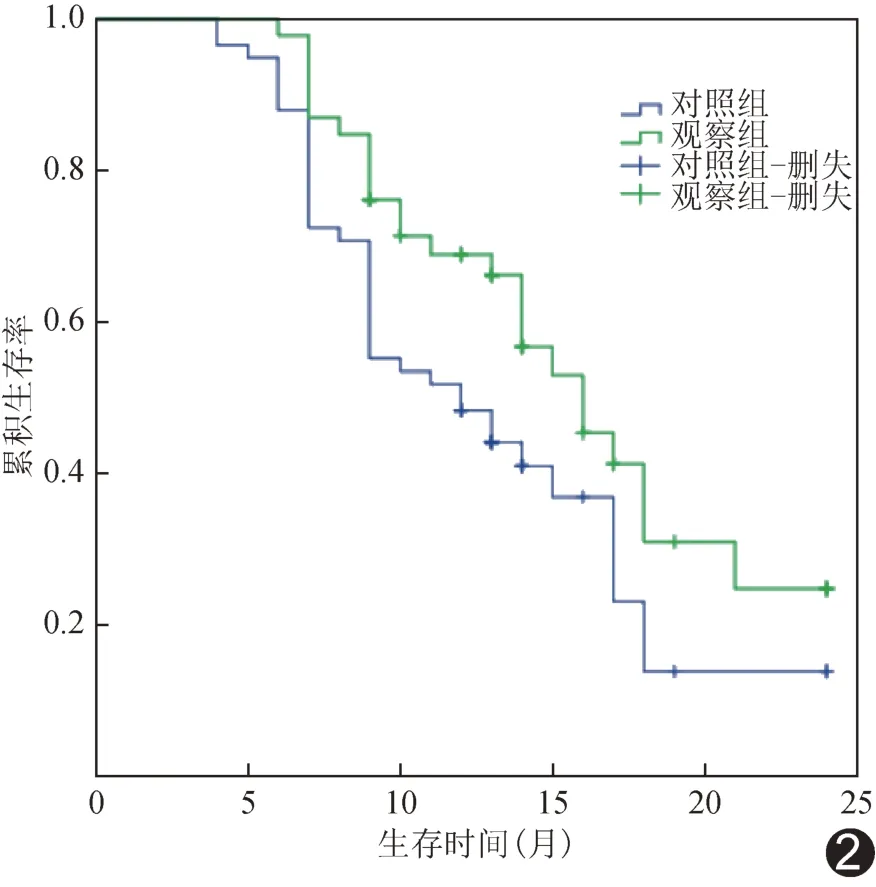
图2 2 组HCC 患者总生存率生存曲线
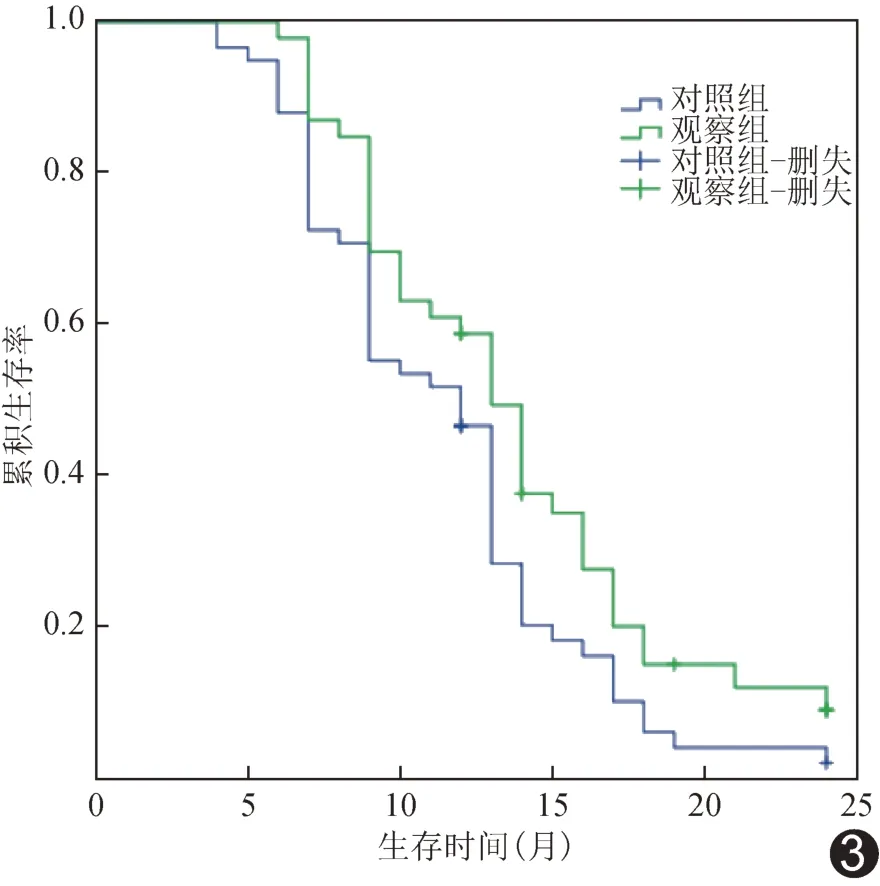
图3 2 组HCC 患者无进展生存率生存曲线
2.6 OS 影响因素 单因素Cox 回归分析显示,ECOG 评分、治疗前AFP、肿瘤数目及BCLC 分期均可能影响OS(P均<0.05);将上述因素与治疗方案同时纳入多因素Cox 回归分析模型,结果显示,相比单一HAIC,HAIC 联合仑伐替尼[HR=0.425,95%CI(0.255,0.791)]可延长患者OS;治疗前ECOG 评分 0相对1[HR=0.412,95%CI(0.234,0.726)],AFP<400 μg/ml 相对AFP≥400 μg/ml[HR=0.472,95%CI(0.269,0.810)],瘤灶数目≤2 相对≥3[HR=0.380,95%CI(0.217,0.662)]以及BCLC B期相对C期[HR=0.275,95%CI(0.141,0.523)]均为OS 独立保护因素(P均<0.05)。见表4。
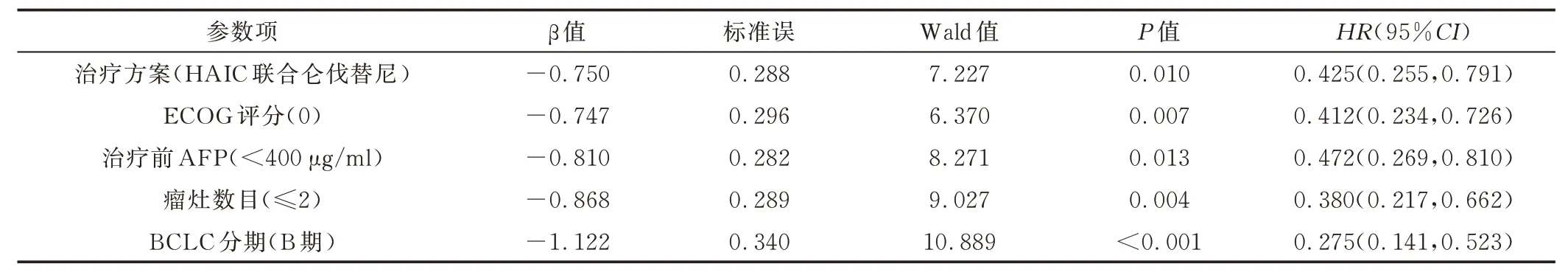
表4 BCLC B 或C 期HCC 患者OS 的多因素Cox 回归分析结果
3 讨论
日本肝病协会最新指南[7]推荐将HAIC 作为治疗无肝外转移的多发HCC 的标准方案之一。目前TACE 是治疗无法手术切除HCC 的重要手段。《原发性肝癌诊疗指南(2022 年版)》[2]指出,TACE 可作为治疗中国肝癌分期Ⅱ或Ⅲ期HCC 的主要方式。与TACE 相比,HAIC 更易反复开展,可作为治疗不能耐受TACE 者的备用方案,有助于延长OS 和PFS[8-9]。以FOLFOX 方案行HAIC 可通过灌注氟尿嘧啶、亚叶酸钙和奥沙利铂等化疗药物诱导肿瘤细胞死亡[10-11]。仑伐替尼可作用于VEGFR1-3、FGFR、KIT 及PDGFR 等多个靶点或通路而延长患者生存期[2,12-14],是治疗中晚期HCC 的重要药物。
HAIC 不良反应较少,可用于治疗BCLC 各分期HCC[15]。既往研究[16]表明,在介入治疗HCC 基础上联合应用仑伐替尼可能增加不良反应发生率,但可通过适当的术后管理加以控制。本研究2 组治疗后1 个月最常见不良反应包括手足综合征、腹泻、白细胞减少及总胆红素升高等,发生率均在可接受的范围内;观察组皮疹发生率高于对照组。
陶杰等[10]发现以FOLFOX 方案HAIC 联合卡瑞利珠单抗及仑伐替尼治疗HCC 可提高客观缓解率并延长OS 及PFS。王雅静等[17]利用FOLFOX 方案HAIC 治疗21 例BCLC C 期HCC,3 个月后总缓解率和疾病控制率分别达57.14%和95.24%。本研究结果显示,治疗后3、6 个月存活患者中,观察组mRECIST 评估结果优于对照组,且随访期间观察组总生存率高于对照组;多因素Cox 回归分析亦显示,HAIC 联合仑伐替尼可延长患者OS。
既往研究[18]提示ECOG 评分可影响HCC 患者的生存率。肿瘤数目及肿瘤分期与肿瘤复发相关,而肿瘤复发影响患者预后[19]。本研究发现,相比单一HAIC,HAIC 联合仑伐替尼有助于延长OS;相比治疗前ECOG 评分1、AFP≥400 μg/ml、瘤灶数目≥3 及BCLC C 期,治疗前ECOG 评分0、AFP<400 μg/ml、瘤灶数目≤2 及BCLC B 期均为HCC 患者OS 的独立保护因素。
综上,HAIC 联合仑伐替尼治疗BCLC B 或C 期HCC 安全、有效;治疗前ECOG 评分、AFP 水平、瘤灶数目及BCLC 分期均可影响HCC 患者OS。但本研究为单中心回顾性分析,且样本量较小,有待通过高质量大样本研究进一步观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:于海东指导、查阅文献、撰写和修改文章、经费支持;郭应兴指导、查阅文献、修改文章;雷振武统计分析、审阅文章;杨海明统计分析、修改和审阅文章;孙世蒙查阅文献;马存凯修改和审阅文章。
