老年人自身免疫性肝病自身抗体谱的检测及临床特征
2024-02-28洪海龙占启川
洪海龙 占启川
自身免疫性肝病(autoimmune liver disease,AILD)是免疫性疾病,具有复杂的发病机制,具体机制尚不明确[1-3]。通常认为,抗原激活是AILD 发病的主要影响因素,病毒感染等因素是AILD 的常见诱因[4-6]。麻疹、乙肝病毒等感染肝组织,激活肝细胞膜表层人白细胞抗原(human leukocyte antigen,HLA),进而加速自身B 细胞抗体释放,导致肝脏组织受损和肝功能损伤,严重时诱发肝硬化甚至肝功能衰竭,对患者生命健康造成严重威胁。上述病原体均具有特异性自身抗体,滴度较高,基于此原理对AILD 患者进行自身抗体谱检测,以期准确诊断、鉴别疾病[7]。本文选取福建医科大学附属第一医院泉港总医院2020 年7 月—2023 年6 月接诊的AILD 老年患者90 例,说明自身抗体谱检测方法,分析检测结果,总结AILD 临床特征。
1 资料与方法
1.1 一般资料
选取福建医科大学附属第一医院泉港总医院2020 年7 月—2023 年6 月90 例老年AILD 患者。纳入标准:(1)符合《自身免疫性肝病基础与临床》[8]中AILD 的诊断标准;(2)资料完整;(3)年龄≥60 岁;(4)沟通能力良好。排除标准:(1)合并酒精性肝硬化;(2)合并肝部肿瘤;(3)合并血液系统疾病;(4)合并传染病。根据病情分为A 组、B 组、C 组,各30 例。A 组为自身免疫性肝炎(autoimmune hepatitis,AIH),男15 例,女15 例;年龄65~83 岁,平均(76.23±5.29)岁。B 组为原发性胆汁性肝病(primary biliary liver disease,PBC),男16 例,女14 例;年 龄65~82 岁,平均(76.21±5.32)岁。C 组为原发性硬化胆管病(primary sclerosing cholangitis,PSC),男14 例,女16 例;年龄66~84 岁,平均(76.19±5.30)岁。3组一般资料比较,差异无统计学意义(P>0.05),有可比性。本研究取得患者家属同意,获得医院伦理委员会批准。
1.2 方法
(1)采集3 mL 晨间空腹静脉血,真空采集管保存血液样本。以3 000 r/min 转速离心处理血样10 min,取血清,专业冰箱冷藏备用,冷藏温度为-20 ℃。(2)间接免疫荧光法检测:间接免疫荧光法检测血清抗核抗体(antinuclear antibody,ANA)、抗线粒体抗体(anti-mitochondrial antibody,AMA)、抗平滑肌抗体(anti-smooth muscle antibody,SMA)。(3)抗原检测:采用人喉表皮样癌细胞(HEp-2)基质、大鼠胃基质冰冻生物薄片进行抗原检测。1 ∶100 比例配比待检血清,温浴处理基质30 min,洗涤基质,置入有异硫氰酸荧光素标记的羊抗人IgG,等待30 min,然后洗片、封片。使用荧光显微镜观察待检样本。ANA、AMA 阳性标准为组织、细胞可见特异性黄绿色荧光。(4)免疫印迹法检测:采用免疫印迹法测定抗可溶性肝抗原/肝胰抗原(soluble liver antigen/liver pancreas,SLA/LP)、抗肝肾微粒体(liver-kidney microsomal,LKM)抗体Ⅰ型。使用硝酸纤维薄膜层包被处理基因重组表达抗LKM 抗体Ⅰ型、SLM/LP 抗原,分别包被相对分子质量不同的5 种AMA-M2 亚型抗原。1 ∶50 配比处理待检血清,取30 μL 使用1.5 mL 稀释液稀释处理,然后观察膜反应变化。在常规温度下振荡孵育持续l h,洗膜后滴入抗人IgG(有酶标记),常温下振荡孵育1 h。然后洗膜处理,滴入酶标记抗人IgG,常温水平幻蝶宫1 h,达到要求后,使用5-溴-4-氯-3-吲哚基-磷酸盐(5-Bromo-4-chloro-3-indolyl phosphate,BCIP)/四唑硝基蓝(nitrotetrazolium blue chloride,NBT)显色处理10 min。利用蒸馏水终止反应。对比标准对照条带图,判断SLA/LP、抗LKM 抗体Ⅰ型阳性结果,特定区域条带着色、颜色清晰视为阳性。
1.3 观察指标
(1)AMA、ANA 阳性率:比较3 组AMA(≥1 ∶5为阳性)和ANA(≥1 ∶80 为阳性)阳性率。(2)SLA/LP 抗LKM 抗体Ⅰ型、SMA 滴度检测:比较3 组SLA/LP 阳性率(采用免疫印迹法检测时,对照条带图显示清晰的紫色为阳性)、抗LKM 抗体Ⅰ型阳性率(采用免疫印迹法检测时,对照条带图显示清晰的紫色为阳性)、SMA 滴度阳性率(滴度≥1 ∶320)。(3)并发症发生率:统计肝硬化、消化性溃疡、胆囊结石伴慢性胆囊炎、高血压、贫血、慢性乙型肝炎、干燥综合征、系统性红斑狼疮、类风湿关节炎等并发症发生率。
1.4 统计学处理
2 结果
2.1 3 组血清AMA、ANA 阳性率比较
B 组AMA 阳性率高于A 组、C 组,差异有统计学意义(P<0.05);A 组ANA 阳性率高于B 组、C 组,差异有统计学意义(P<0.05);B 组与C 组ANA 阳性率、A 组与C组AMA 阳性率比较,差异无统计学意义(P>0.05)。见表1。
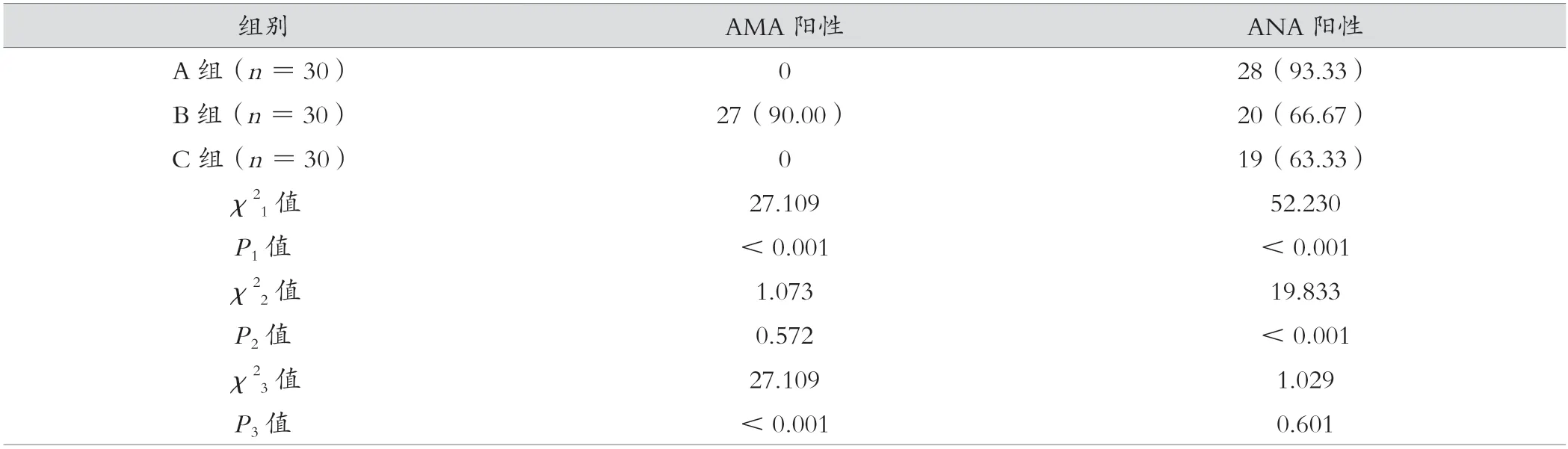
表1 A 组、B 组、C 组血清AMA、ANA 阳性率比较[例(%)]
2.2 3 组血清SLA/LP、抗LKM 抗体Ⅰ型、SMA 滴度阳性率比较
A 组SLA/LP 阳性率高于B 组、C 组,差异有统计学意义(P<0.05);A 组抗LKM 抗体Ⅰ型阳性率高于B 组、C 组,差异有统计学意义(P<0.05);A 组SMA 滴度阳性高于B 组、C 组,差异有统计学意义(P<0.05)。见表2。
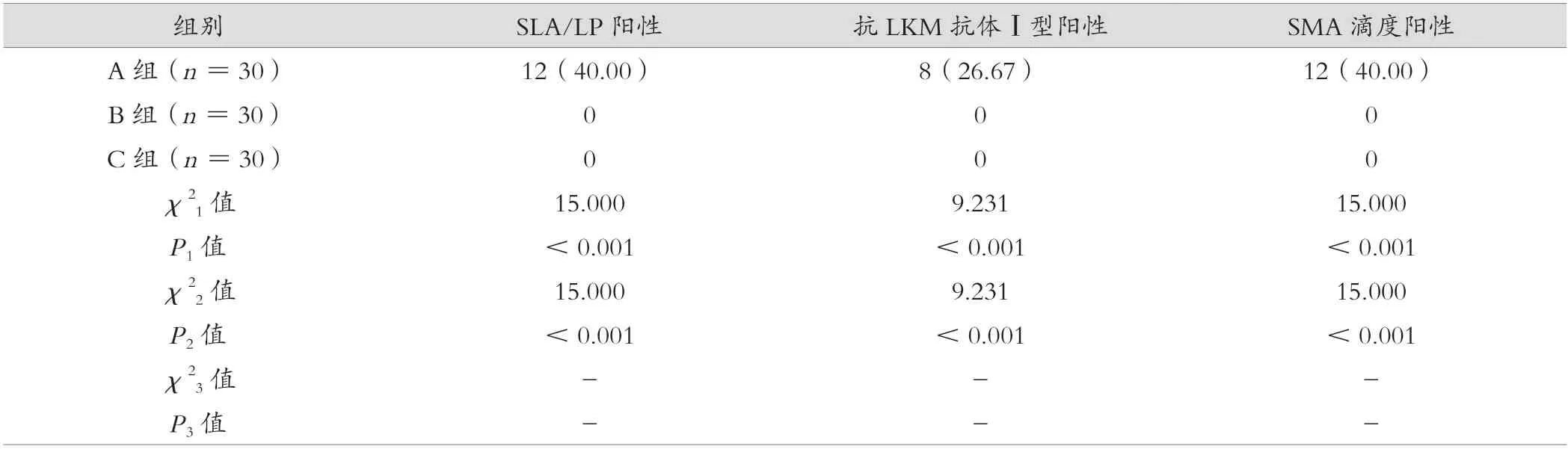
表2 A 组、B 组、C 组血清SLA/LP、抗LKM 抗体Ⅰ型、SMA 滴度阳性率比较[例(%)]
2.3 3 组并发症发生率比较
肝硬化发生率B 组>A 组>C 组,差异有统计学意义(P<0.05);A 组胆囊结石伴慢性胆囊发生率低于C组、B 组,差异有统计学意义(P<0.05);3 组高血压、消化性溃疡、贫血、慢性乙型肝炎、干燥综合征、系统性红斑狼疮、类风湿关节炎发生率比较,差异无统计学意义(P>0.05)。见表3。
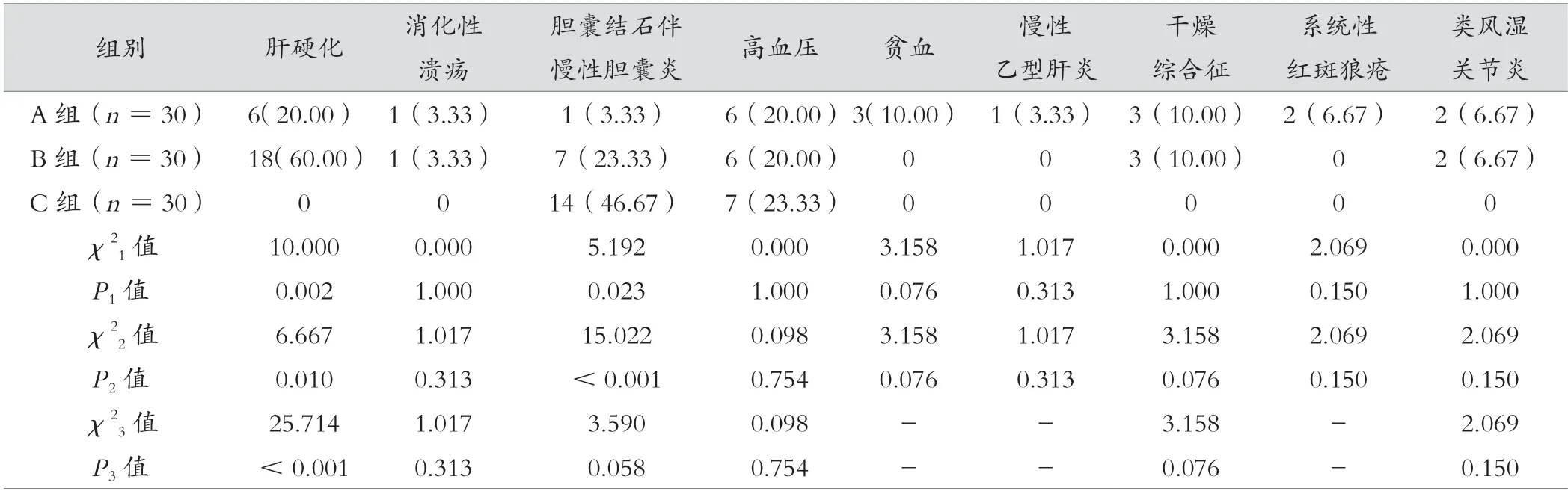
表3 A 组、B 组、C 组并发症发生率比较[例(%)]
3 讨论
AILD 即肝脏组织受到免疫功能异常、免疫应答等自身免疫系统攻击影响发生病变,通常起病隐匿而且无典型症状。从组织病理学、免疫学角度分析,可将AILD 分为AIH、PBC、PSC 等疾病类型[9]。准确检测AILD,科学疾病分型,对于临床精准治疗具有重要意义[10]。自身抗体谱检测是现代比较先进、可靠的检测方法[11]。通过综合检测和免疫分析,可有效确诊上述疾病,指导医师科学治疗[12]。
本研究体现了《自身免疫性肝病基础与临床》[8]的临床参考或执行标准。本研究中,B 组AMA 阳性率高于A 组、C 组,差异有统计学意义(P<0.05);A 组ANA 阳性率高于B 组、C 组,差异有统计学意义(P<0.05);A 组SLA/LP、抗LKM 抗体Ⅰ型阳性率高于其他类型AILD 患者,此外,A 组SMA 滴度阳性率高于B 组、C 组,差异有统计学意义(P<0.05)。
自身抗体谱检测可用于早期诊断AILD[13]。血清AMA可特异性识别PBC,SLA/LP 在AIH 检测中具有较高敏感度[14-15]。不同类型AILD 患者血清ANA 指标存在一定差异,对AIH 具有显著影响[16]。AIH 患者ANA 阳性率显著升高[17]。PBC 患者、PSC 患者ANA 水平出现一定程度变化[18]。正常情况下,针对健康体检者进行血清ANA 检测时,结果应呈现为阴性[19]。自身抗体谱检测中,ANA 具有高敏感性,是现代筛查AILD 的重要手段,被视为AILD 标志物[20]。PBC患者常见AMA 激活。AMA 检测常见AMA-M2 阳性,是PBC 血清特征性自身抗体。PBC 患者常见血清AMA 检测阳性结果。在PBC 筛查中,血清AMA 可作为诊断敏感性指标。PSC 为AILD 高发性病型,自身抗体谱检测显示,部分PSC患者出现ANA 阳性结果,而PSC 患者血清AMA 通常为阴性结果。SMA 滴度≥1 ∶320、SLA/LP、抗LKM 抗体Ⅰ型1 值、P1值为A 组、B 组比较,χ22 值、P2值为A 组、C 组比较,χ23 值、P3值为B 组、C 组比较。1 值、P1值为A 组、B 组比较,χ22 值、P2值为A 组、C 组比较,χ23 值、P3值为B 组、C 组比较。
注:χ21 值、P1值为A 组、B 组比较,χ22 值、P2值为A 组、C 组比较,χ23 值、P3值为B 组、C 组比较。检测等显示,PSC 患者通常为阴性结果。PSC 鉴别与诊断是AILD 诊断难点,应结合既往肝病史,分析影像学检查结果,实施综合诊断以降低PSC 误诊风险。并发症方面,AILD 患者因为存在免疫系统疾病和肝损伤,常合并多种疾病,其中,B 组患者合并肝硬化风险较高,C 组合并胆囊结石伴慢性胆囊发生率高。
综上所述,采用自身抗体谱检测法对于老年AILD 诊断具有积极意义。在临床疾病诊断中,应采用多种自身抗体检测方法,实施自身抗体谱检测,予以针对性治疗干预。此外,应加强对老年AILD 患者的并发症防控,实施综合治疗,促进患者预后。
