黄蜀葵花提取物中总黄酮与总多酚含量测定及体外抑菌与抗氧化活性研究
2024-02-26孙增红王丽娃宫海燕田树革
孙增红,张 莎,王丽娃,宫海燕,田树革*
(1.新疆医科大学中医学院,新疆 乌鲁木齐 830017;2.广东医科大学附属东莞第一医院,广东 东莞 523710)
龋齿是人类最常见的感染病,其发生发展与某些慢性系统性疾病有关,如肥胖症、糖尿病、心血管疾病等。龋齿是细菌在牙齿表面形成生物膜(牙菌斑)、通过碳水化合物发酵产酸而引起的,可进一步溶解牙齿硬组织,最终导致牙齿溃烂。变异链球菌(Streptococcusmutans)是一种主要的致龋细菌[1],通过产生糖基转移酶合成不溶性胞外多糖,糖基转移酶黏附在牙齿表面形成细菌生物膜。临床治疗龋齿的传统方法多采用氟化物和抗生素,虽然有一定疗效,但长期使用会导致细菌对抗生素产生耐药性,并产生其它药物毒副反应。研究表明,口腔组织中含有的大量自由基也会增加牙周病和龋齿的患病几率,对伤口的愈合也会造成影响,而天然化合物即外源性抗氧化剂可以抑制细菌代谢活动,保护菌斑菌群免受口腔恶劣环境的影响[2],且具有广泛的药理作用和良好的生物相容性,可以作为抗菌药物的重要来源应用于口腔抗菌领域[3-4]。
黄蜀葵花是锦葵科秋葵属草本植物黄蜀葵[Abelmoschicorolla(L.) Medik.]的花,具有消肿解毒、清热清湿等功效[5],民间应用历史悠久。黄蜀葵花提取物(Abelmoschicorollaextracts,ACE)作为原材料或中间体被广泛应用于化妆品、药物和保健食品等领域[6]。黄酮类和多酚类化合物是重要的植物次生代谢物,具有抗氧化活性,两者的含量成为植物抗氧化能力的重要指标之一,其中,多酚类化合物是通过直接清除活性氧(ROS)、金属螯合、再生体内高效抗氧化剂等来发挥抗氧化活性,羟基是其最主要的清除自由基的化学基团[7];而黄酮类化合物因为含有酚羟基能与自由基发生反应,即失去或得到氢后生成较稳定的半醌式自由基,使得自由基链式反应得以终止,从而发挥抗氧化活性[8]。现代药理学研究发现,黄蜀葵花主要含有黄酮类和多酚类化合物,如金丝桃苷、芦丁、异槲皮苷和槲皮素等,它们均具有抑菌、抗氧化等作用[9-11]。但有关黄蜀葵花对S.mutans的抑制作用的报道较少,因此,作者通过测定ACE中总黄酮和总多酚的含量,探讨其对S.mutans的抑制作用和抗氧化活性,为其进一步应用于口腔抗菌领域提供理论基础。
1 实验
1.1 材料、试剂与仪器
黄蜀葵花(Abelmoschicorolla):选取安徽(亳州市源升堂药业有限公司)、河北(安国市药源商贸有限公司)、陕西(桦甸市山缘参茸有限公司)3个产地,均为干品,经新疆医科大学中医学院中药鉴定教研室徐海燕教授鉴定为锦葵科秋葵属草本植物黄蜀葵[Abelmoschicorolla(L.) Medik.]的花;变异链球菌(S.mutans,ATCC 76100),新疆医科大学中心实验室。
琼脂粉、脑心浸出液(BHI)、2,2-联氮-(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ)、1,1-二苯基-2-三硝基苯肼(DPPH),分析纯,北京索莱宝科技有限公司;金丝桃苷标准品(批号HR18604B1),纯度≥98%,宝鸡辰光生物科技有限公司;芦丁标准品(批号100050-200707),纯度≥98%,中国药品生物制品检定所;没食子酸标准品(批号MUST-11122813,纯度≥98%)、福林酚试剂(分析纯),成都科龙化工试剂厂;维生素C(VC),分析纯,天津精细化工开发中心。
ME204E型电子天平,梅特勒-托利多(上海)仪器有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限公司;KQ3200DE型超声波清洗器,昆山超声仪器有限公司;SW-GJ-2FD型超净工作台,上海博讯实业有限公司;Multiskan GO型全波长酶标仪,美国Thermo Scientific公司;150 mm游标卡尺,上海锡丰标准件有限公司。
1.2 ACE的制备
将干燥黄蜀葵花粉碎,过50目筛;称取1.0 g,按料液比1∶50(g∶mL)加入70%乙醇,90 ℃恒温水浴回流提取0.5 h;过滤,即得ACE样品溶液(若未标注产地,均为安徽ACE)。
同法将滤液蒸干至浸膏状,即得ACE干浸膏,供抑菌实验和抗氧化实验用。
1.3 菌悬液的制备
将保存于-80 ℃冰箱的S.mutans菌株用BHI液体培养基稀释,并在5%CO2、37 ℃厌氧条件下复苏48 h,采用平板划线法将其接种到BHI固体培养基上培养一定时间,计数,用BHI培养液稀释成菌浓为1×108CFU·mL-1的菌悬液。使用时按需调整菌浓。
1.4 总黄酮含量的测定
参照文献[12],以金丝桃苷为对照品,采用紫外分光光度法测定ACE中总黄酮含量。精确称取8.11 mg金丝桃苷标准品置于100 mL容量瓶中,加50%甲醇至刻度,摇匀,得0.081 1 mg·mL-1金丝桃苷标准溶液;再依次精密量取金丝桃苷标准溶液1 mL、2 mL、3 mL、4 mL、5 mL、6 mL至25 mL容量瓶中,加50%甲醇至刻度,摇匀,静置15 min,以不加金丝桃苷标准溶液为空白组,测定360 nm处吸光度。以浓度(x,μg·mL-1)为横坐标、吸光度(y)为纵坐标绘制金丝桃苷标准曲线。
取ACE样品溶液,加入70%乙醇稀释1倍后,精密量取1 mL至25 mL容量瓶中,按上述方法静置15 min后测定360 nm处吸光度,根据回归方程计算总黄酮含量。
1.5 总多酚含量的测定
参照文献[13],以没食子酸为对照品,采用福林酚法测定ACE中总多酚含量。精确称取25.0 mg没食子酸标准品置于250 mL容量瓶中,加水至刻度,得0.1 mg·mL-1没食子酸标准溶液;再依次精密量取没食子酸标准溶液0.25 mL、0.50 mL、0.75 mL、1.00 mL、1.25 mL、1.50 mL至10 mL容量瓶中,加入福林酚试剂1 mL和10%Na2CO3溶液2 mL,加水定容至刻度,摇匀,室温下避光反应1 h,以不加没食子酸标准溶液为空白组,测定765 nm处吸光度。以浓度(x,μg·mL-1)为横坐标、吸光度(y)为纵坐标绘制没食子酸标准曲线。
精密量取ACE样品溶液1 mL至50 mL容量瓶中,按上述方法测定765 nm处吸光度,根据回归方程计算总多酚含量。
1.6 抑菌实验
1.6.1 抑菌圈的测定
采用琼脂打孔法测定不同产地、不同浓度ACE的抑菌圈直径[14]。制备50 mg·mL-1的不同产地ACE水溶液,无菌滤过后,用两倍稀释法将ACE水溶液稀释成25 mg·mL-1和12.5 mg·mL-1的样品溶液。用移液枪吸取100 μL浓度为1×106CFU·mL-1的菌悬液至BHI固体培养基上,用无菌涂菌棒涂匀,晾干,用打孔器在BHI固体培养基上打5个直径为6 mm的孔,孔中分别加入40 μL的样品溶液、复方氯己定溶液(阳性对照)、无菌水(阴性对照),于5%CO2、37 ℃厌氧培养24 h,使用毫米游标卡尺测量抑菌圈直径,重复3次,取平均值。
1.6.2 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
采用微量稀释法测定ACE对S.mutans的MIC和MBC[15]。制备50 mg·mL-1的ACE水溶液,无菌滤过后,用无菌超纯水将ACE水溶液稀释成50~1 mg·mL-1梯度浓度。将100 μL(1×107CFU·mL-1)菌悬液与100 μL梯度浓度安徽ACE水溶液/无菌水(空白对照)加至96孔板中,混匀,于5%CO2、37 ℃厌氧培养24 h,每组设置3个平行;24 h后取出,观察并记录孔内无细菌生长时的ACE最低浓度,即为MIC。然后用无菌移液枪移取适量96孔板中浓度≥MIC的菌悬液,接种至新的BHI固体培养基上,于5%CO2、37 ℃厌氧培养24 h,记录BHI固体培养基上无细菌生长时的ACE最低浓度,即为MBC。
1.6.3 ACE对S.mutans生长的影响
在无菌96孔板中分别加入100 μL(1×107CFU·mL-1)菌悬液与100 μL含有不同浓度(2MIC、MIC、1/2MIC、1/4MIC)ACE的BHI液体培养基,以未加ACE为空白对照,每组设置3个平行,于5%CO2、37 ℃厌氧培养,分别于0 h、2 h、4 h、6 h、9 h、12 h、26 h、30 h、36 h时测定OD600值。考虑到ACE溶液本身颜色对结果的影响,以不同时期混合液的△OD600值作为评价指标,绘制S.mutans的生长曲线[16]。
1.7 抗氧化实验
1.7.1 DPPH自由基清除实验
配制50 mg·mL-1的DPPH溶液;以无水乙醇为溶剂配制10 mg·mL-1的ACE母液,然后稀释成浓度(mg·mL-1)分别为0.35、0.30、0.25、0.20、0.15、0.10、0.05、0.01的样品溶液。参照文献[17],设置实验组、对照组和标准组,于室温避光反应30 min,测定520 nm处吸光度,平行测定3次。按式(1)计算DPPH自由基清除率:
(1)
式中:A2为实验组,150 μL DPPH溶液+50 μL样品溶液的吸光度;A1为对照组,150 μL无水乙醇+50 μL样品溶液的吸光度;A0为标准组,150 μL DPPH溶液+50 μL无水乙醇的吸光度。
同法测定VC、金丝桃苷和芦丁对DPPH自由基的清除率。
1.7.2 ABTS自由基清除实验
避光称取96.05 mg ABTS粉末和16.56 mg K2S2O8,分别置于2个25 mL容量瓶中,加超纯水至刻度,按体积比1∶1混合,制备ABTS自由基母液,于4 ℃冷藏14~16 h,备用;使用前,用无水乙醇将其稀释至吸光度在0.70±0.02范围内。以无水乙醇为溶剂,将10 mg·mL-1的ACE母液稀释成浓度(mg·mL-1)分别为0.40、0.35、0.30、0.25、0.20、0.15、0.10、0.05、0.01的样品溶液。参照文献[18],设置实验组、对照组和标准组,避光反应30 min后,测定734 nm处吸光度,平行测定3次。按式(2)计算ABTS自由基清除率:
(2)
式中:A2为实验组,150 μL ABTS溶液+50 μL样品溶液的吸光度;A1为对照组,150 μL无水乙醇+50 μL样品溶液的吸光度;A0为标准组,150 μL ABTS溶液+50 μL无水乙醇的吸光度。
同法测定VC、金丝桃苷和芦丁对ABTS自由基的清除率。
1.7.3 FRAP法测定总抗氧化能力
参照文献[19],采用铁离子还原/抗氧化能力分析(FRAP)法测定ACE的总抗氧化能力。以无水乙醇为溶剂,分别制备ACE、VC、金丝桃苷和芦丁母液,浓度均为10 mg·mL-1,然后将上述母液稀释成不同浓度样品溶液;将180 μL的FRAP工作液与20 μL不同浓度样品溶液轻轻混合,静置5 min,测定593 nm处吸光度(x),平行测定3次。以FeSO4标准品溶液替代样品溶液与FRAP工作液反应,绘制FeSO4标准曲线,用FeSO4标准品溶液的浓度(y)表示FRAP值,依据FeSO4标准曲线方程y=1.6323x-0.0291(R2=0.9996)分别计算ACE、VC、金丝桃苷和芦丁的FRAP值。
1.8 数据处理
2 结果与讨论
2.1 ACE中总黄酮、总多酚的含量
2.1.1 标准曲线
分别按1.4、1.5方法绘制金丝桃苷和没食子酸的标准曲线,拟合得线性回归方程为:金丝桃苷y=29.382x+0.0437(R2=0.9991);没食子酸y=87.029x-0.004(R2=0.9978)。
可以看出,金丝桃苷浓度在3.24~19.46 μg·mL-1范围、没食子酸浓度在2.50~15.00 μg·mL-1范围与吸光度具有良好的线性关系。
2.1.2 方法学考察
稳定性实验:精密量取金丝桃苷和没食子酸对照品溶液1.0 mL,分别按1.4、1.5方法,在0 min、20 min、40 min、60 min、80 min测定标准溶液的吸光度。结果显示,金丝桃苷和没食子酸标准溶液在80 min内均稳定,其RSD值分别为0.318%和1.040%。
重复性实验:精密称取6份1.0 g的ACE粉末(过50目筛),分别按1.4、1.5方法测定ACE中的总黄酮和总多酚含量,其RSD值分别为0.532%和1.448%,表明2种测定方法的重复性均良好。
精密度实验:精密称取金丝桃苷标准品8.11 mg,置于10 mL容量瓶中,加入适量50%甲醇,超声溶解,再加入50%甲醇至刻度,混匀;精密量取2 mL置于25 mL容量瓶中,加入50%甲醇定容,混匀;然后精密吸取6份上述标准溶液各4.0 mL,分别置于25 mL容量瓶中,用50%甲醇定容,混匀,按1.4方法测定360 nm处吸光度,RSD值为0.868%;同一标准溶液重复测定5次,RSD值为0.426%,表明该方法精密度良好。精密量取6份0.1 mg·mL-1没食子酸标准溶液各0.5 mL,按1.5方法测定765 nm处吸光度,RSD值为0.220%,同一标准溶液重复测定5次,RSD值为0.553%,表明该方法精密度良好。
加标回收率实验:取已知含量的黄蜀葵花粉末,平行精密称取6份,分别加入金丝桃苷和没食子酸标准品适量,按1.4、1.5方法测定总黄酮和总多酚含量,计算得到加标回收率分别为98.53%和101.46%,RSD值分别为1.13%和2.43%(表1)。

表1 加标回收率测定结果(n=6)Tab.1 Determination results of recovery(n=6)
2.1.3 样品测定
按1.2方法制备安徽、陕西和河北等3个产地ACE样品溶液,采用比色法测定其中的总黄酮和总多酚含量,结果见表2。

表2 不同产地ACE中的总黄酮和总多酚含量(n=3)Tab.2 Contents of total flavonoids and total polyphenols in ACE from different origins(n=3)
由表2可知,安徽ACE中的总黄酮含量最高,为(4.68±0.37) mg·g-1,陕西ACE中的总多酚含量最高,为(1.48±0.11) mg·g-1。
2.2 ACE的体外抑菌活性
2.2.1 不同产地ACE对S.mutans的抑菌圈直径
以抑菌圈直径进行敏感性判断:抑菌圈直径大于20 mm为高敏,10~20 mm为中敏,10 mm以下为不敏感。50 mg·mL-1的不同产地ACE、不同浓度安徽ACE的抑菌实验结果如图1所示,不同产地、不同浓度ACE的抑菌圈直径见表3。
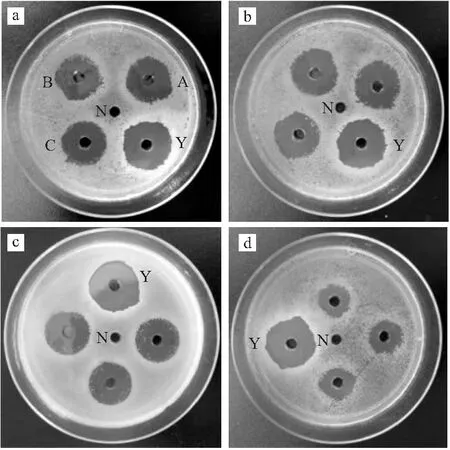
A.安徽ACE B.陕西ACE C.河北ACE N.阴性对照 Y.阳性对照b.50 mg·mL-1安徽ACE c.25 mg·mL-1安徽ACE d.12.5 mg·mL-1安徽ACE图1 50 mg·mL-1不同产地ACE(a)、不同浓度安徽ACE(b~d)的抑菌实验结果Fig.1 Antibacterial experiment results of 50 mg·mL-1 ACE from different origins(a) and Anhui ACE with different concentrations(b-d)
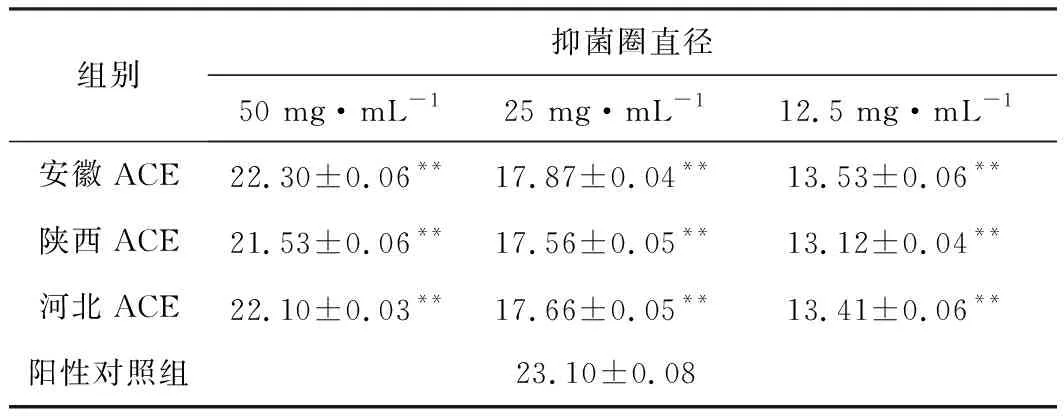
表3 不同产地、不同浓度ACE的抑菌圈直径/mm(n=3)Tab.3 Diameter of inhibition circle of ACE with different concentrations from different origins/mm(n=3)
由表3可知,当3个产地ACE的浓度为50 mg·mL-1时,其抑菌圈直径均大于20 mm,达到高敏,且均接近复方氯己定阳性对照组的抑菌圈直径(P<0.01);当浓度为25 mg·mL-1和12.5 mg·mL-1时,ACE对S.mutans的抑制作用均达到中敏;随着浓度的降低,不同产地ACE的抑菌圈直径均逐渐减小,且呈浓度依赖性;相同浓度下,不同产地ACE的抑菌圈直径大小依次为:安徽ACE>河北ACE>陕西ACE。
2.2.2 ACE对S.mutans的MIC和MBC
实验发现,ACE浓度大于3 mg·mL-1时,96孔板中的溶液是透明的,可见底部,所以ACE对S.mutans的MIC为3 mg·mL-1;ACE浓度为 6 mg·mL-1时,BHI固体培养基上无细菌生长,因此,确定ACE对S.mutans的MBC为6 mg·mL-1。
2.2.3 ACE对S.mutans生长的影响
不同浓度(2MIC、MIC、1/2MIC、1/4MIC)ACE对S.mutans生长的影响如图2所示。
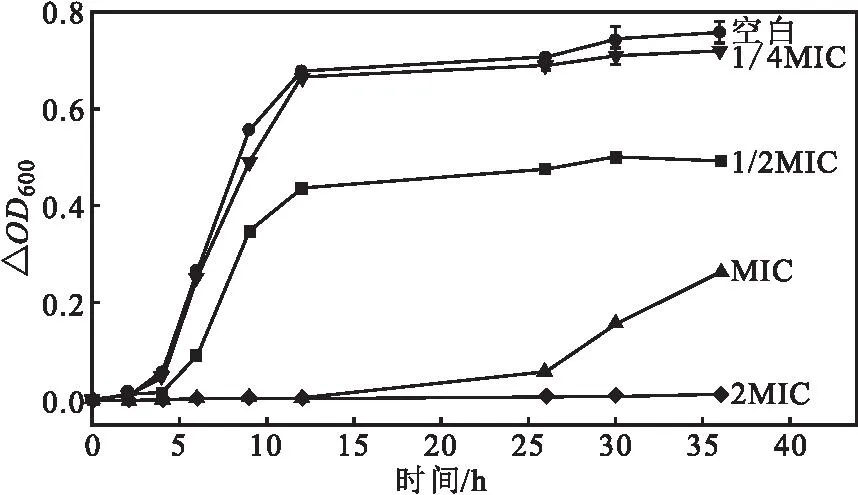
图2 ACE对S.mutans生长的影响Fig.2 Effect of ACE on growth of S.mutans
由图2可知,不同浓度ACE对S.mutans的生长均有一定的抑制作用,36 h内,不同浓度ACE组的生长速率均低于空白对照组,△OD600值与空白对照组相比均有统计学差异(P<0.01)。空白对照组菌体在4 h后开始进入对数生长期,12 h后生长速率逐渐减慢;高浓度(2MIC、MIC)ACE对S.mutans的生长具有明显的抑制作用,菌体进入对数生长期的时间明显延后;中浓度(1/2MIC)ACE对S.mutans生长的抑制作用较高浓度ACE弱;低浓度(1/4MIC)ACE相较于空白对照组表现出轻微的抑制作用,仅在8 h和36 h有显著性差异。推测原因可能是,低浓度ACE中的总黄酮和总多酚含量较低,导致其抗氧化活性较低;随着ACE浓度的增加,其中的总黄酮和总多酚含量相应增加,其对S.mutans的抑制作用随之增强。表明,ACE对S.mutans的抑制作用与其浓度呈正相关。
2.3 ACE的抗氧化活性
2.3.1 ACE对DPPH自由基的清除率(图3)

图3 ACE对DPPH自由基的清除率Fig.3 Scavenging rate of DPPH free radicals by ACE
由图3可知,随着浓度的增加,ACE对DPPH自由基的清除率逐渐升高,在浓度为0.10~0.35 mg·mL-1时,DPPH自由基清除率基本稳定在23.96%~33.15%之间,低于VC对DPPH自由基的清除率(93.61%~95.87%)(P<0.01);在浓度为0.01~0.35 mg·mL-1时,金丝桃苷和芦丁对DPPH自由基的清除率均与浓度呈正相关,即随着浓度的增加,DPPH自由基清除率逐渐升高。
2.3.2 ACE对ABTS自由基的清除率(图4)
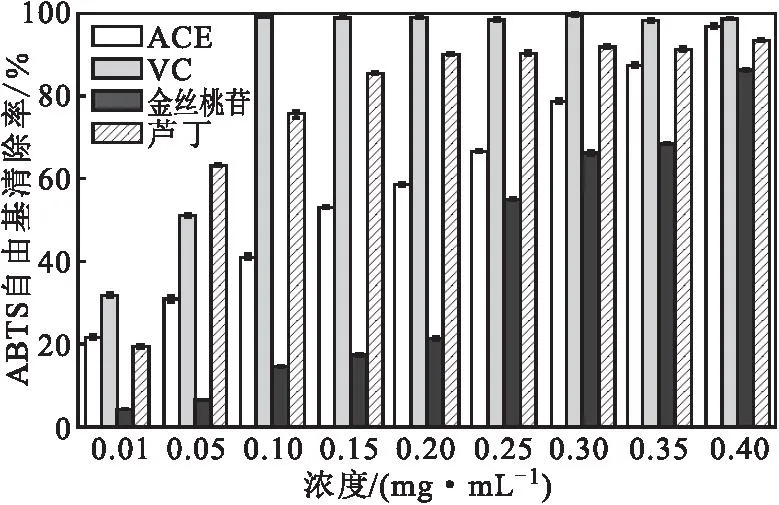
图4 ACE对ABTS自由基的清除率Fig.4 Scavenging rate of ABTS free radicals by ACE
由图4可知,ACE、VC、金丝桃苷、芦丁对ABTS自由基的清除率均随浓度增加逐渐升高,且呈显著的正相关。当VC和芦丁浓度分别增至0.10 mg·mL-1和0.20 mg·mL-1时,ABTS自由基清除率基本稳定,说明VC和芦丁对ABTS自由基的清除作用达到饱和;当金丝桃苷浓度为0.40 mg·mL-1时,其对ABTS自由基的清除率为86.10%;而当ACE浓度为0.40 mg·mL-1时,其对ABTS自由基的清除率则达到了96.50%。表明,ACE对ABTS自由基具有较好的清除能力。
2.3.3 ACE的总抗氧化能力(图5)

图5 ACE的总抗氧化能力Fig.5 Total antioxidant capacity of ACE
由图5可知,ACE、VC、金丝桃苷、芦丁的总抗氧化能力(FRAP值)均随浓度增加逐渐增强,且呈显著的量效关系。当VC和金丝桃苷浓度分别增至0.15 mg·mL-1和0.25 mg·mL-1时,FRAP值基本保持不变,说明VC和金丝桃苷的总抗氧化能力(FRAP值)达到饱和;在浓度为0.01~0.35 mg·mL-1时,总抗氧化能力(FRAP值)大小依次为:VC>金丝桃苷>芦丁>ACE。
3 结论
天然药物具有资源丰富、使用相对安全、药理作用广和实用价值大等优势,已成为研究者获取理想防龋药物的重要资源。以安徽、陕西、河北等地的ACE为研究对象,分别测定了总黄酮和总多酚的含量,其中,安徽ACE中的总黄酮含量最高,为(4.68±0.37)mg·g-1,陕西ACE中的总多酚含量最高,为(1.48±0.11) mg·g-1。ACE能够显著抑制S.mutans的生长,且呈较好的浓度依赖性,最低抑菌浓度(MIC)和最低杀菌浓度(MBC)分别为3 mg·mL-1和6 mg·mL-1;ACE具有良好的清除DPPH、ABTS等自由基的能力和抗氧化活性,且在一定浓度范围内呈量效关系。表明,不同产地ACE中的总黄酮和总多酚含量差别较小,ACE具有一定的体外抑菌和抗氧化活性。该研究为ACE应用于龋齿预防提供了实验依据,也为ACE作为医药、保健食品和化妆品的原料或中间体提供了实验基础。研究方法除抑菌实验外,其余实验均使用了酶标仪和微孔板(具有短时间同时测定样本和大幅降低试剂消耗的优点),具有快速、微量化和准确度高等优点,但有关ACE抑制S.mutans的具体机制和自由基损伤口腔组织的确切机理仍有待更深入的研究。
