多主棒孢菌对乙霉威和腐霉利敏感基线的建立及抗药性监测
2024-02-26温智浩朱广雪孙炳学周荣佳谢学文柴阿丽李磊范腾飞李宝聚石延霞
温智浩,朱广雪,孙炳学,周荣佳,谢学文,柴阿丽,李磊,范腾飞,李宝聚,石延霞
(中国农业科学院蔬菜花卉研究所,蔬菜生物育种全国重点实验室,北京 100081)
多主棒孢菌(Corynesporacassiicola)引起的黄瓜棒孢叶斑病是我国黄瓜生产上的重要叶部病害,造成了严重的经济损失(于淑晶 等,2014;王泉城 等,2023)。多主棒孢菌寄主范围广泛,可侵染53 科380 属530 多种植物(李宝聚 等,2012)。目前,黄瓜棒孢叶斑病在我国大面积发生,已遍及山东、河北、辽宁等地区,初夏和冬春季节发生尤为严重,田间发病率一般为10%~25%,严重时可达60%~70%,甚至100%,对黄瓜产业发展构成严重威胁,已成为设施黄瓜主要真菌性病害之一(李宝聚 等,2008;李长松 等,2009;杨双娟 等,2012)。
化学杀菌剂是目前防治黄瓜棒孢叶斑病的主要方法,我国用于防治该病害的化学杀菌剂主要有琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitors,SDHIs),如啶酰菌胺、噻呋酰胺、吡噻菌胺;苯醌外部抑制剂(quinone outside inhibitors,QoIs),如吡唑醚菌酯、苯醚菌酯、啶氧菌酯;以及14α-脱甲基化抑制剂(14α-demethylation inhibitors,DMIs),如苯醚甲环唑、戊唑醇、丙环唑等(李桂香 等,2022)。
乙霉威和腐霉利均为传统杀菌剂,在设施黄瓜上的应用时间长、范围广。乙霉威是日本住友公司于1984 年开发的一种苯氨基甲酸酯类杀菌剂,作用机理为药剂与真菌细胞内的β-微管蛋白相结合,进而影响菌体细胞的正常有丝分裂,使菌体死亡,其与多菌灵杀菌剂具有负交互抗性(谢学文等,2020)。腐霉利是德国巴斯夫公司开发的一种二甲酰亚胺类触杀型杀菌剂,能显著抑制孢子萌发及菌丝生长,广泛应用于防治多种蔬菜病害(郑远,2020)。
乙霉威和腐霉利虽然在我国并未登记用于防治黄瓜棒孢叶斑病,但已经成为生产中防治黄瓜灰霉病的常用药剂,且黄瓜灰霉病与黄瓜棒孢叶斑病在田间发生存在时间交集,由于这2 种杀菌剂长期在黄瓜上的应用,在防治黄瓜灰霉病的过程中也间接导致了乙霉威和腐霉利对多主棒孢菌的药剂选择压,出现了大量抗性菌株,产生抗性风险(詹家绥等,2014;Sabine & Yigal,2016)。因此,建立多主棒孢菌对乙霉威和腐霉利的敏感基线,监测其田间抗性频率和抗性状况,可为黄瓜生产中的科学合理应用杀菌剂提供参考。
1 材料与方法
1.1 试验材料
1.1.1 多主棒孢菌 2017—2021 年,中国农业科学院蔬菜花卉研究所蔬菜病害防控创新团队从山东省济南市、寿光市、临沂市、聊城市和辽宁省大连市、沈阳市、鞍山市、营口市、朝阳市采集黄瓜棒孢叶斑病病样,经分离纯化共获得828 株多主棒孢菌(表1)。所有菌株验证具有致病力后,转接在马铃薯葡萄糖琼脂(PDA)斜面上,25%甘油冻存管保存,备用。
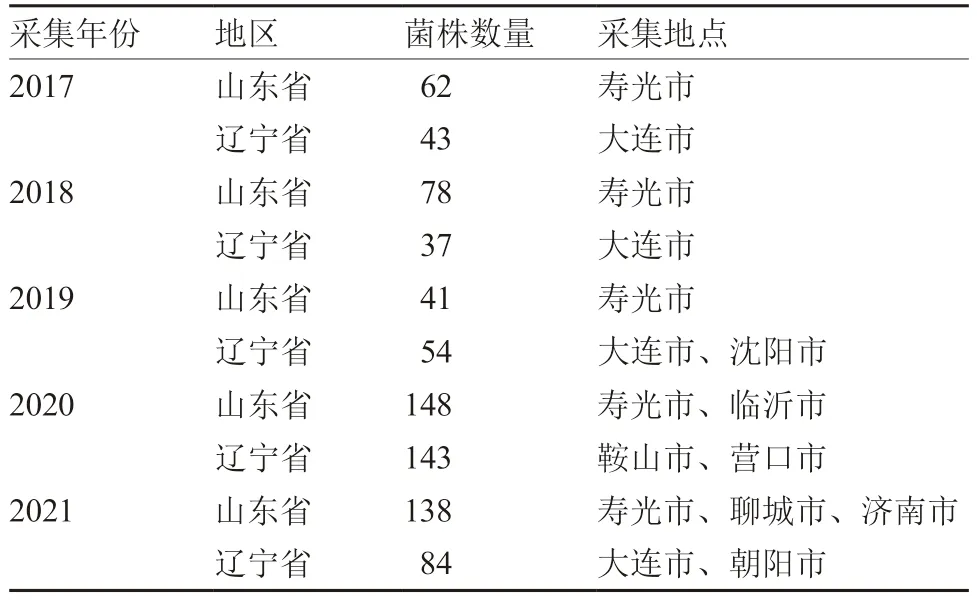
表1 供试多主棒孢菌采集时间及地点
1.1.2 药剂及试剂 95%乙霉威(Diethofencarb)原药,购自山东亿嘉农化有限公司;99%腐霉利(Procymidone)原药,购自山东力发生物科技有限公司。采用丙酮溶解,配成10 000 μg · mL-1的母液。
1.1.3 培养基 菌株的分离、保存和对杀菌剂的敏感性测定均使用马铃薯葡萄糖琼脂(PDA)培养基。
1.2 试验方法
1.2.1 菌株活化 供试多主棒孢菌经单孢纯化后编号,保存于PDA 斜面上,存放于4 ℃冰箱,以备后续使用。
1.2.2 多主棒孢菌对乙霉威和腐霉利的敏感性测定 采用菌丝生长速率法。将供试菌株接种至PDA平板上,25 ℃培养5 d,使用打孔器沿菌落边缘打取直径5 mm 的菌饼,菌丝面向下分别接种至乙霉威浓度为0、0.2、0.4、0.8、2.0 μg · mL-1的PDA含药平板和腐霉利浓度为0、0.1、1.0、1.5、10.0、100.0 μg · mL-1的PDA 含药平板中央,每处理3 次重复,以接种至不含药PDA 平板为空白对照,以接种至等量丙酮溶液为溶剂对照,置于25 ℃条件下培养4 d。待空白对照平板菌落直径接近培养皿边缘时,采用十字交叉法测量菌落生长直径,计算菌丝生长抑制率(%)(杨名佳 等,2021)。
菌丝生长抑制率 = (对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)× 100%
利用SPSS 软件对药剂浓度的对数(x)和菌丝生长抑制率的几率值(y)进行线性回归分析,建立毒力回归方程,计算乙霉威和腐霉利对各菌株的抑制中浓度(EC50)。根据菌株对乙霉威和腐霉利的敏感性频率分布,观察其是否呈正态分布,以此来建立敏感基线。
1.2.3 乙霉威和腐霉利对多主棒孢菌抗性区分剂量的确定及田间抗药性监测 对不同浓度乙霉威和腐霉利处理的菌丝生长数据进行分析得出:当乙霉威浓度为0.4 μg · mL-1时,敏感菌株的菌丝生长抑制率大于50%,抗性菌株菌丝生长不受抑制;当腐霉利浓度为1.5 μg · mL-1时,敏感菌株的菌丝生长抑制率大于40%,抗性菌株菌丝生长不受抑制。因此,选择0.4 μg · mL-1作为多主棒孢菌对乙霉威抗性水平的区分剂量,1.5 μg · mL-1作为多主棒孢菌对腐霉利抗性水平的区分剂量(Hideo et al.,2011;陈杰,2015)。采用区分剂量法,测定2017—2021 年采集的828 株多主棒孢菌对乙霉威和腐霉利的抗药性。将多主棒孢菌5 mm 菌饼接种于含有乙霉威和腐霉利区分剂量的PDA 平板中央,每处理3 次重复,以接种至不含药剂的PDA 平板为对照,置于25 ℃培养4 d 后进行调查,分别计算敏感菌株和抗性菌株的发生频率(裴龙飞 等,2016)。
抗性频率 = 抗性菌株数/总菌株数× 100%
2 结果与分析
2.1 多主棒孢菌对乙霉威和腐霉利的敏感基线
2.1.1 多主棒孢菌对乙霉威的敏感基线 通过测定828 株多主棒孢菌对乙霉威的EC50值,其中最小值为0.09 μg · mL-1。选取104 株多主棒孢菌进行敏感基线建立,该104 株菌的EC50值范围在0.09~0.44 μg · mL-1之间(图1),多主棒孢菌对乙霉威的敏感性频率整体呈正态曲线分布,因此可将该104 株多主棒孢菌群体的平均EC50值(0.22 ± 0.06)μg ·mL-1作为多主棒孢菌对乙霉威的敏感基线(图2)。2.1.2 多主棒孢菌对腐霉利的敏感基线 通过测定828 株多主棒孢菌对腐霉利的EC50值,其中最小为0.15 μg · mL-1。选取254 株对腐霉利的敏感菌株,其EC50值范围在0.15~4.73 μg · mL-1(图3),多主棒孢菌对腐霉利的敏感性频率总体呈正态曲线分布,因此可将该群体的平均EC50值(2.75 ±0.91)μg · mL-1作为多主棒孢菌对腐霉利的敏感基线(图4)。
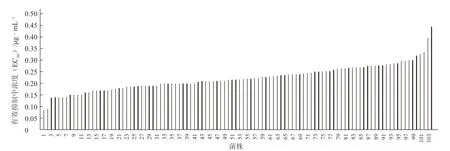
图1 104 株多主棒孢菌对乙霉威的敏感性分布

图2 多主棒孢菌对乙霉威的敏感基线
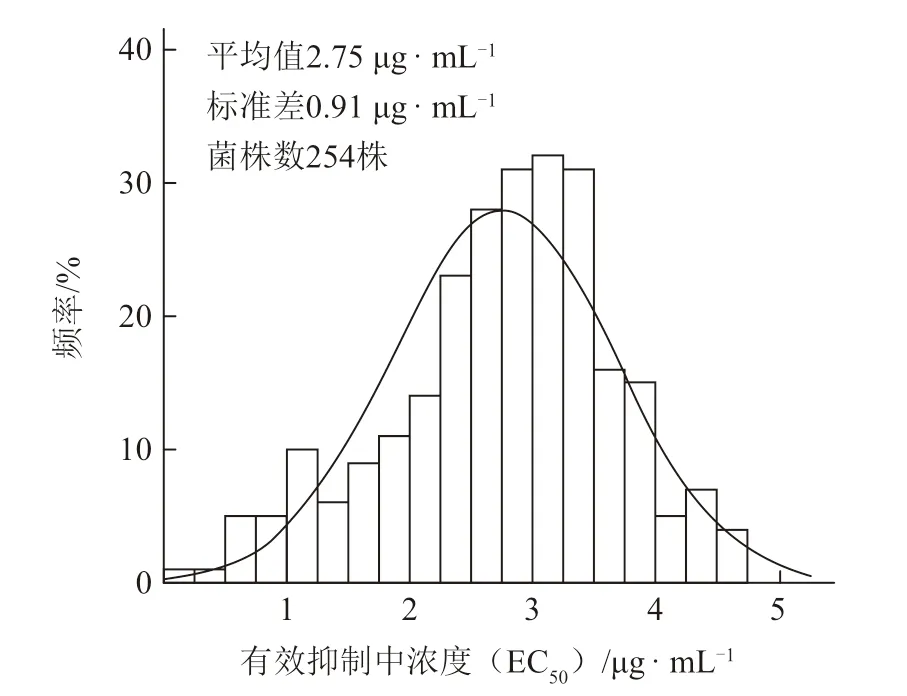
图4 多主棒孢菌对腐霉利的敏感基线
2.2 多主棒孢菌对乙霉威和腐霉利的抗药性监测
采用区分剂量法对多主棒孢菌所有供试菌株进行抗性水平测定,评价抗性水平。结果表明,多主棒孢菌对乙霉威和腐霉利的抗性发展迅速。2017年,山东省和辽宁省多主棒孢菌对乙霉威的抗性频率分别为58.06%和67.44%,2021 年则分别达到了91.30%和82.14%(表2);同时山东省和辽宁省多主棒孢菌对腐霉利的抗性频率2017 年为43.55%和53.49%,2021 年达到了78.99%和83.33%(表3)。表明在山东省和辽宁省,多主棒孢菌对乙霉威和腐霉利已产生抗性,抗性频率呈逐年上升趋势。

表2 山东省和辽宁省多主棒孢菌对乙霉威的抗性频率

表3 山东省和辽宁省多主棒孢菌对腐霉利的抗性频率
3 结论与讨论
黄瓜棒孢叶斑病是一种世界性的真菌病害,在美国、日本、韩国、新西兰等地均有报道(Dixon et al.,2009;朱广雪 等;2023)。设施蔬菜生产过程中长期的高温高湿环境,为病原菌的积累和病害的暴发提供了良好环境条件(Kwon et al.,2003)。目前防治该病害主要以化学杀菌剂防治为主,随着化学杀菌剂长期、大量、高频率地使用,田间病原菌出现了不同程度的抗药性,使得化学药剂田间防效大幅度下降(Miyamoto et al.,2009,2010)。蔬菜病害防控创新团队前期工作发现,黄瓜棒孢叶斑病也对啶酰菌胺、多菌灵等多种杀菌剂产生了不同程度的抗药性(朱发娣,2018;Zhu et al.,2019)。由于田间应用乙霉威和腐霉利防治黄瓜灰霉病时,这两种药剂对同期发生的黄瓜棒孢叶斑病可能造成选择压,因此监测多主棒孢菌对这两种杀菌剂的抗性风险,对于预防抗药性产生及田间合理用药尤为重要(裴艳刚 等,2021)。
建立病原菌对杀菌剂的敏感基线及抗性评估有助于明晰化学杀菌剂防效的高低,也为合理使用杀菌剂提供理论支撑(毛玉帅 等,2022)。目前,已经通过腐霉利对苹果轮纹病菌和油菜菌核病菌的抑菌率测定结果,建立了苹果轮纹病菌和油菜菌核病菌对腐霉利的敏感基线,分别为(1.289 1 ± 0.060 0)μg · mL-1和(0.198 1 ± 0.022 0)μg · mL-1(曹敏娟,2008;顾乃图 等,2016)。本试验采用菌丝生长速率法测定了多主棒孢菌对乙霉威和腐霉利的敏感性,两者敏感菌株的频率分布图均呈正态曲线分布,可将(0.22 ± 0.06)μg · mL-1和(2.75 ± 0.91)μg · mL-1作为多主棒孢菌对乙霉威和腐霉利的敏感基线。分别以0.4 μg · mL-1和1.5 μg · mL-1作为多主棒孢菌对乙霉威和腐霉利抗性水平的区分剂量,监测了2017—2021 年山东省和辽宁省黄瓜生产大棚采集的多主棒孢菌对这两种药剂的抗药性。结果表明:山东省和辽宁省多主棒孢菌对乙霉威和腐霉利的抗性发展迅速,其抗性频率常年处于高水平,对乙霉威和腐霉利的抗性菌株已成优势群体。本研究在国内率先建立了多主棒孢菌对乙霉威和腐霉利的敏感基线,为黄瓜棒孢叶斑病的抗药性风险评估及合理使用药剂奠定了基础。
已有研究表明,我国多个省份其他病原菌对乙霉威和腐霉利产生了较强的抗药性。例如,在山西省黄瓜种植产区,由于乙霉威和腐霉利的过度施用,导致黄瓜灰霉病菌对乙霉威和腐霉利产生了抗药性,且抗性频率分别达到84.00%和81.36%(赵晓军 等,2010,2011);在云南省弥勒葡萄产区,葡萄灰霉病菌对腐霉利、乙霉威和多菌灵均产生了严重的抗药性,不仅抗性频率高,而且出现了双抗和多抗菌株(普继雄 等,2021)。本试验对2017—2021 年山东和辽宁地区采集的多主棒孢菌进行抗性评估,发现这两个地区多主棒孢菌已对乙霉威和腐霉利产生抗性,抗性频率逐年增加。由此可见,随着化学杀菌剂的长期施用,病原菌对多种杀菌剂产生了普遍的抗药性。生产中应尽量少用或不施用单一的化学杀菌剂,可与其他作用机理的杀菌剂交替使用,并与农业防治、生物防治和物理防治相结合,多维控制病原菌的蔓延与发展,以延缓黄瓜棒孢叶斑病的抗药性发展,提高田间防效。
