番茄Ph-2 基因晚疫病株龄抗性的比较转录组分析
2024-02-26潘春阳李鑫苏文悦胡俊玲鲁晓晓潘峰张晨张辉黄泽军国艳梅王孝宣杜永臣刘磊李君明
潘春阳,李鑫,苏文悦,胡俊玲,鲁晓晓,潘峰,张晨,张辉,黄泽军,国艳梅,王孝宣,杜永臣,刘磊,李君明
(中国农业科学院蔬菜花卉研究所,蔬菜生物育种全国重点实验室,北京 100081)
卵菌纲致病疫霉(Phytophthorainfestans)引起的晚疫病是危害番茄生产的毁灭性病害,其生理小种进化快、致病力强、化学防治难有成效,培育抗性品种是实现晚疫病防治的有效措施(Foolad et al.,2008;Li et al.,2011)。
目前,抗番茄晚疫病最有效的基因是Ph-2与Ph-3,聚合二者可抗多个生理小种,在抗性品种培育中应用最为广泛(Zhi et al.,2021)。但研究表明Ph-2和Ph-3基因均存在株龄相关抗性(age-related resistance,ARR),转入Ph-2和Ph-3基因的抗病材料三叶期幼苗接种致病疫霉后表现为一定程度的感病,其抗性随着株龄增加而逐渐增强,并在六叶期后充分表达(Chungwongse et al.,2002;李君明等,2007;李涛 等,2015)。
株龄相关抗性通常指植物的某种抗性随苗龄增长而出现增强或降低的现象,是植物对病毒、细菌、真菌、卵菌、昆虫等抗性适应性的一种普遍现象(Hu & Yang,2019),在合适的株龄,植物激活更强的免疫反应,既可以增加对病原的抗性,又能减少其他时期不必要的免疫激活而造成的负面影响,但这同时意味着在株龄更小时期,抗性品种幼苗仍然面临着病原侵染的威胁。前人研究发现许多开花植物的植株抗病性与其株龄正相关,并通过对拟南芥、苹果、草莓和黄瓜等转录组分析,发现这种抗性可能是由物理屏障、化学防御和先天免疫等协同组成,并涉及多个信号转导通路的调控(Gusberti et al.,2013;Ando et al.,2015;Mansfeld et al.,2017;Zou et al.,2018;Hu & Yang,2019)。尽管目前对株龄相关抗性机制已经有了初步认识,但尚未有在转录组水平上对番茄-晚疫病互作中株龄相关抗性分析的报道。
本研究通过对Ph-2晚疫病抗性材料三叶期与六叶期幼苗接种后不同时期的转录组分析,对可能调控其株龄抗性的基因进行了初步筛选,并对水杨酸与乙烯信号转导通路响应晚疫病抗性的差异表达基因进行了分析,以期为揭示番茄晚疫病株龄抗性相关机制提供理论依据,为培育晚疫病持久抗性番茄品种奠定基础。
1 材料与方法
1.1 试验材料
试验所用Ph-2晚疫病抗性材料是以Heinz1706为背景的近等基因系,由中国农业科学院蔬菜花卉研究所番茄遗传育种课题组构建,2020 年5 月分批播种,第1 批播种后10 d 进行第2 批播种,幼苗定植于本所北圃场温室,待第1 批播种幼苗第6片真叶充分展开,第2 批播种幼苗第3 片真叶充分展开、第4 片真叶刚刚长出时,选取长势相近、一致性好的幼苗进行接种鉴定。致病疫霉T0,1生理小种由本所植保室提供。
1.2 接种鉴定
参照李涛等(2015)的接种鉴定方法,对Ph-2晚疫病抗性材料三叶期与六叶期幼苗各20 株进行接种鉴定。
1.3 样品RNA 的提取、建库测序与分析
接种后0、8、24、48 h 分别取三叶期幼苗第3 片真叶,六叶期幼苗第6 片真叶,使用华越洋Quick Total RNA Isolation Kit 提取试剂盒提取RNA,每个样品设置2 次生物学重复,建库测序与分析由北京百迈客生物科技有限公司完成。
1.4 qRT-PCR 验证
对转录组测序结果与筛选到的差异表达基因进行qRT-PCR 验证,使用诺唯赞HiScriptⅡ 1 st Strand cDNA Synthesis Kit 进行测序RNA 样品的反转录。采用 SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(TaKaRa,USA)进行qRT-PCR 反应,以番茄Actin基因作为内参基因,每个反应设3 次重复,使用2-ΔΔCT方法分析结果。
1.5 数据分析
利用Microsoft Excel 2016 软件整理试验数据,使用SPSS 24 软件进行差异显著性分析,使用GraphPad Prism 8 对统计数据进行作图。
2 结果与分析
2.1 番茄Ph-2 基因不同株龄的晚疫病抗性鉴定
番茄晚疫病病原菌接种后表型鉴定的时间一般为7 d 左右,本试验所用的病原菌生理小种致病力较弱,因此接种后8 d 进行表型鉴定,结果如表1 所示,Ph-2抗性材料三叶期幼苗病级指数5.30 ±0.66,六叶期幼苗病级指数2.30 ± 0.94,存在极显著性差异(P<0.01),表明Ph-2基因存在株龄相关抗性。
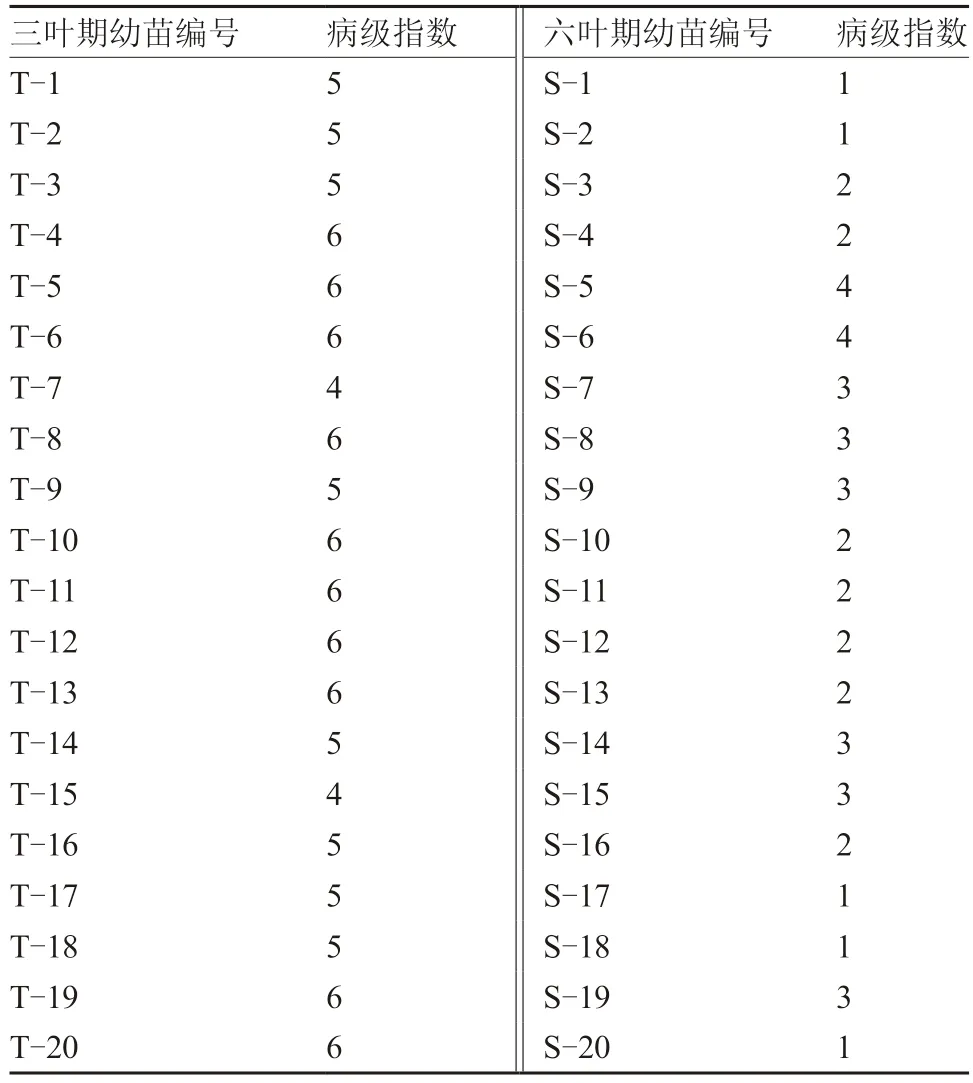
表1 番茄Ph-2 晚疫病抗性材料三叶期与六叶期幼苗接种后表型鉴定结果
2.2 番茄Ph-2 基因不同株龄晚疫病抗性的转录组测序
对三叶期幼苗与六叶期幼苗接种后0、8、24、48 h 4 个时间点共计16 个样品进行转录组测序,共获得98.12 Gb Clean Data。各样品的Clean Data Q30 碱基百分比均不小于92.38%。分别将各样品的Clean reads 与番茄Heinz1706 参考基因组进行序列比对,各样品的reads 比对效率在87.79%~97.07%之间,各重复间相关性均高于0.8,以上结果表明转录组测序数据可用于下一步分析。
2.3 番茄Ph-2 基因晚疫病株龄相关抗性基因的筛选
由图1 可知,对0 hpi(hpi 为接种后时间,单位:小时)与48 hpi 三叶期幼苗与六叶期幼苗差异表达基因进行KEGG 富集分析,均能富集到“植物-病原互作”中的相关基因,表明在病原侵染前与侵染完成后,三叶期幼苗与六叶期幼苗抗性存在一定差异。
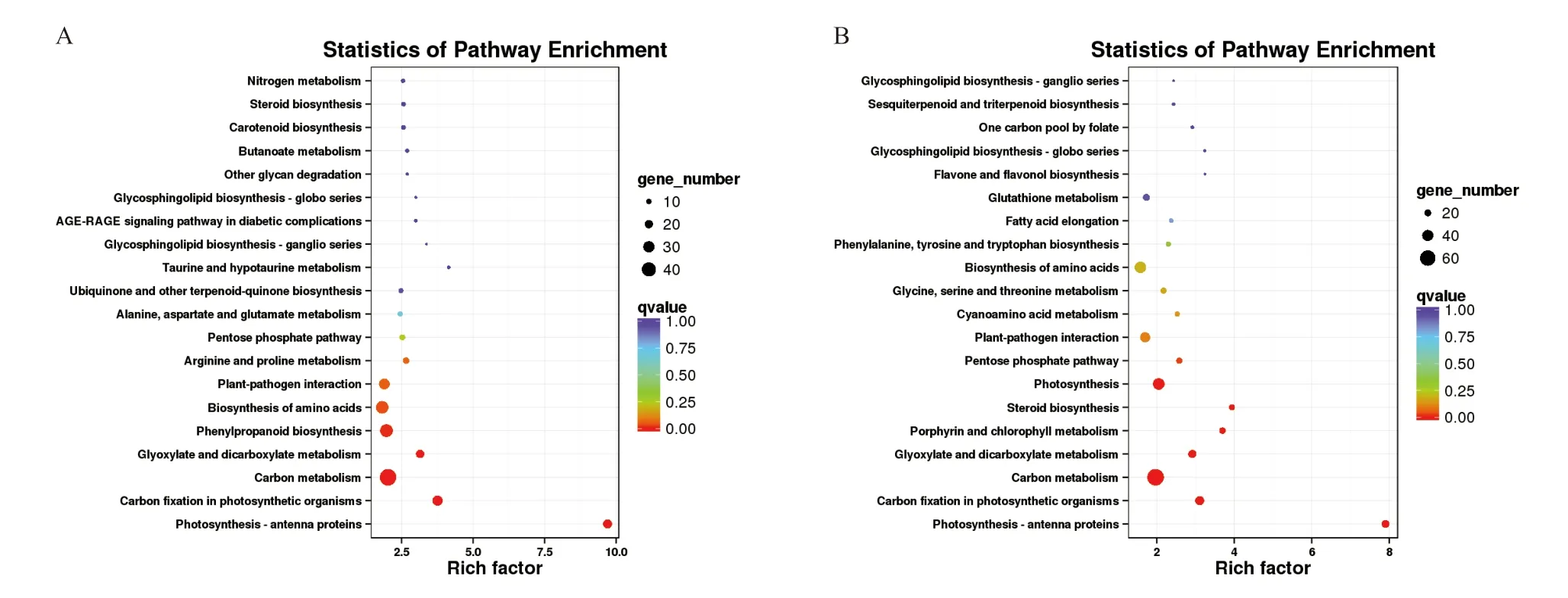
图1 三叶期幼苗与六叶期幼苗在接种后0 h(A)和48 h(B)差异表达基因KEGG 富集分析
为了探究Ph-2晚疫病抗性材料出现株龄相关抗性是否为Ph-2基因在不同株龄幼苗中差异表达所致,对不同株龄材料在4 个取样时间点的差异表达基因进行了筛选(Fold change ≥2,FDR ≤0.01,表达量单位:FPKM)。分析发现(表2),Ph-2基因精细定位区间中所有基因在两组材料中均不存在表达差异,因此推断Ph-2株龄相关抗性并非由Ph-2基因在不同材料中差异表达引起。进一步分析发现,在差异表达的基因中也不包括NBS-LRR、STK等其他典型抗病基因,降低差异表达基因筛选标准(Fold change ≥1.5,FDR ≤0.05)后仍得到相同的结果。因此,推断本试验中Ph-2抗性材料出现株龄相关抗性并不是由抗病基因差异表达直接导致。

表2 不同样品组间差异表达基因情况
进一步对三叶期幼苗和六叶期幼苗在0~48 hpi 与8~48 hpi 间均存在差异表达的基因进行分析(表3),在0~48 hpi 间筛选到1 个在六叶期幼苗中表达量始终显著高于三叶期幼苗基因Solyc01g006290,该基因编码过氧化物酶活性蛋白,可进行细胞氧化解毒,并参与调控木质素合成。木质素是细胞壁修饰的重要组成部分,在植物抗病性中起着重要作用(Passardi et al.,2010)。同时过氧化物酶活性基因在植物细胞壁受到破坏时还可以作为信号物质激活下游免疫反应,如疫霉侵染辣椒后,辣椒过氧化物酶活性基因的表达与植株抗性正相关(Alcázar et al.,2010)。在8~48 hpi 间的差异表达基因中同样筛到六叶期幼苗表达量显著高于三叶期幼苗的过氧化物酶活性基因Solyc02g087110。此外,还筛选到3 个未知蛋白,其表达量在六叶期幼苗与三叶期幼苗中存在显著性差异。如图2 所示,试验进一步通过qRT-PCR 验证了转录组的分析结果。

图2 株龄抗性相关基因在不同时期幼苗中的表达量
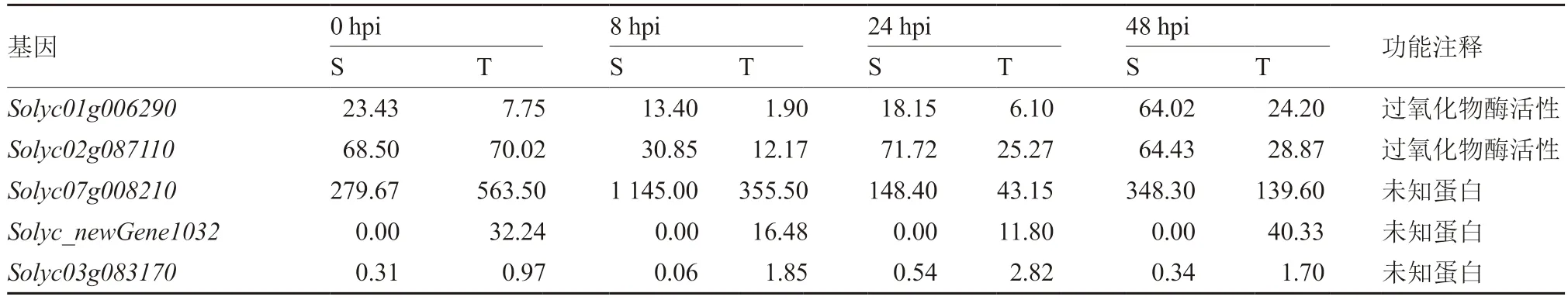
表3 株龄抗性相关基因的筛选 单位:FPKM
由于过氧化物酶活性基因在植物细胞壁建成与修复中起关键作用,因此进一步筛选了六叶期幼苗较之三叶期幼苗差异表达基因中与细胞壁相关的基因。结果在0、8、24 hpi 和48 hpi 中分别筛选到178 个(125 个表达量显著上调,53 个显著下调)、120 个(45 个显著上调,75 个显著下调)、9 个(5个显著上调,4 个显著下调)、225 个(171 个显著上调,54 个显著下调)与细胞壁相关的差异表达基因,其中六叶期幼苗表达量显著高于三叶期幼苗的基因大多与细胞壁的生物发生和修饰有关,少数表达量低于三叶期幼苗的基因与细胞壁分解等相关。
2.4 番茄Ph-2 基因不同株龄水杨酸与乙烯信号转导通路中免疫响应基因的分析
水杨酸与乙烯信号转导通路中相关基因介导了番茄对晚疫病的抗性反应(Eschen-Lippold et al.,2010)。通过对接种后水杨酸与乙烯信号转导通路差异表达基因分析(Fold change ≥2,FDR ≤0.01,表达量单位:FPKM)表明,三叶期与六叶期幼苗接种后水杨酸信号转导通路中17 个基因差异显著,其中多数基因表达趋势在2 种材料中较为一致,而Solyc01g106620、Solyc09g006005、Solyc09g007010、Solyc11g068370和SLnewgene3379共5 个基因在三叶期幼苗中表达量明显高于六叶期幼苗(表4);乙烯信号转导通路中9 个基因差异显著,其中6 个基因在2 种材料中的表达模式与表达量较为相近,Solyc09g089930、Solyc07g008250、Solyc01g009170共3 个基因在两种材料间表达趋势不一致且表达量差异较大(表5),这可能与乙烯信号转导途径中复杂的反馈调节机制相关。
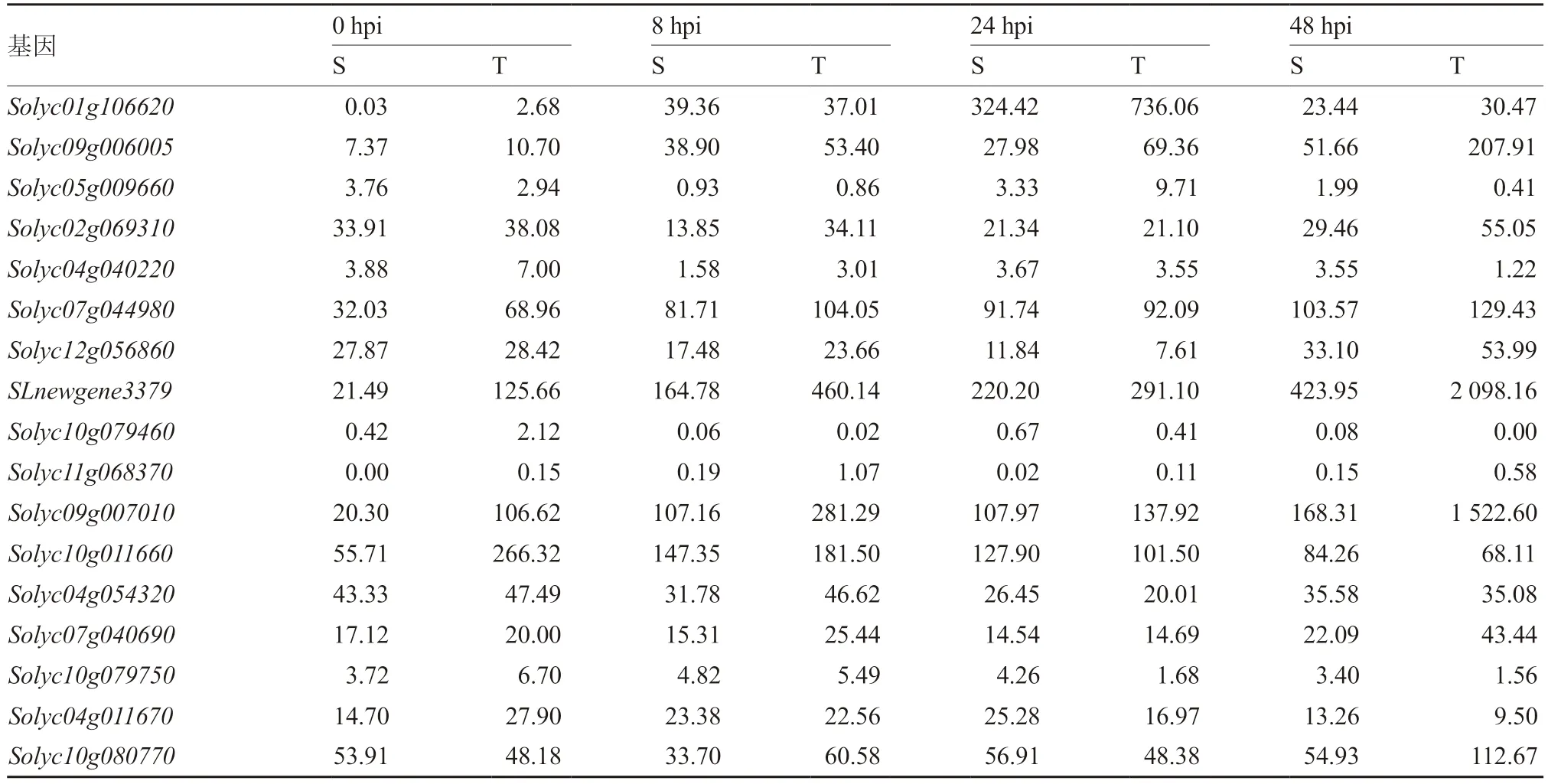
表4 水杨酸信号转导途径中差异表达基因单位:FPKM

表5 乙烯信号转导途径中差异表达基因 单位:FPKM
3 结论与讨论
株龄相关抗性是植物中普遍存在的一种防御机制,它在一定程度上协调了生长发育与抗性反应之间的平衡,揭示株龄相关抗性机制是实现作物持久抗性的关键,也是作物育种的重要目标。本试验发现,2 个过氧化物酶活性基因Solyc01g006290和Solyc02g087110在不同株龄番茄幼苗叶片中的表达差异可能是番茄抗晚疫病Ph-2基因株龄相关抗性产生的原因之一。
过氧化物酶活性基因在植物抗病中发挥重要作用。辣椒中CaPO2的异源表达可增强拟南芥的抗病性,引起HR 反应、H2O2积累和病原体相关(PR)基因的表达(Choi,2007)。水稻中OsPrx114的异源表达也能够诱导PR 基因的表达并增强对病原体的抗性(Wally & Pnuja,2010)。研究表明,在病原菌侵染初期,过氧化物酶基因的表达与抗性正相关,抗性物种在这一时期会迅速反应并产生大量的过氧化物酶,感病物种则出现反应滞后或不产生过氧化物酶的情况(蒋选利 等,2001),这与本试验中过氧化物酶基因Solyc02g087110的表达类似,其0 hpi的表达量在六叶期幼苗与三叶期幼苗中不存在显著性差异,在8 hpi 时受到病原侵染表达量均出现一定的下调,但六叶期幼苗中该基因下调幅度较小且表达水平显著高于三叶期幼苗,而后其表达量迅速恢复并持续高水平表达,但在三叶期幼苗中,该基因的下调幅度明显更大,并在8~48 hpi 间持续低水平表达。另外,细胞壁相关过氧化物酶在植株受到外伤、病原等外部作用后能够催化木质素或木栓素等物理屏障的形成,实现细胞壁硬化,从而限制病原物的入侵(Passardi et al.,2010)。本试验中筛选到的另一个过氧化物酶基因Solyc01g006290位于木质素合成通路,正调控木质素合成。其在三叶期幼苗与六叶期幼苗中的表达差异可能影响受损细胞壁的修复效率与硬化程度,造成细胞壁强度差异,进而导致株龄相关抗性的产生。通过对六叶期幼苗与三叶期幼苗差异表达基因中细胞壁相关基因的分析结果也与此推断基本一致。
此外,前人研究表明水杨酸与乙烯介导的信号转导通路在番茄晚疫病抗性中起重要作用(李涛等,2015),本试验对接种致病疫霉后水杨酸与乙烯信号转导通路相关基因的表达量进行了分析,发现六叶期幼苗与三叶期幼苗中相关基因的表达趋势基本一致,但部分基因的表达模式与表达量存在较大差异,这些差异可能在一定程度上影响到抗性激活的时间与强度。
本试验结果表明,植物株龄相关抗性可能不是由典型抗病基因在不同株龄植株中差异表达直接引起的,其可能是由过氧化物酶活性基因、细胞壁修复与强化、激素信号转导等先天免疫组分在不同株龄材料中差异表达导致。但株龄相关抗性是由内在的复杂网络调控,其表达模式涉及环境条件、植物生理状态和病原体周期之间复杂的相互作用,并由物理屏障、化学免疫和先天防御协同组成,株龄抗性的互作不仅限于基因与基因间,在基因与miRNA 间也存在复杂的相互作用(Shubin &Dahn,2004;Zhang et al.,2011;Ando et al.,2015;Mansfeld et al.,2017;Luan et al.,2018;Zou et al.,2018)。因此,揭示株龄相关抗性机制需要借助多组学技术综合分析,进而加快株龄抗性关键基因的鉴定,解析其时空表达特性,以期借助基因编辑等手段改变相关基因特定时期的表达模式或提前激活株龄相关抗性的“基因开关”,从而创制出具有持久抗性的新种质。
