乙二胺-N-丙基改性硅胶的可控键合制备及其在银杏酸脱除中的应用研究
2024-02-26潘翔宇靳钊关彤陈贝怡
潘翔宇 靳钊 关彤 陈贝怡


摘要:優化了乙二胺-N-丙基键合硅胶(PSA)键合量可控的制备工艺,考察了PSA制备的批次重复性,并进行PSA制备的中试放大实验。采用红外光谱、元素分析及电位滴定法对所制备的PSA进行性能评价,结果表明:在3 460 cm-1处出现了N—H伸缩振动峰,在2 960 cm-1和2 860 cm-1处出现了—CH的不对称和对称伸缩振动峰,708 cm-1处出现了—NH2的变形振动吸收峰,表明乙二胺-N-丙基成功接枝到硅胶表面;随着制备体系中硅烷化试剂比例的增加,碳、氮和氢元素的含量以及电位滴定法得到的离子交换容量均呈现上升趋势,说明乙二胺-N-丙基官能团的键合量逐渐增加。将制备的PSA填充成分离纯化小柱,考察了不同键合量PSA对银杏叶提取物中银杏酸的脱除效率,结果表明:PSA对银杏酸有强吸附能力,可应用于银杏叶提取物中银杏酸的脱除,2#、3#、4#和5#PSA分离纯化柱的最大上样体积分别为21、22、23、24 mL,且脱除效率随乙二胺-N-丙基键合量的增加而升高。
关键词:乙二胺-N-丙基改性硅胶;键合量;银杏酸脱除
中图分类号:O658 文献标志码:A 文章编号:1002-4026(2024)01-0051-08
Controllable bonding preparation of ethylenediamine-N-propyl modified silica gel and its application in ginkgolic acid removal
Abstract∶In this paper, the preparation process of N-propylethylenediamine bonded silica gel (PSA) with controllable bonding amount was optimized; the batch repeatability of PSA preparation was examined; and the pilot scale-up experiment of PSA preparation was conducted. The properties of the PSA were investigated by infrared spectroscopy, elemental analysis, and potentiometric titration. The results showed that N—H stretching vibration peaks appeared at 3 460 cm-1, asymmetric and symmetric stretching vibration peaks of —CH appeared at 2 960 cm-1 and 2 860 cm-1, and deformation vibration absorption peaks of —NH2 appeared at 708 cm-1, indicating that N-propylethylenediamine was successfully grafted onto the surface of silica gel.Furthermore, with the increasing proportion of silane reagent in the preparation system, the content of carbon, nitrogen, and hydrogen elements and the ion exchange capacity obtained by potentiometric titration showed an upward trend, indicating that the bonding amount of ethylenediamine-N-propyl functional group gradually increased. Moreover, the prepared PSA packing component was separated from the purification column, and the removal efficiency of ginkgolic acid from the extract of ginkgo biloba leaves using PSA with different bonding amounts was investigated. The results showed that PSA had a strong adsorption capacity for ginkgolic acid and could be used to remove ginkgolic acid from the extract of ginkgo biloba leaves, the maximum sample loading volumes for PSA separation and purification columns 2#, 3#, 4#, and 5# are 21, 22, 23, 24 mL, respectively. In addition, the removal efficiency was found to increase with the increasing amount of ethylenediamine-N-propyl bonding.
Key words∶ethylenediamine-N-propyl modified silica gel; bonding quantity; ginkgo acid removal
胺类硅胶材料由于强吸附性能已经成为人们研究的热门课题[1-4],乙二胺-N-丙基键合硅胶(PSA)是目前被广泛应用的一种胺基键合硅胶,因PSA具有两个胺基且存在仲胺,通过弱阴离子交换和正相保留作用,其具有较大的离子交换容量[5]。李来明等[6]采用非均相氨化法合成硅胶微球,制备了氨丙基和乙二胺-N-丙基两种胺基键合硅胶并评价了其对甲苯磺酸吸附的吸附量。Aguado等[7]制备了氨丙基、乙二胺-N-丙基、二乙烯三胺基丙基功能化介孔硅胶SBA-15材料,可用于污水中重金属Cu2+等重金属离子的吸附。王军等[8]以PSA和十八烷基键合硅胶为净化材料去除样品中的干扰物质,建立了一种QuEChERS-气相色谱-质谱法检测酥油中的8种有机磷农药残留。蒋明明等[9]建立了一种基于PSA和多壁碳纳米管通过超高效液相色谱-质谱法测定普洱茶中3种手性杀菌剂农药残留的分析方法。Ma等[10]通过PSA去除番茄、甜椒和甜食中的有机酸、一些糖类和极性色素。然而,目前同一厂家的商品化PSA离子交换容量通常为固定值,针对不同有害物质的脱除需要不同离子交换容量的PSA来实现,对PSA的应用效果及应用领域产生了一定的限制作用。目前PSA生产处于实验室阶段,中试批量生产PSA难度大,无法满足PSA的实际应用需求。因此,开发乙二胺-N-丙基键合量可控的PSA制备工艺,并进行中试放大实验生产批次稳定性高、离子交换容量可选的PSA具有重要的应用价值。
银杏叶提取物中含有银杏黄酮和银杏内酯等药用活性成分[11],但其中也含有具有较强毒副作用[12-15]的银杏酸[16-17]。《中国药典》[18]中规定银杏叶提取物中银杏酸的质量分数不得超过5 mg/kg,其中白果新酸为银杏酸中的主要成分,白果新酸具有抗氧化、抗血小板聚集及改善记忆、提高机体免疫功能等药理作用,可用于防治农业病虫害、抑制痤疮致病菌等。目前通常使用大孔树脂脱除银杏酸,辛云海[19]用D918阴离子交换树脂对银杏提取物中银杏酸进行脱除,但大孔树脂存在处理步驟繁琐、成本较高且会出现破碎的问题。硅胶作为一种稳定的无机材料具有高机械稳定性,乙二胺-N-丙基官能团具有双氨基结构,与银杏酸间可产生强吸附作用力,因此PSA在银杏酸脱除中具有理想的应用前景。
本文探讨了PSA制备工艺中乙二胺-N-丙基硅烷化试剂和三甲基氯硅烷两个关键参数的用量与PSA键合量的关系,实现PSA离子交换容量可调控的制备工艺要求,并对优化的制备工艺进行中试放大实验,通过离子交换容量、红外光谱和元素分析结果对制备重复性进行表征,保证制备工艺的批次稳定性。将制备的PSA填充成分离纯化小柱,应用于银杏叶提取物中有害物质银杏酸的脱除。采用《中国药典》中规定的高效液相色谱法对银杏酸含量进行定量分析,考察了不同离子交换容量的PSA对银杏酸的脱除效率,评价PSA在银杏酸脱除方面的应用前景。
1 实验部分
1.1 试剂与仪器
硅胶(230~400目),青岛美高集团有限公司;乙二胺-N-丙基三甲氧基硅烷(纯度≥95%),上海吉至生化科技有限公司;三甲基氯硅烷(纯度≥99.99%),上海阿拉丁生化科技股份有限公司;白果新酸(标准品,纯度≥98%),四川维克奇生物科技有限公司;浓盐酸、甲苯、4A型分子筛、二氯甲烷、三氟乙酸、磷酸、乙醇和甲醇,AR,国药集团化学试剂有限公司;甲醇,色谱纯,德国默克股份公司;乙腈,色谱纯,天津康科德科技有限公司。
Waters 2695高效液相色谱仪配置Waters 2487双波长检测器,美国Waters公司;Vario ELⅢ型元素分析仪,德国Elementar公司;Nicolet 6700FTIR Spectormeter型傅里叶变换红外分析光谱仪,美国Thermo公司;R-1001VN型旋转蒸发仪,郑州长城科工贸有限公司;高精度电位滴定仪,北京海光仪器有限公司;马弗炉,济南精锐分析仪器有限公司;反应釜,南京科尔仪器设备有限公司;电热鼓风烘箱,上海精宏实验设备有限公司;真空干燥箱,上海一恒科学仪器有限公司。
1.2 PSA的制备
1.2.1 PSA制备工艺优化
将硅胶置于450 ℃马弗炉中活化6 h,得到活化硅胶。取活化硅胶置于质量分数20%盐酸中,于25 ℃机械搅拌10 h,待反应结束后,用超纯水多次洗涤至中性,于65 ℃鼓风烘箱干燥3 h,65 ℃真空烘箱干燥10 h,得酸化硅胶。称取20 g酸化硅胶,置于150 mL三口圆底烧瓶中,加入100 mL除水甲苯,分别加入不同体积乙二胺-N-丙基三甲氧基硅烷(3.4、4.1、4.8、5.5、6.8、8.2 mL,PSA编号分别为1#、2#、3#、4#、5#和6#),通N2作为保护气,机械搅拌下于50 ℃冷凝回流反应24 h,待反应完成后,冷却过滤,依次采用50 mL甲苯、3次50 mL甲醇洗涤,于80 ℃鼓风烘箱预烘,80 ℃真空烘箱干燥过夜得不同键合量的PSA,其反应式如图1所示。
1.2.2 PSA中试放大实验
中试放大实验在10 L带机械搅拌控温反应釜中进行,加入2 kg酸化硅胶、550 mL乙二胺-N-丙基三甲氧基硅烷和7 L除水甲苯,通N2作为保护气,机械搅拌下于50 ℃冷凝回流反应24 h,待反应完成后,冷却过滤,依次采用甲苯和甲醇进行洗涤,于80 ℃鼓风烘箱预烘,80 ℃真空烘箱干燥过夜得中试键合PSA。
1.3 PSA离子交换容量的测定
PSA上键合的乙二胺-N-丙基官能团上的两个胺基可以与H+发生酸碱中和反应,因此通过电位滴定仪和pH电极可以测定PSA的离子交换容量:称取0.2 g PSA于锥形瓶中,加入120 mL浓度为 0.01 mol/L的HCl水溶液,超声10 min,静置1~2 h,使填料上的胺基和溶液中的H+充分反应,用移液管移取上清液50 mL于锥形瓶中,确保没过pH电极,加入1~2滴酚酞指示剂,用0.01 mol/L NaOH标准溶液滴定剩余的HCl,滴定终点时,记录消耗NaOH水溶液的体积,同时做空白,通过式(1)计算,可以得到离子交换容量(IEC),平行3次取平均值。
式中,c1为HCl溶液浓度,mol/L;V1为HCl溶液体积,mL;c2为NaOH溶液浓度,mol/L;V2为NaOH溶液体积,mL;V3为移取上清液体积,mL;m为PSA质量,g。
1.4 PSA脱除银杏酸
1.4.1 银杏酸含量检测方法
参考中国药典“银杏叶提取物”中银杏酸高效液相色谱检测(HPLC)方法,色谱柱为C18柱(4.6 mm×150 mm,5 μm),流动相(A)为体积分数0.1%三氟乙酸的乙腈,流动相(B)为体积分数0.1%三氟乙酸的水。紫外检测波长为310 nm,流速为1.0 mL/min,柱温为35 ℃,进样量为10 μL。流动相梯度:0~30 min,流动相A从75%升到90%,保持5 min,35~36 min,流动相A从90%降至75%,保持9 min。
以白果新酸为对照品,采用外标法进行定量。称取10 mg白果新酸标准品于10 mL容量瓶中,甲醇溶解定容,配制成质量浓度1 000 μg/mL的母液。用甲醇将母液稀释成质量浓度分别为0.1、0.25、0.5、1、5、10、25 μg/mL的标准工作液,采用HPLC进行检测绘制标准曲线。
1.4.2 银杏叶提取物的制备
取30 g银杏叶粉末于500 mL蓝盖瓶中,加入300 mL的乙醇,摇匀,超声1 h,抽滤并收集滤液;剩余滤渣再用300 mL的乙醇超声提取1 h,抽滤后合并滤液得到银杏叶提取液。取50 mL银杏液提取液进行旋转蒸发,将溶剂蒸干后得到0.33 g银杏叶提取物。
1.4.3 分离纯化柱的装填
在低压分离纯化柱管底部放入筛板,将柱管连接至真空抽滤瓶。取5 g PSA填料用乙醇-水(体积比4[KG-*2]∶[KG-*3]1)25 mL分散,超声1~2 min后用移液枪沿着管壁旋转加入到吸附柱中,抽干溶剂后将柱管顶部放入筛板压实,拧紧顶部盖子后完成装填。
2 结果与讨论
2.1 PSA的制备
PSA硅胶上乙二胺-N-丙基的键合量与其离子交换容量成正比关系,因此本文通过检测离子交换容量来反映乙二胺-N-丙基键合量的变化趋势。
2.1.1 PSA制备工艺优化
以20 g酸化硅胶为原料,进行PSA键合反应小试制备工艺优化。首先优化反应体系中乙二胺-N-丙基三甲氧基硅烷用量对离子交换容量的影响。构建6种键合反应体系,分别得到1# ~6#键合PSA,每种反应体系重复3次考察键合反应的批次重复性,1# ~6#键合PSA的离子交换容量相对标准偏差值范围为0.7%~5.9%,批次重复性良好。以PSA离子交换容量平均值为纵坐标、乙二胺-N-丙基三甲氧基硅烷体积为横坐标作图(图2),考察PSA键合量与硅烷化试剂用量间的关系。结果表明:当体系中乙二胺-N-丙基三甲氧基硅烷少于5.5 mL时,离子交换容量随硅烷化试剂用量增加而快速升高,而体系中乙二胺-N-丙基三甲氧基硅烷体积达到5.5 mL之后,离子交换容量增加趋势变平缓。原因是当硅胶表面硅羟基趋于键合饱和时,由于反应活性位点减少导致继续增加硅烷化试剂的量其键合量增加不明显。同时,体系中过剩的未反应硅烷化试剂可发生自交联反应,造成硅胶孔结构的堵塞,硅胶表面积降低。因此,对于PSA小试制备工艺体系,选择加入的乙二胺-N-丙基三甲氧基硅烷体积为5.5 mL。
2.1.2 PSA的中试放大实验
为了验证PSA制备小试优化的工艺可以成功应用于中试放大实验,按照小试工艺优化的物料比,酸化硅胶和乙二胺-N-丙基三甲氧基硅烷的量分别放大100倍,即2 kg酸化硅胶和550 mL乙二胺-N-丙基三甲氧基硅烷,溶剂除水甲苯的量放大70倍,即7 L,在10 L带机械搅拌机控温反应釜中进行中试放大实验。若完全按照小试优化工艺全部放大100倍,体积超出10 L反应釜的承载范围,因此对溶剂除水甲苯的放大倍数较少为70倍,经实验表明物料的分散和搅拌均满足实验要求。键合反应的键合温度、键合时间以及清洗步骤均参照小试工艺进行。键合反应重复3次,采用PSA的离子交换容量重复性评价中试放大实验的批次稳定性,结果列于表1,结果表明:采用最佳工藝中试放大实验离子交换容量重复性良好,三批次重复性相对标准偏差仅为0.7%。中试放大实验的离子交换容量与小试相比略有提升,原因可能为中试放大实验中溶剂除水甲苯的用量相对减少30%,因此单位溶剂中硅烷化试剂的浓度提升,从而导致键合量略有提升。与商品化PSA相比,最佳工艺中试放大实验制备的PSA可达到甚至优于商品化PSA的离子交换容量,说明中试放大合成工艺的可行性。
2.2 PSA的表征
2.2.1 红外光谱
对裸硅胶和PSA进行傅里叶红外光谱(FTIR)表征,图3为两者的IR谱图。裸硅胶谱图中1 100 cm-1处的吸收峰为硅胶上Si—O键的弯曲振动峰,3 460 cm-1和1 640 cm-1处的吸收峰分别为硅胶表面残留硅羟基O—H键的伸缩振动和弯曲振动峰。与裸硅胶相比,PSA谱图中在3 460 cm-1处出现了更为明显N—H键的伸缩振动峰[20],在708 cm-1处出现了—NH2的变形振动吸收峰,在2 960 cm-1和2 860 cm-1处出现了—CH的不对称和对称伸缩振动峰,表明乙二胺-N-丙基基团被成功键合到硅胶上。
2.2.2 元素分析
将小试工艺优化构建的6种反应体系所得PSA进行元素分析测试。如图4所示,PSA的碳、氮和氢元素质量分数随着键合反应体系中乙二胺-N-丙基三甲氧基硅烷用量的增加而快速上升,当乙二胺-N-丙基三甲氧基硅烷用量达到小试最优工艺5.5 mL时,所得PSA的碳、氮和氢元素质量分数分别为6.39%、2.86%和2.03%,然而硅烷化试剂用量继续增加时,碳、氮和氢元素质量分数增加趋势变平缓。结果表明:PSA的碳、氮和氢元素质量分数与硅胶上键合的乙二胺-N-丙基的量成正比,其变化趋势与离子交换容量的变化趋势相符合,因此小试制备工艺中乙二胺-N-丙基三甲氧基硅烷用量为5.5 mL时,键合量开始趋于饱和。
表2为最佳工艺中试放大实验所得3批次PSA的元素分析结果,与小试最佳工艺相比略有微,与离子交换容量的结果相符。与商品化PSA的元素分析结果相比,碳、氮和氢元素含量可达到甚至优于商品化PSA。
2.3 PSA对银杏酸的吸附研究
将中试放大制备的PSA填装成分离纯化小柱,用于银杏叶提取物中银杏酸的脱除。在真空作用下使银杏叶提取物通过小柱,收集净化液进行高效液相色谱分析,定量检测净化液中白果新酸含量。
2.3.1 白果新酸标准曲线的建立
将质量浓度分别为0.10、0.25、0.50、1.00、5.00、10.00、25.00 μg/mL的白果新酸标准工作液进行高效液相色谱分析,绘制标准工作曲线。所得标准工作曲线的线性回归方程为y=6 636.1x,相关系数r2=0.993 3。图5为白果新酸标准品液相色谱图(质量浓度为25 μg/mL)。
2.3.2 PSA离子交换容量对银杏酸脱除效率的影响
PSA键合的乙二胺-N-丙基官能团含有一个伯胺基团和一个仲胺基团,其与银杏酸含有的羧基以及酚羟基之间存在酸碱作用力,因此PSA对银杏酸具有强吸附作用。当银杏叶提取物通过PSA分离纯化柱时,银杏酸被吸附到填料上,从而达到银杏酸脱除的目的。为了考察PSA离子交换容量对银杏酸脱除效率的影响,
选取2#、3#、4#、5# PSA进行脱酸实验。每支PSA分离纯化柱总上样体积为25 mL银杏叶提取物,前10 mL上样体积间隔为2 mL,之后上样体积间隔改为1 mL,收集净化液定量分析白果新酸含量。银杏叶提取物的上样体积与净化液中白果新酸含量的关系图如图6所示:(1)2#、3#、4#和5# PSA分离纯化柱对白果新酸的突破体积(脱除效率为100%),分别为15、16、17、18 mL,结果表明随着离子交换容量的增加,突破体积增大,当上样体积大于18 mL时,所有PSA柱的净化液中均检出白果新酸。(2)《中国药典》中规定银杏叶提取物中银杏酸质量分数不得超过5 mg/kg,因此本文将净化液中白果新酸含量不高于5 mg/kg的上样体积作为最大上样体积,2#、3#、4#和5#PSA分离纯化柱的最大上样体积分别为21、22、23和24 mL。因此,PSA离子交换容量越高,对银杏酸的吸附效率越高,PSA的离子交换容量与银杏酸脱除效率成正相关关系。
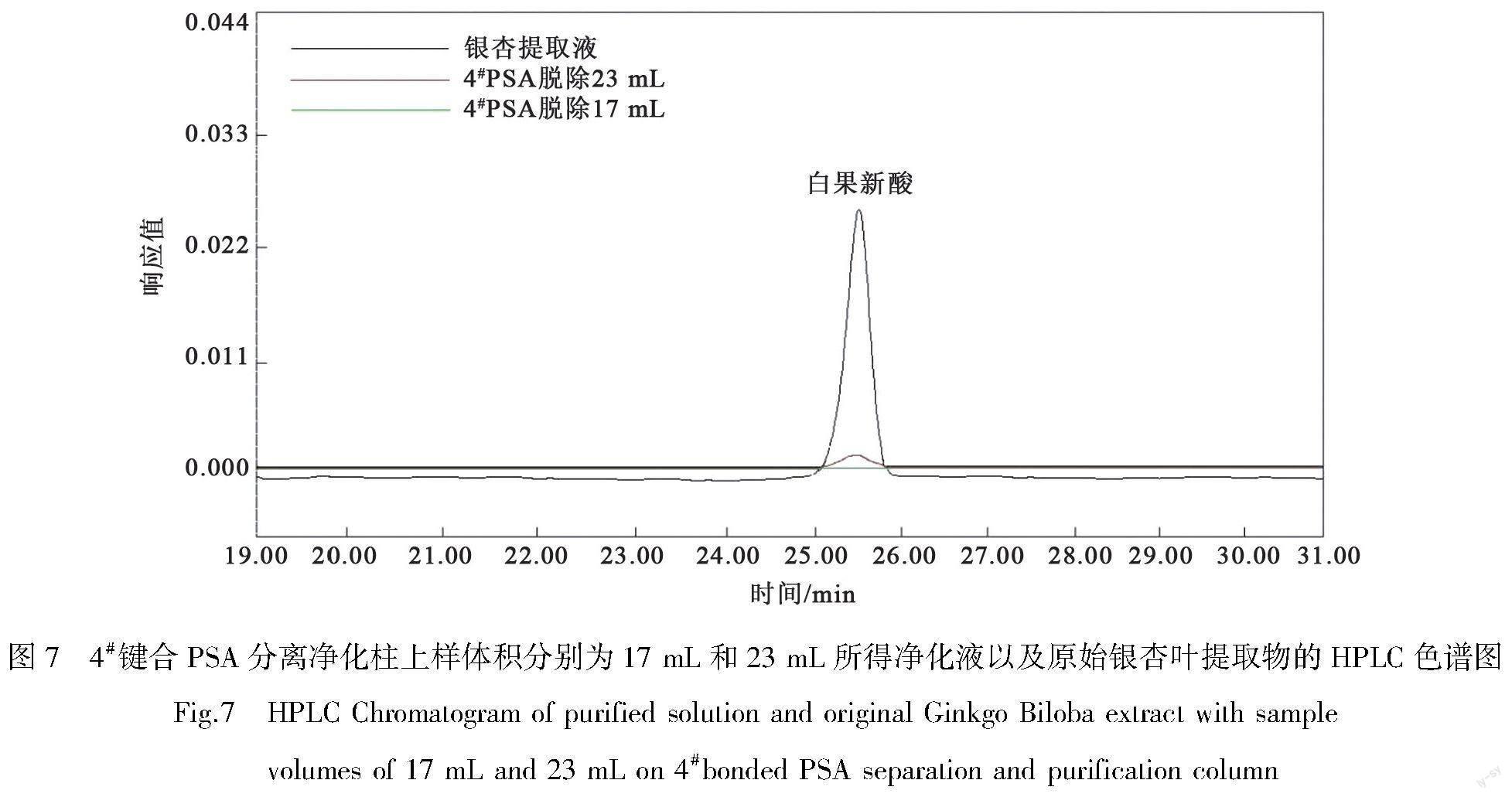
图7为4# 键合PSA分离净化柱上样体积分别为17 mL和23 mL所得净化液以及原始银杏叶提取物的HPLC色谱图。原始银杏叶提取物中白果新酸质量分数为6 682 mg/kg,4# PSA分离净化柱上样体积分别为17 mL和23 mL所得净化液中白果新酸质量分数分别为0和4.1 mg/kg。
3 结论
本文通过考察PSA小试制备工艺中硅烷化试剂与离子交换容量的变化关系,制备一系列离子交换容量不同的PSA并得到最优小试制备工艺。将最优小试制备工艺在10 L反应釜中进行公斤级中试放大实验,验证最优小试制备工艺的放大效果,对工业批量生产PSA具有一定借鉴意义。对中试实验制备、小试制备及商品化PSA进行离子交换容量、红外光谱和元素分析表征,并将其结果进行比较,结果表明中试放大实验得到的PSA性能与最优小试工艺相符,中试放大实验成功,并且其性能与商品化PSA性能相当。本文优化的制备工艺对工业生产PSA硅胶填料具有借鉴价值。将PSA装填成分离纯化小柱应用于银杏叶提取物中银杏酸的脱除,发现白果新酸的脱除效率与PSA的离子交换容量成正相关关系。4#键合PSA分离纯化柱对白果新酸脱除的突破体积和最大上样体积分别达到17 mL和23 mL,结果表明键合PSA在银杏酸脱除方面具有应用潜力。
参考文献:
[1]宋祥家, 李红霞. 胺类硅胶材料的合成及应用[J]. 化工技术与开发, 2012, 41(8): 26-28. DOI: 10.3969/j.issn.1671-9905.2012.08.008.
[2]王明华. 硅胶负载酰胺—胺型螯合树脂的合成及性能研究[D]. 烟台: 鲁东大学, 2008.
[3]朱萌. 胺類聚合物型亲水作用色谱固定相的制备及色谱性能评价[D]. 青岛: 青岛科技大学, 2019.
[4]王玲慧. 乙二胺硅胶材料的制备及其吸附性能研究[D]. 郑州: 郑州大学, 2010.
[5]包建民, 王惠柳, 李优鑫. HPLC级二氧化硅微球的制备及其功能化[J]. 精细化工, 2018, 35(9): 1457-1465. DOI: 10.13550/j.jxhg.20170514.
[6]李来明, 任芳芳, 包建民, 等. 7种胺基键合硅胶的制备及其对重金属Pb2+的吸附[J]. 色谱, 2020, 38(3): 341-349. DOI: 10.3724/SP.J.1123.2019.09030.
[7]AGUADO J, ARSUAGA J M, ARENCIBIA A. Influence of synthesis conditions on mercury adsorption capacity of propylthiol functionalized SBA-15 obtained by co-condensation[J]. Microporous and Mesoporous Materials, 2008, 109(1/2/3): 513-524. DOI: 10.1016/j.micromeso.2007.05.061.
[8]王军, 扎西次旦, 黄利英, 等. 基于N-丙基乙二胺键合硅胶和十八烷基键合锆胶的QuEChERS-气相色谱-质谱法检测酥油中的8种有机磷农药残留[J]. 食品安全质量检测学报, 2019, 10(21): 7360-7364. DOI: 10.19812/j.cnki.jfsq11-5956/ts.2019.21.050.
[9]蒋明明, 曾小娟, 宋红坤, 等. 多壁碳纳米管/N-丙基乙二胺混合吸附-超高效液相色谱-串联质谱法测定普洱茶中3种手性杀菌剂农药残留[J]. 食品安全質量检测学报, 2020, 11(6): 1702-1708. DOI: 10.19812/j.cnki.jfsq11-5956/ts.2020.06.002.
[10]MA Y C, MANI A N, CAI Y L, et al. An effective identification and quantification method for ‘Ginkgo biloba flavonol glycosides with targeted evaluation of adulterated products[J]. Phytomedicine, 2016, 23(4): 377-387. DOI: 10.1016/j.phymed.2016.02.003.
[11]池静端. 银杏叶中黄酮类成分的化学研究[J]. 中国中药杂志, 1998, 23(1): 40-41.
[12]杨小明, 陈钧, 钱之玉. 烷基酚酸的生物活性研究进展[J]. 中草药, 2003, 34(5): U005-U006. DOI: 10.3321/j.issn: 0253-2670.2003.05.047.
[13]沈琦, 李贺, 廉洪, 等. 银杏酸对大鼠肝毒性的影响研究[J]. 中国临床药理学杂志, 2018, 34(12): 1457-1459. DOI: 10.13699/j.cnki.1001-6821.2018.12.018.
[14]IRIE J, MURATA M, HOMMA S. Glycerol-3-phosphate dehydrogenase inhibitors, anacardic acids, from Ginkgo biloba[J]. Bioscience, Biotechnology, and Biochemistry, 1996, 60(2): 240-243. DOI: 10.1271/bbb.60.240.
[15]张秀丽, 杨小明, 夏圣, 等. 银杏酸对痤疮致病菌的抑制作用[J]. 江苏大学学报(医学版), 2007, 17(6): 523-525. DOI: 10.13312/j.issn.1671-7783.2007.06.004.
[16]王云飞, 杨小明, 李月英, 等. 银杏酚对SMMC-7721肝癌细胞和荷H22肝癌小鼠的抗癌作用[J]. 江苏大学学报(医学版), 2013, 23(3): 233-237. DOI: 10.13312/j.issn.1671-7783.2013.03.018.
[17]姚建标, 金辉辉, 王如伟, 等. 银杏叶提取物中总银杏酸HPLC法限量检测[J]. 药物分析杂志, 2015, 35(11): 2041-2044. DOI: 10.16155/j.0254-1793.2015.11.30.
[18]国家药典委员会.中华人民共和国药典2020年版一部[S].北京:中国医药科技出版社,2020.
[19]辛云海. 银杏叶化学成分及银杏酚酸脱除工艺的研究[D]. 桂林: 广西师范大学, 2007.
[20]YU J G, LE Y, CHENG B. Fabrication and CO2 adsorption performance of bimodal porous silica hollow spheres with amine-modified surfaces[J]. RSC Advances, 2012, 2(17): 6784-6791. DOI: 10.1039/C2RA21017G.
