肺热普清散对低氧诱导斑马鱼运动损伤的保护作用及对Hif1α的影响
2024-02-26吴永昊谢和兵侯海荣王荣春陈锡强
吴永昊 谢和兵 侯海荣 王荣春 陈锡强


摘要:探討藏药复方肺热普清散对低氧环境下斑马鱼模型的保护作用及其对低氧诱导因子1α(Hif1α)的影响。建立斑马鱼低氧运动损伤模型,分别检测低氧条件下斑马鱼行为学和整体乳酸水平,以受精后72 h AB型斑马鱼幼鱼为实验对象,空白对照组采用正常溶氧100%(8.4 mg/L),低氧组采用纯氮气置换获得溶氧50%(4.2 mg/L)培养水,50%低氧水加不同浓度肺热普清散处理胚胎24 h。采用斑马鱼行为学分析仪记录30 min游泳轨迹,使用Zeblab软件导出30 min内运动距离和运动时间;分别对实验后各组斑马鱼进行整体匀浆并测定组织乳酸含量和乳酸脱氢酶(lactate dehydrogenase, LDH)活力;利用蛋白印迹(western blot, WB)分析各组斑马鱼Hif1α的表达水平变化;使用免疫组织化学方法对各组鱼尾鳍部Hif1α表达进行比较。结果表明,与低氧对照组比较,肺热普清散 10~30 mg/L剂量组可显著增加低氧诱导引起的运动距离和运动时间(p<0.05),并且相对于低氧引起的乳酸升高(p<0.001), 10~30 mg/L组的乳酸含量明显降低(p<0.05);同时LDH与低氧组活力比较,肺热普清散30 mg/L组可显著降低LDH活力(p<0.05);WB实验结果显示,与低氧组比较,肺热普清散可抑制Hif1α表达(p<0.05);同时免疫组化结果显示10 mg/L 肺热普清散可减少Hif1α表达。由此肺热普清散对急性斑马鱼低氧损伤模型引起的运动损伤有保护作用,其耐低氧机制与Hif1α表达有关。
关键词:肺热普清散;斑马鱼;低氧;运动损伤;低氧诱导因子1α
中图分类号:R285.5 文献标志码:A 文章编号:1002-4026(2024)01-0032-07
Protective effect of Feirepuqing Powder on hypoxia-induced sports injury in zebrafish model by inhibiting Hif1α
Abstract∶This study aimed to investigate the protective effects of the Tibetan medicinal compound Feirepuqing Powder on a zebrafish model in a hypoxic environment and its effect on the hypoxia-inducible factor 1α (Hif1α). Through establishing a zebrafish hypoxic injury model, behavioral and overall lactate changes under hypoxic conditions were investigated. Experiments were conducted using AB zebrafish larvae 72 h after fertilization. In the control group, 100% standard dissolved oxygen (8.4 mg/L) was used, while in the hypoxia group, pure nitrogen (N2) gas replacement was used to obtain 50% dissolved oxygen (4.2 mg/L) culture water, and the embryos were treated with 50% hypoxic water add different concentrations of Feirepuqing Powder for 24 h. The zebrafish behavioral analyzer was used to record the swimming trajectory for 30 min, and the Zeblab software was used to derive the movement distance and time during the 30 min. Following the experiment, all the zebrafish from both the groups were homogenized and the lactic acid and lactate dehydrogenase (LDH) content in their tissue were determined. The changes in the Hif1α expression level of the zebrafish in each group were analyzed via western blot (WB) analysis, and the expression of Hif1α in the caudal fin of each group of fish was compared using immunohistochemistry. The results revealed that compared with the hypoxic control group, 10 to 30 mg/L Feirepuqing Powder group significantly increased the hypoxia-induced exercise distance and exercise time (‘p<0.05), and relative to the hypoxia-induced lactic acid increase (‘p<0.001), the lactic acid content of the 30 mg/L Feirepuqing Powder group significantly reduced. When LDH activity was compared with that of the hypoxic group, LDH activity was significantly reduced in the 30 mg/L Feirepuqing Powder group (‘p<0.05). The WB results revealed that when compared with the hypoxia group, Feirepuqing Powder inhibited the expression of Hif1α (‘p<0.05). Finally, the immunohistochemical results showed that 10 mg/L of Feirepuqing Powder reduced the expression of Hif1α. The results of this study show that Feirepuqing Powder exhibits a protective effect on induced exercise injuries in an acute zebrafish hypoxic injury model and that its hypoxia-tolerance mechanism is related to the expression of Hif1α.
Key words∶Feirepuqing Powder; zebrafish; hypoxia; exercise injuries; hypoxia-inducible factor 1α
高原病又称高山病,是在高海拔地区活动引发的主要以缺氧为主的一组疾病,病变涉及呼吸系统、神经系统和循环系统等。该类疾病具有广泛性和突发性的特点,严重威胁人们的生命健康,因此针对急、慢性高原病的致病机理研究和药物研发亟待开展。高原病的发生与低氧条件下糖代谢异常密切相关,始于糖酵解的启动,此过程组织中会积累大量乳酸,除了会影响运动系统功能外,还会诱导产生多种活性氧(reactive oxygen species,ROS),过量的ROS损害机体细胞和功能,引起炎症因子并促进其释放,同时细胞内低氧诱导因子家族(hypoxia inducible factor,Hif)受到刺激开始表达[1-3],其中Hif1α是低氧诱导损伤引起的低氧调控的关键因子[4-5]。斑马鱼模型是近年药物筛选应用中常用的动物模型,基于遗传学和器官发育的研究成果,该模型在药物低氧的保护作用评价中也有独特的优勢,利用低含氧的培养水可以复制鱼缺氧反应,低氧刺激在行为学和分子机制方面都与哺乳动物类似,近年来借助斑马鱼低氧模型针对相关疾病机理和信号通路的研究已有报道[6-7]。
高原病属于疑难病之一,对症治疗是目前的首选治疗手段,针对高原病的特效药物仍然处于空白,因而针对高原病的药物研发是大健康的重要议题。藏药是我国民族医药重要的组成部分,在临床上有百年的应用历史,在高原地区患者中得到广泛认可,但针对藏药复方的现代药学系统性研究还远远不足,其作用机制和相关的药效学研究尚处于起步阶段。肺热普清散是收录于藏医学《四部医典》中的效验方,在小儿难治性肺炎的治疗中有较佳效果[8]。肺热普清散具有经典藏药组方特点,主药包含多种芳香性中药,其中红花、檀香、丁香、降香、木香等为主要成分,共同发挥清肺泄热的功效,较早的研究发现该复方具有较强的抗炎作用[9]。临床报道证明其对高原地区的支气管和肺部感染有明确疗效[10]。现代研究发现该复方中多个成分具有抗ROS活性:红花黄色素、檀香油、降香黄酮具有显著的抗氧化应激和抗炎的活性[11-13];而丁香的主要成分丁香酚不仅具有抗菌的作用,而且有较强抗氧化和抗炎的活性;木香的水提物研究发现可显著恢复心肌乳酸脱氢酶(lactate dehydrogenase,LDH)活性,复方整体显示出较强的抗氧化应激作用[14]。
本研究利用斑马鱼低氧损伤实验模型,对肺热普清散在低氧损害保护中的作用进行评价,并考察其对低氧诱导Hif1α的表达影响。
1 材料与方法
1.1 主要试剂和仪器
肺热普清散由西藏神猴药业有限公司提供(国药准字Z54020045, 批号20210601),取原药粉末制成100 g/L母液,有微量沉淀,置于4 ℃保存,用前混匀。
链霉蛋白酶E(Pronase E,脱膜剂)和胚胎麻醉剂MS222购自北京索莱宝公司,Multiskan FC型酶标仪购自美国Thermo公司,Hif1α 一抗和GAPDH一抗购自美国CST公司,乳酸ELISA法试剂盒(D799851)和LDH测定试剂盒(BL853B)分别购自碧云天公司和赛国生物科技公司,超净工作台购自苏州安泰净化消毒设备厂, IX51倒置显微镜购自奥林巴斯(日本),DYY-6D电泳仪和DYZC-24C转印电泳仪购自北京六一公司,LiCOR-odyssey 400化学成像仪购自美国Genetech 公司,Zebrabox斑马鱼行为分析仪购自法国Viewpoint公司,斑马鱼养殖饲养系统购自北京爱生科技公司。
1.2 实验动物
本实验所选斑马鱼野生型AB系由山东省科学院生物研究所药物筛选平台提供,培养方法按照《斑马鱼及相关实验技术》操作[15], 实验所用为斑马鱼受精后72 h胚胎,受精24 h使用1.0 g/L Pronase E溶液脱去卵膜。在体视显微镜下挑选正常的斑马鱼胚胎,移入24孔培养板中。动物实验方案经山东省科学院生物研究所实验动物福利伦理委员会审查,审查批件号为SDSW20220606。
1.3 药物处理和行为学方法
挑选健康AB系斑马鱼幼鱼,随机分为6组,每组60条,分为常氧组、低氧组、低氧加肺热普清散多剂量组。常氧组为非密闭容器处理(8.4 mg/L);低氧组的低氧水用纯氮气通过管道持续输入常规培养水中制得,使用溶氧仪监控水中氧含量达到50%(4.2 mg/L),低氧组将低氧水和幼鱼置于密封瓶中;将肺热普清散样品(质量浓度分为1、3、10、30 mg/L等4组)与[JP2]斑马鱼幼鱼置于密封瓶中,28 ℃处理24 h。行为学分析采用低氧水幼鱼于24孔板中,每孔1条,放入斑马鱼行为学分析系统的暗箱中,使用Zeblab软件分别采集30 min内各组幼鱼的运动轨迹,利用软件导出游行距离和时间进行统计处理。
1.4 斑马鱼整体乳酸和LDH测定方法
乳酸测定实验方法按照报道的实验方法进行[16],将实验后的幼鱼,按照每组6个样本,每个样本取自10条幼鱼,每个样本麻醉后冰上进行匀浆,乳酸测定方法按照试剂盒要求按步骤进行,匀浆后收集上清液,依次制作标准曲线,利用酶标仪在570 nm条件下通过吸光度测定样品乳酸浓度。LDH测定方法按照各组取得30 mg幼鱼组织,冰上匀浆,8 000 r/min离心,取上清,按照测定试剂盒步骤操作,采用标准曲线计算LDH的活性。
1.5 蛋白印迹(western blot, WB)分析实验
WB的实验操作流程按照已报道方法进行[17],简略过程如下:实验后每组30条斑马鱼幼鱼麻醉后进行冰上匀浆,用冷组织裂解液提取蛋白,使用SDS-PAGE电泳技术进行蛋白质样本分离,随后湿法转膜至NC膜,一级抗体(Hif1α)和二级抗体分别进行1:1 000和1:10 000的稀释孵育,化学发光成像选用LiCOR-odyssey 400化学成像仪(美国基因公司)显影,利用机带软件Image studio1.0进行灰度分析。
1.6 免疫组化实验方法
实验后斑马鱼胚胎用PBS清洗2次,麻醉后放置于冰上处死,加入4%多聚甲醛过夜,用常規PBST-乙醇梯度脱水,然后用冷丙酮处理20 min,清洗后加3%马血清封闭2 h,更换封闭液,加入Hif1α一抗(1:200),置于4 ℃过夜,换为荧光二抗(Alexa Fluor@488)4 ℃过夜, 荧光显微镜下观察拍照,利用Image J软件将照片改为灰色背景。
1.7 统计学方法
应用SPSS 13.0对实验所得数据进行组间t检验, 多个样本均值比较采用单因素方差(anova)分析,各组数据以均值 ‘x±s表示,p<0.05为显著性差异,p<0.01为极显著性差异。
2 结果
2.1 肺热普清散对低氧斑马鱼模型行为学的影响
本实验共6组,按照每组8条置于24孔板中,每孔1条,同时进行轨迹记录见图1。低氧处理后行为学的实验结果显示:30 min内常氧对照组的运动不受影响,运动距离和运动时间均值分别达到了13.08 cm和11.97 min;低氧组的运动距离和运动时间均显著下降, 均值分别为2.14 cm和3.78 min,与常氧组比较具有显著性差异(p<0.001);低剂量肺热普清散组与低氧组比较无显著性差异;30 mg/L 肺热普清散组较低氧组运动时间有明显增强,运动距离和运动时间均值分别达到了6.47 cm和7.86 min(p<0.05)(表1)。
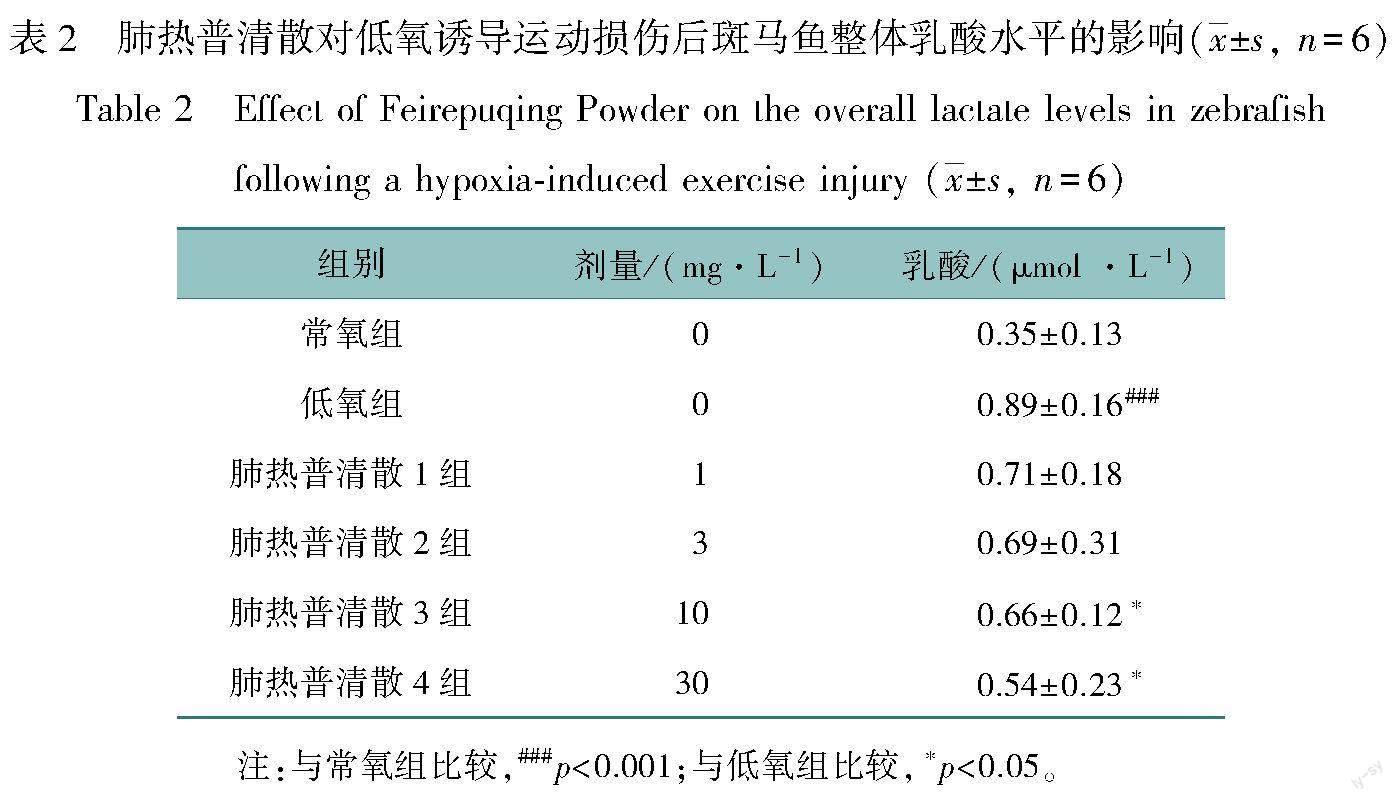
2.2 肺热普清散对低氧诱导运动损伤后斑马鱼整体乳酸水平和LDH活性的影响
本实验包含6个组,每组6个样本,单一样本取自10条幼鱼。以受精后72 h的斑马鱼幼鱼为实验动物,常氧组乳酸均值为0.35 μmol/L,用低氧培养水造模处理后,可以造成斑马鱼幼鱼活动减少,乳酸的浓度会显著增高,达到0.89 μmol/L 左右,与常氧组比较具有显著性差异(p<0.001);同时LDH活性也呈现同样的升高变化,常氧组与低氧组比较具有显著性差异(p<0.005)。用药组结果表明:处理24 h后,用药组乳酸均值均有降低,与低氧组相比,经肺热普清散10 mg/L和30 mg/L处理后,整体乳酸水平明显下降且具有统计学意义(p<0.05),具有剂量依赖性的倾向(数据见表2)。LDH活力的监测结果显示高浓度肺热普清散与低氧组比较具有显著性差异(p<0.05),如图2所示。
2.3 肺热普清散对斑马鱼Hif1α蛋白表达水平的影响
斑马鱼整体WB结果显示,低氧处理后Hif1α蛋白水平与常氧对照组比较呈现增高现象,肺热普清散低剂量组(1、3 mg/L)Hif1α未出现明显变化,而高剂量组(10、30 mg/L)可有效降低Hif1α表达水平,其中10 mg/L组抑制Hif1α表达具有极显著意义(p<0.01),说明肺热普清散对该模型的Hif1α表达水平有抑制作用(图3)。
2.4 肺热普清散对斑马鱼Hif1α免疫组化结果
免疫组化处理后的斑马鱼全身都有荧光点分布,本研究以鱼尾部位作为观察部位,对照组仅能见到少量白色荧光小点,而低氧处理后无论是躯干部位还是鱼鳍白色荧光点明显增加(图4白色箭头指示);经过10 mg/L 肺热普清散处理后的相同部位荧光点减少,表明经过肺热普清散处理可减少低氧条件下的Hif1α表达水平(图4)。
3 讨论与结论
普通人在高原地区活动都会受到高原低氧的影响,运动能力下降是低氧环境下的机体反应,同时低氧因素和糖酵解过程共同作用产生的乳酸在肌肉组织中积累,加重了运动障碍。本研究中低氧组的斑马鱼普遍出现了运动距离和运动时间缩短的情况,提示其运动能力显著性下降,同时伴随组织乳酸水平和LDH活性的升高。基于本实验中低氧诱导下斑马鱼行为学的典型变化,利用该模型运动能力(时间和距离)可量化的优势,评价肺热普清散的耐低氧能力,结果表明肺热普清散不仅能够提升低氧处理后的运动能力,同时对低氧引起的乳酸水平和LDH活性增加均有显著性的逆转作用,提示肺热普清散对于低氧引起的运动损伤具有提高缺氧耐受的作用,对于急性低氧损害引起的运动障碍有明显的改善作用。
低氧环境不仅引起机体血氧含量降低和糖代谢紊乱,以低氧-乳酸轴激活为特征的广泛继发反应更为有害,同时低氧参与到了包括肿瘤、感染、局部缺血和炎症等多个疾病过程中[18-19]。Hif1α是感知低氧和维持细胞氧内环境平衡的核心调节因子,常氧时会与VHL(Von Hippel-Lindau)蛋白结合并降解,几乎检测不到[20];低氧条件下其高表达,作为最重要低氧耐受的关键枢纽性因子,其会调控下游的多个靶基因的表达水平,同时伴行病理性变化[21-22]。研究表明低氧刺激斑马鱼模型的通路多个基因具有较高保守性,与哺乳动物的表型相近[4, 23-24]。在本研究中经过低氧联合肺热普清散处理后,Hif1α的表达水平显著降低,说明减少Hif1α表达是肺热普清散的耐缺氧调节的作用靶点之一,这种作用是直接作用还是间接影响尚需要深入的研究。动物细胞中对氧气的感知和反应是能量代谢中的基础细胞应激反应过程,低氧因子的升高并不是高原病的专属现象,低氧相关因子也参与了包括癌症、炎症以及血细胞发生等过程[25],本研究揭示肺热普清散的低氧保护作用与抑制Hif1α的表达有关,并且可以推测该复方在癌症和炎症等疾病中可能的应用前景。
本研究首次对传统藏药名方肺热普清散进行了实验研究,提示其具有显著的低氧运动损伤保护作用,并对相关的Hif1α具有显著的抑制作用。同时对肺热普清散的药用机制进行了初步探索,也为该类复方二次开发积累了必需的药理学数据。
参考文献:
[1]CLANTON T L. Hypoxia-induced reactive oxygen species formation in skeletal muscle[J]. Journal of Applied Physiology, 2007, 102(6): 2379-2388. DOI: 10.1152/japplphysiol.01298.2006.
[2]MCGARRYT, BINIECKA M, VEALE D J, et al. Hypoxia, oxidative stress and inflammation[J]. Free Radical Biology and Medicine, 2018, 125: 15-24. DOI: 10.1016/j.freeradbiomed.2018.03.042.
[3]SENDOEL A, HENGARTNER M O. Apoptotic cell death under hypoxia[J]. Physiology, 2014, 29(3): 168-176. DOI: 10.1152/physiol.00016.2013.
[4]IVASHKIV L B. The hypoxia-lactate axis tempers inflammation[J]. Nature Reviews Immunology, 2020, 20(2): 85-86. DOI: 10.1038/s41577-019-0259-8.
[5]KIM H R, GREENALD D, VETTORI A, et al. Zebrafish as a model for von Hippel Lindau and hypoxia-inducible factor signaling[J]. Methods in Cell Biology, 2017, 138: 497-523. DOI: 10.1016/bs.mcb.2016.07.001.
[6]LEE Y, LEE S, PARK J W, et al. Hypoxia-induced neuroinflammation and learning-memory impairments in adult zebrafish are suppressed by glucosamine[J]. Molecular Neurobiology, 2018, 55(11): 8738-8753. DOI: 10.1007/s12035-018-1017-9.
[7]HAN S W, XU W G, WANG Z Y, et al. Crosstalk between the HIF-1 and Toll-like receptor/nuclear factor-κB pathways in theoral squamous cell carcinoma microenvironment[J]. Oncotarget, 2016, 7(25): 37773-37789. DOI: 10.18632/oncotarget.9329.
[8]國家药典委员会. 中华人民共和国药典2020年版一部 [M]. 北京: 中国医药科技出版社, 2020.
[9]ZHANG Y, CEN J A, JIA Z L, et al. hepatotoxicity induced by isoniazid-lipopolysaccharide through endoplasmic reticulum stress, autophagy, and apoptosis pathways in zebrafish[J]. Antimicrobial Agents and Chemotherapy, 2019, 63(5): 01639-18. DOI: 10.1128/aac.01639-18.
[10]贡保吉. 藏西医结合治疗小儿支气管肺炎50例疗效观察[J]. 西部中医药, 2013, 26(10): 65-66.
[11]BARRIONUEVO W R, FERNANDES M N, ROCHA O. Aerobic and anaerobic metabolism for the zebrafish, Danio rerio, reared under normoxic and hypoxic conditions and exposed to acute hypoxia during development[J]. Brazilian Journal of Biology, 2010, 70(2): 425-434. DOI: 10.1590/s1519-69842010000200027.
[12]MATEEN S, REHMAN T, S SHAHZAD, et al. Anti-oxidant and anti-inflammatory effects of cinnamaldehyde and eugenol on mononuclear cells of rheumatoid arthritis patients[J]European Journal of Pharmacology,2019, 852:14-24, DOI:10.1016 /j.ejphar. 2019.02.031.
[13]FRANCOIS-NEWTON V, BROWN A, ANDRES P, et al. Antioxidant and anti-aging potential of Indian sandalwood oil against environmental stressors in vitro and ex vivo[J].Cosmetics, 2021, 8(2): 53. DOI: 10.3390/cosmetics8020053.
[14]何欣, 杨云, 赵祥升, 等. 降香化学成分及药理作用研究进展[J]. 中国现代中药, 2022, 24(6): 1149-1166. DOI: 10.13313/j.issn.1673-4890.20210327002.
[15]董武. 斑馬鱼及相关实验技术[M]. 青岛: 中国海洋大学出版社, 2006.
[16]陈锡强, 韩利文, 王希敏, 等. 人乳腺癌斑马鱼移植瘤模型建立[J]. 中国药理学通报, 2016, 32(1): 128-132. DOI: 10.3969/j.issn.1001-1978.2016.01.027.
[17]采金金, 谢和兵, 吴永昊, 等. 肺热普清散对斑马鱼炎症模型的抗炎作用及机制研究[J]. 药物评价研究, 2023, 46(2): 364-369. DOI: 10.7501/j.issn.1674-6376.2023.02.017.
[18]MOHAMED SALEEM T S, PRASANTHI A, VISHNU M N, et al. Aqueous extract of Saussurea lappa root ameliorate oxidative myocardial injury induced by isoproterenol in rats[J]. Journal of Advanced Pharmaceutical Technology & Research, 2013, 4(2): 94. DOI:10.4103/2231-4040.111525.
[19]GONZALEZ F J, XIE C, JIANG C T. The role of hypoxia-inducible factors in metabolic diseases[J]. Nature Reviews Endocrinology, 2019, 15(1): 21-32. DOI: 10.1038/s41574-018-0096-z.
[20]KROCK B L, SKULI N, SIMON M C. Hypoxia-induced angiogenesis: Good and evil[J]. Genes & Cancer, 2011, 2(12): 1117-1133. DOI: 10.1177/1947601911423654.
[21]HARRIS J H. Hypoxic treatment of zebrafish embryos and larvae[EB/OL]. [2023-01-12]. https://doi.org/10.2307/j.ctv1khdp5v.
[22]ELKS P M, RENSHAW S A, MEIJER A H, et al. Exploring the HIFs, buts andmaybes of hypoxia signalling in disease: lessons from zebrafish models[J]. Disease Models & Mechanisms, 2015, 8(11): 1349-1360. DOI: 10.1242/dmm.021865.
[23]ZIELLO J E, JOVIN I S, HUANG Y. Hypoxia-Inducible Factor (HIF)-1 regulatory pathway and itspotential for therapeutic intervention in malignancy and ischemia[J]. The Yale Journal of Biology and Medicine, 2007, 80(2): 51-60.
[24]SUZUKI N, GRADIN K, POELLINGER L, et al. Regulation of hypoxia-inducible gene expression after HIF activation[J]. Experimental Cell Research, 2017, 356(2): 182-186. DOI: 10.1016/j.yexcr.2017.03.013.
[25]MANDIC M, BEST C, PERRY S F. Loss of hypoxia-inducible factor 1α affects hypoxia tolerance in larval and adult zebrafish (Danio rerio)[J]. Proceedings of the Royal Society B: Biological Sciences, 2020, 287(1927): 20200798. DOI: 10.1098/rspb.2020.0798.
