SLC6A8 通过BNIP3L 调控线粒体自噬促进肝癌细胞增殖
2024-02-23李文川许佐明罗宗将马嘉盛
路 远,唐 俊,李文川,许佐明,罗宗将,马嘉盛,浦 涧
(右江民族医学院附属医院,广西 百色 533000)
肝细胞癌是一种常见的原发性肝癌,通常在不可切除的晚期被诊断,发病率和死亡率高,是癌症相关死亡的第三大主要原因[1]。据统计,2020 年,全球估计有90.57 万人确诊肝癌,同时83.02 万人死于肝癌[2]。目前,肝细胞癌患者有多种治疗选择,大致可以分为治愈性治疗(肝移植、手术切除或消融/细分性动脉内放射性微球)和非治愈性治疗(动脉化疗栓塞(TACE)、全身性治疗),但对于BCLC D 期患者仍无特异有效的治疗方法[3,4]。
线粒体自噬是一种保守的细胞内分解代谢过程,负责清除功能失调或多余的线粒体以维持细胞中的线粒体质量和需要[5]。研究发现,肿瘤细胞依赖健康的线粒体促进其生长[6],并通过线粒体自噬更新决定癌症功能和命运[7]。例如,STOML2 可能通过促进PINK1 介导的线粒体自噬,增加肝细胞癌的 转 移 能 力,并 调 节 对Lenvatinib 的 敏 感 性[8]。此外,Ketoconazole 可能通过加剧线粒体自噬来诱导肝细胞癌的凋亡[9]。因此,线粒体状态对肝细胞癌的发展尤为重要。近几年的研究表明,化疗和靶向药物介导的线粒体损伤因线粒体自噬增加而减弱,线粒体自噬与肿瘤治疗耐药性和复发密切相关[10-12]。这些发现强调了线粒体自噬在肝细胞癌发展和治疗中的重要性,也揭示了其作为潜在治疗靶点的可能性。
可溶性载体家族6 成员8(Solute carrier family 6 member 8,SLC6A8)是一种编码肌酸特异性转运蛋白的基因,其以Na+和Cl-依赖性的方式将肌酸转运到细胞内[13]。目前,SLC6A8基因在多种癌症中的作用已被多次报道[14-16],其中,在肝细胞癌中,SLC6A8基因已被发现其敲低可抑制人肝癌Huh-7和Hep3B 细胞侵袭和迁移[17]。而线粒体自噬受体BNIP3L(BCL2/adenovirus E1B interacting protein 3-like,BCL2/腺病毒E1B 相互作用蛋白3 样)通过介导选择性去除线粒体[18]。然而,SLC6A8 是否通过BNIP3L 调控线粒体自噬未见相关报道,值得进一步探讨。
本研究旨在通过转染SLC6A8 过表达慢病毒,探讨SLC6A8 过表达通过BNIP3L 调控线粒体自噬,及其在促进肝癌细胞增殖中的作用,进一步研究线粒体自噬在肝细胞癌中的调控机制和影响。这为深入理解SLC6A8 和BNIP3L 在肝细胞癌中的作用及其相互作用的机制提供了理论依据,同时深入对线粒体自噬的研究,有助于揭示肝细胞癌的发病机制,并为肝细胞癌的治疗提供新的靶点和策略。
1 材料与方法
1.1 实验细胞
人肝癌细胞株Huh-7、Hep3B 购自上海生物科学研究所。在体外低氧条件下,人肝癌Huh-7 使用DMEM 培养基(HyClone,SH30243.01B)添加10%胎牛血清(Gibco,42F7180K)进行培养,Hep3B 细胞则使用MEM 培养基(HyClone,SH30024.01B)加入10%胎牛血清培养。随后,这些细胞在无血清的条件下继续培养。为模拟低氧环境,细胞被分别置于一个设置为1% O2、5% CO2和94% N2平衡气体环境中,并在37 ℃温度的培养箱中培养,均持续培养20 h。完成培养后收样以进行后续实验。作为实验的阴性对照,细胞以等量的磷酸盐游离生理盐水(PBS)处理12 h。
1.2 TCGA 数据库分析
利用仙桃学术(https://www.xiantaozi.com/),通过TCGA 数据库分析SLC6A8在正常人体组织和肝癌组织中的表达,以及SLC6A8与BNIP3L表达相关性,同时进行肝癌组织中SLC6A8与线粒体自噬相关基因的相关性分析。
1.3 RT-PCR 检 测SLC6A8 和BNIP3L 的 表 达
首先使用Trizol 试剂盒(Invitrogen,GT1402)按照说明书提取细胞总RNA。接着使用RNeasy Mini 试剂盒(Qiagen,74104)对提取的总RNA 进行纯化处理。然后,使用逆转录试剂盒SuperScript ⅣReverse Transcriptase(Invitrogen,18090010)进行逆转录反应,将RNA 转录为cDNA。使用GoScript Reverse Transcription System 试 剂 盒(Promega,A5000)进行RT-PCR 扩增。表达数据分析统一标准化为内参GAPDH。使用2-ΔΔCt方法评估相对表达水平。实验过程中涉及的引物如下:SLC6A8-F:CATCTCCAAGGTGGCAGAGT;SLC6A8-R:G ATGAAGCCCTCCACACCTA;BNIP3L-F:CAG CAGGGACCATAGCTCTC;BNIP3L-R:TCATGGCTCCACTTTTCCTC;GAPDH-F:CCAGG TGGTCTCCTCTGA;GAPDH-R:GCTGTAGCCAAATCGTTGT。
1.4 Western blot 检测SLC6A8 和BNIP3L 蛋白的表达量
使用RIPA 裂解液(碧云天技术,P0013B)50 mL 对Huh-7 和Hep3B 细胞进行裂解,收集蛋白质样本。并使用BCA 蛋白质测定试剂盒(Thermo Fisher Scientific,23225)按照说明书测定蛋白质浓度。将蛋白样本与SDS 样本缓冲液混合,并在SDS-PAGE 凝胶(Bio-Rad,456-1094)中进行电泳分离。然后将分离的蛋白转移到PVDF 膜(Merck Millipore,IPVH00010)上。为了防止非特异性结合,使用5%脱脂牛奶50 mL 在TBST 缓冲液中封闭膜1 h。接下来,加入抗SLC6A8(ab151315)和抗BNIP3L(ab10433)一抗(Abcam)进行反应,按1∶1 000稀释,每个样本5 μL 孵育膜过夜。使用TBST 缓冲液洗涤膜3 次,使用与一抗相匹配的HRP 标记二抗(Santa Cruz Biotechnology,sc-2004)进行反应,按1∶2 000 稀释,每个样本5 μL 孵育1 h。再次使用TBST 缓冲液洗涤膜3 次。使用ECL 化学发光试剂盒(GENVIEW,GE2301)进行化学发光显色。使用Image J 软件定量条带密度。将蛋白质的相对水平归一化为GAPDH。
1.5 免疫荧光观察线粒体自噬相关蛋白
将Huh-7 和Hep3B 细胞株种植在适合免疫荧光的载玻片上。使用Lipofectamine 2000 转染试剂(Thermo Fisher Scientific,11668019)转染SLC6A8过表达质粒、阴性对照质粒到细胞中。转染48 h后,使用4% 甲醛10 mL 固定细胞15 min。使用0.1% Triton X-100(Sigma-Aldrich,T9284)10 mL在PBS 中渗透细胞10 min。使用5%BSA(Sigma-Aldrich,A9418)50 mL 在PBS 中封闭细胞1 h,以防止非特异性结合。随后,加入抗TOM20(ab56783)和抗LC3(ab128025)一抗(Abcam),按1∶200 稀释,每个样本5 μL 并在4 ℃下孵育过夜。使用PBS 洗涤细胞3 次,每次5 min。使用与一抗相匹配的荧光标记山羊抗兔二抗(Jackson ImmunoResearch,111-545-144),按1∶500 稀释,每个样本5 μL 于避光室温环境中孵育细胞1 h。再使用PBS 洗涤细胞3 次,每次5 min。使用DAPI(Sigma-Aldrich,D9542)按1∶1 000 稀释染色细胞核10 min。使用PBS 洗涤细胞两次。使用抗褪色封片液(Vector Laboratories,H-1000)封片。然后使用荧光显微镜观察并捕获图像。
1.6 CCK-8 检测细胞增殖
将Huh-7 和Hep3B 细胞株分别种植在96 孔板中,每孔5×103细胞,不同组进行3 次重复。使用Lipofectamine 2000 转染试剂转染SLC6A8 过表达质粒、阴性对照质粒、BNIP3L 沉默质粒到细胞中。在1、2、3、4、5 d 固定时间点,向每孔添加10 μL CCK-8 试剂(Dojindo,CK04)。并置于37 ℃、5% CO2孵育器中孵育3 h,直到颜色发展良好。使用酶标仪在450 nm 波长下读取吸光度值(OD 值)。使用阴性对照组的数据进行归一化,计算细胞增殖率。
1.7 统计学处理
计量资料以平均值±标准差(±s)表示。使用GraphPad Prism 9.0.0 软件进行数据分析与作图,两组之间的比较采用Student'st检验,单因素方差进行多组比较,P<0.05 为差异具有统计学意义。
2 结果
2.1 SLC6A8 在肝癌组织中高表达且与BNIP3L 表达正相关
通过TCGA 数据库分析SLC6A8基因,发现SLC6A8在肝癌组织中显著高表达(t=0.94,P<0.001),见 图1A;且SLC6A8在 肝 癌 组 织 中 与BNIP3L表达呈正相关(R=0.327,P<0.001),见图1B。根据对肝癌组织中SLC6A8 与线粒体自噬相关基因的相关性分析,结果显示SLC6A8 在肝癌组织中与线粒体自噬相关基因BNIP3L、PINK1、ATG5、ATG7、ULK1、MAP1LC3B有一定相关性,见图1C。

图1 SLC6A8 在肝癌组织中高表达且与BNIP3L 表达正相关Fig 1 SLC6A8 is highly expressed in liver cancer tissue and positively correlated with BNIP3L expression
2.2 SLC6A8 过表达促进线粒体自噬
采用RT-PCR 检测SLC6A8过表达人肝癌Huh-7 及Hep3B 细胞中SLC6A8mRNA 的表达。结果显 示,OE -SLC6A8 组(SLC6A8 过 表 达 组)中SLC6A8相 对 表 达 为4.29±0.34,显 著 高 于NC 组(阴性对照组)中SLC6A8 相对表达1.01±0.02(t=16.63,P<0.001),见图2A。使用Western blot 检测SLC6A8 蛋白的表达量。结果显示,OE-SLC6A8组中SLC6A8 蛋白相对表达为0.81±0.02,显著高于NC 组中SLC6A8 蛋白相对表达0.36±0.02(t=24.32,P<0.001),见 图2B。 使 用CCK -8 检 测SLC6A8 过表达人肝癌Huh-7 及Hep3B 细胞增殖率。结果显示,OE-SLC6A8 组第五天细胞增殖率(1.69±0.15)显著高于NC 组2.85±0.13(t=22.20,P<0.001),见图2C。通过免疫荧光标记线粒体蛋白TOM20 以及自噬体蛋白LC-3 观察线粒体自噬。结果显示,OE-SLC6A8 组中发生的线粒体自噬(黄色部分)显著多于NC 组,见图2D。

图2 SLC6A8 过表达促进线粒体自噬促进肝癌细胞增殖Fig 2 Overexpression of SLC6A8 promotes mitochondrial autophagy and promotes liver cancer cells proliferation
2.3 SLC6A8 过表 达促进BNIP3L 表 达
采用RT-PCR 检测SLC6A8过表达人肝癌Huh-7 及Hep3B 细胞中BNIP3LmRNA 的表达。结果显 示,OE-SLC6A8 组 中BNIP3LmRNA 相 对 表 达(1.40±0.13)显著高于NC 组中BNIP3LmRNA 相对表达1.03±0.07(t=4.34,P<0.05),见图3A。使用Western blot 检测BNIP3L 蛋白的表达量。结果显示,OE-SLC6A8 组中BNIP3L 蛋白相对表达量(0.82±0.03)显著高于NC 组中BNIP3L 蛋白相对表达量0.34±0.03(t=19.60,P<0.001),见图3B。
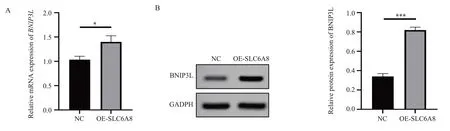
图3 SLC6A8 过表达促进BNIP3L 表达Fig 3 Overexpression of SLC6A8 promotes BNIP3L expression
2.4 沉默BNIP3L 逆转SLC6A8 过表达对肝癌细胞增殖的促进作用
采用CCK-8 检测沉默BNIP3L 后SLC6A8 过表达人肝癌Huh-7 及Hep3B 细胞的增殖率。CCK-8 结 果 显 示,沉 默BNIP3L 后OE-SLC6A8+KDBNIP3L 组(过表达SLC6A8+沉默BNIP3L 组)第5 天 的 细 胞 增 殖 率(2.01±0.14)显 著 低 于OESLC6A8 组(过 表 达SLC6A8 组)2.60±0.23(q=8.945,P<0.001);OE-SLC6A8 组第5 天的细胞增殖率(2.60±0.23)显著高于NC 组1.77±0.13(q=12.54,P<0.001),见图4。

图4 沉默BNIP3L 可以逆转SLC6A8 过表达对肝癌细胞增殖的促进作用Fig 4 Silencing BNIP3L can reverse the promoting effect of SLC6A8 overexpression on liver cancer cells proliferation
3 讨论
肝细胞癌是肝脏的原发性肿瘤,占肝脏原发性肿瘤的90%以上[3]。尽管近年来肝癌的治疗方法有所进步[3,19],但其复杂的发病机制以及晚期诊断的问题使得死亡率依然高居不下[20,21]。研究发现,基因的异常表达和调控可能是导致肝癌发生的关键因素之一[22]。某些基因的过度表达或沉默可能导致细胞的恶性转化,进而诱发肝癌的发生[23,24]。
SLC6A8基因编码肌酸转运蛋白[25],近年来研究发现其与结肠癌、非小细胞肺癌等多种肿瘤的恶性 进 展 有 关[26,27],并 且SLC6A8 在 多 种 癌 症 中 都 有显著的上调[28]。本课题组前期研究发现SLC6A8基因敲低可抑制人肝癌Huh-7 和Hep3B 细胞侵袭和迁移[17]。在本次研究中,进一步的实验结果显示,SLC6A8 的过表达不仅显著促进线粒体自噬,还促进人肝癌Huh-7 及Hep3B 细胞的增殖,与前期研究[17]结果一致。
根据报道,线粒体功能障碍与多种慢性肝病的发生和发展有关[29]。线粒体自噬是一个关键的生物过程,它通过选择性降解受损和老化的线粒体来维持细胞的线粒体质量[30],这对于肝细胞癌的发生和发展具有重要影响[31]。研究发现,线粒体自噬与代谢重编程、抗癌疗法抗性和癌细胞干细胞有关,这 为 针 对 肿 瘤 的 治 疗 提 供 了 新 的 策 略[32,33]。BNIP3L 是一种调控线粒体自噬的关键蛋白[34],其功能异常可能导致线粒体自噬的紊乱,进而影响肝细胞癌的发生和发展[31]。本研究显示,在肝癌组织中SLC6A8与线粒体自噬相关基因BNIP3L的正相关性最为显著。研究结果表明,SLC6A8的过表达能显著促进BNIP3LmRNA 和蛋白的表达,且沉默BNIP3L 可以逆转SLC6A8 过表达对肝癌细胞增殖的促进作用。 以上结果表明,SLC6A8 调控BNIP3L 的表达影响线粒体自噬,对肝细胞癌的发生和发展产生影响。
本研究虽然取得了一些有意义的研究结果,但仍存在不足。首先本研究主要基于细胞实验,未进行动物实验和临床试验,因此SLC6A8 和BNIP3L在体内的具体作用及机制仍需进一步探讨。其次,本研究只探讨了SLC6A8 与BNIP3L 之间的关系,但SLC6A8 可能还与其他基因或通路存在交互,这也是未来研究的方向。
总而言之,本研究发现SLC6A8 在肝癌组织中的高表达且与BNIP3L 正相关,SLC6A8 的过表达能促进线粒体自噬和肝癌细胞的增殖,沉默BNIP3L 可逆转SLC6A8 过表达对肝癌细胞增殖促进作用。这些发现不仅为理解肝细胞癌的发生机制提供了新的线索,也为开发新的肝细胞癌治疗策略提供了可能的靶点。
作者贡献度说明:
路远: 实验、统计分析与写稿;唐俊:细胞培养;李文川:RT-PCR 检测;许佐明:Western blot 检测;罗宗将:CCK8 检测;马嘉盛:免疫荧光观察自噬;浦涧:文章审核与经费支持。
所有作者声明不存在利益冲突关系。
