牛冠状病毒纤突蛋白的结构与功能分析
2024-02-22陆桂丽苗书魁魏婕魏玉荣米晓云海力且木·买买提依明




摘"要:【目的】""研究新疆牛冠状病毒(Bovine coronavirus,BCoV)流行株的遗传变异规律,分析纤突(Spike,S)蛋白结构与功能特征。
【方法】""对新疆巴楚县某牛场BCoV阳性的犊牛粪便,提取病毒RNA,采用RT-PCR方法扩增S基因,通过序列测定和拼接,获得BCoV S基因全长序列,对其开展生物信息学分析和遗传进化分析。
【结果】""获得BCoV S基因核苷酸序列(GenBank索引号:OR136878.1)。S基因全长4 092核苷酸(nucleotide,nt),编码1 363氨基酸(amino acid,aa)。BCoV S蛋白分子量为150.67 Ku,等电点为5.29,有1个跨膜螺旋区,亲水性较弱,疏水性略强。S蛋白主要分布于宿主细胞的内质网膜和高尔基体,具有信号肽的概率为0.984 2,是分泌型蛋白,含有14个潜在的N-糖基化位点和132个磷酸化位点。S蛋白具有3个结构域,其中受体结合结构域(Receptor binding domain,RBD)共含有215 aa,无规则卷曲(Coiled coil, Cc)占比最高(62.79%),其次为延伸链(Extended strand, Es)(20.47%)和α-螺旋(α-helix, Hh)(12.56%),β-转角(β-turn, Tt)占比最少(4.19%)。筛选出S蛋白15个优势B细胞表位和11个T细胞表位。S蛋白能与SWISS-MODEL数据库中模板(SMTL ID:7sbw.1.C)同源建模,二者序列相似性为92.00%,模型GMQE值为0.76,QMEAN值为0.82,符合率较高,拉氏图(Ramachandran plots)的Ramachandran favored值为96.14%,表明空间构象合理,模型准确可靠。遗传进化试验扩增的BCoVS基因序列,与2016年我国新疆的BCV-Aks-01株处于同一小分支,两者S基因核苷酸序列同源性为99.1%。
【结论】""BCoV S蛋白存在多个抗原表位。RBD在病毒进入宿主细胞时具有重要作用,可针对RBD序列设计疫苗靶点,阻止病毒与宿主受体结合。采用生物信息学方法首次分析BCoV S蛋白理化性质、信号肽和亚细胞定位、磷酸化位点、糖基化位点、结构域、抗原表位、三级结构和RBD二级结构等特征,为BCoV S基因遗传进化、结构与功能研究、疫苗研发、靶向药物设计提供参考。
关键词:""牛冠状病毒;纤突蛋白;生物信息学分析
中图分类号:"S858.23""""文献标志码:"A""""文章编号:"1001-4330(2024)11-2844-09
0"引 言
【研究意义】犊牛腹泻是由多因素引起的以腹泻为主要特征的症候群。腹泻可引起低血容量和酸中毒,对犊牛甚至是致命的,腹泻还可导致厌食症和共济失调[1]。BCoV是引起腹泻的病原之一,可导致犊牛腹泻、成年牛冬痢和牛呼吸道疾病,还可引起犊牛死亡率升高、牛生产性能及产奶量下降,常造成经济损失[2-5]。分析BCoV S蛋白生物信息学特征,为BCoV疫苗研发提供理论依据。【前人研究进展】近年来对BCoV的研究,包括检测、遗传进化分析和流行病学调查。Lotfollahzadeh S等[6]扩增了BCoV S基因,对其进行遗传进化分析。Qinghe Zhu等[7]对我国东北1 016头腹泻牛的BCoV流行病学调查显示,粪便阳性率为12.20%(124/1 016),鼻拭子阳性率21.53%(79/367)。寇美玲等[8]通过RT-PCR扩增,获得了BCoV的全基因组序列,并分析了遗传进化关系。张莹钰等[9]分离到BCV-Aks-01株,且进行了遗传进化分析。张坤[10]对新疆北疆7个奶牛场的BCoV开展检测,阳性率为0%~40%(ELISA)和0%~60%(RT-PCR)。【本研究切入点】BCoV属于套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)2a亚群,基因组全长约31 000 nt,编码5种结构蛋白:纤突蛋白(S)、核衣壳蛋白(N)、跨膜蛋白(M)、血凝素酯酶蛋白(HE)、小衣壳蛋白(E)[11-14]。其中S蛋白的主要负责病毒与易感细胞的结合,介导膜融合及诱导机体产生中和抗体[15]。目前,对BCoV S蛋白遗传进化分析的报道较多[6,8-9],但尚无生物信息学分析方面较全面的报道。需研究新疆牛冠状病毒流行株的遗传变异规律。【拟解决的关键问题】从腹泻犊牛粪便中提取BCoV RNA,通过RT-PCR扩增S基因,采用生物信息学方法分析S蛋白结构与功能,并分析遗传进化关系,为病毒-宿主相互作用、S蛋白基因工程疫苗研究奠定基础。
1"材料与方法
1.1"材 料
1.1.1"样 品
新疆巴楚县某牛场腹泻犊牛粪便,干冰运输,-80℃冻存备用。
1.1.2"主要试剂
体液病毒DNA/RNA小量制备试剂盒AP-MN-BF-VNA-250、DNA凝胶回收试剂盒AP-GX-250,购自Axygen;RT-PCR试剂盒购自TaKaRa公司;GeneRuler 1 kb Plus DNA Ladder购自Thermo Fisher。
1.1.3"主要仪器、器皿
Eppendorf低温高速离心机、德国耶拿Biometra PCR仪、美国Bio-Rad核酸电泳系统和凝胶成像系统,锥形瓶、50 mL离心管。
1.1.4"引物设计与合成
以GenBank中BCoV S基因序列(GenBank索引号:KU886219.1)为参考序列,应用Oligo6.0软件,将S基因分为相互重叠的6段,分别设计6对特异性引物,由通用生物(安徽)股份有限公司合成。表1
1.2"方 法
1.2.1"BCoV S基因的扩增
将腹泻犊牛粪便用1∶"PBS稀释5倍,5 000 r/min离心5 min,取上清200 μL,提取病毒RNA,具体方法按体液病毒DNA/RNA小量制备试剂盒说明书操作。以RNA为模板,用RT-PCR试剂盒扩增BCoV S基因的6个片段。采用反转录PCR(RT-PCR)方法扩增S基因,反应条件:50℃ 30 min;94℃ 2 min,预变性;再以94℃ 30 s,54℃ 20 s,72℃ 50 s,30个循环扩增;最后72℃ 10 min,延伸。RT-PCR产物经1%琼脂糖凝胶电泳,DNA凝胶回收试剂盒纯化后,送通用生物(安徽)股份有限公司测序,将测序结果拼接后得到S基因全长序列。
1.2.2"S蛋白理化性质、生物信息学及遗传进化
利用多种在线网站和相关软件对BCoV S蛋白开展理化性质与生物信息学分析。将S基因序列在NCBI中用BLAST搜索同源序列,根据序列一致性分值的排序,依次下载得分高的部分序列,再下载国内外具有代表性的部分序列,运用分子生物学软件Mega 5.0,选择连接近邻法构建系统发生树。表2
2"结果与分析
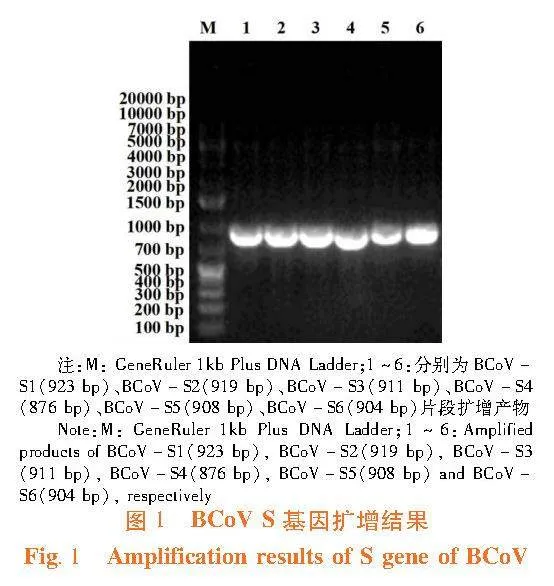
2.1"BCoV S基因扩增
研究表明,获得BCoV S基因的6个片段,每个片段的大小与预期相符。经序列测定和拼接,获得4092 nt的BCoV S基因全长核苷酸序列,已将该序列发布于GenBank(索引号:OR136878.1)。图1
2.2"S蛋白的理化性质
研究表明,S蛋白编码1363 aa,S蛋白分子量为150.67 kDa,分子式为C6745H10311N1729O2038S76,等电点理论值为5.29,负电荷(Asp+Glu)残基总数为112个,正电荷(Arg + Lys + His) 残基总数为89个,脂肪指数:85.30。波长280 nm条件下,在水溶液中的消光系数为197 750 L/(mol·cm)。在体外培养的哺乳动物网织红细胞内半衰期为30 h,在酵母体内半衰期gt;20 h,在大肠埃希氏杆菌体内的半衰期gt;10 h。不稳定系数为33.37,该蛋白属于稳定蛋白。
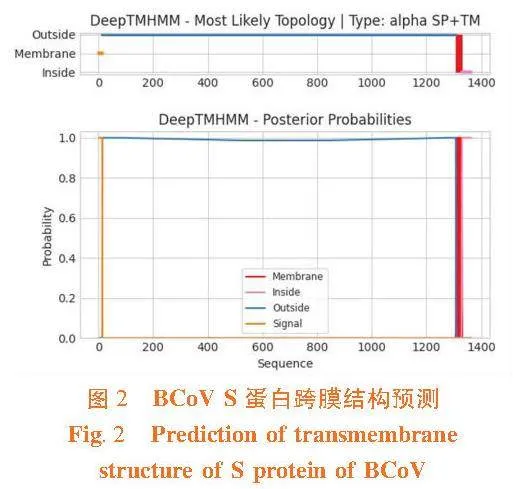
2.3"S蛋白跨膜结构预测
研究表明,S蛋白具有1个跨膜螺旋区,处于W1308~I1328位置,依此确定S蛋白为跨膜蛋白。同时,该蛋白细胞膜外的肽段处于V15~P1307,细胞膜内的肽段处于C1329~D1363。图2"
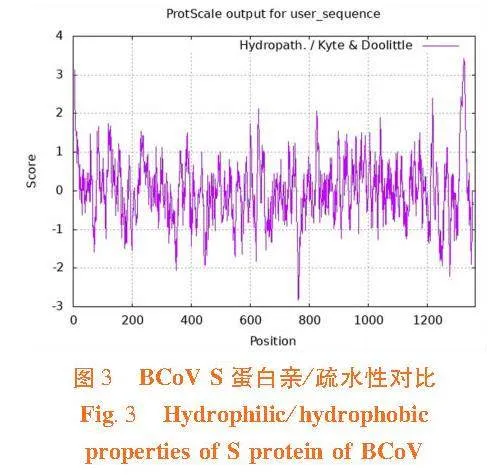
2.4"S蛋白亲/疏水性对比
研究表明,S蛋白亲水性最强的残基是R764,Score=-2.833,而疏水性最强的是F1326,Score=3.411。比较亲水氨基酸与疏水氨基酸的数目,二者相差不大。S蛋白亲水性较弱,疏水性略强。图3
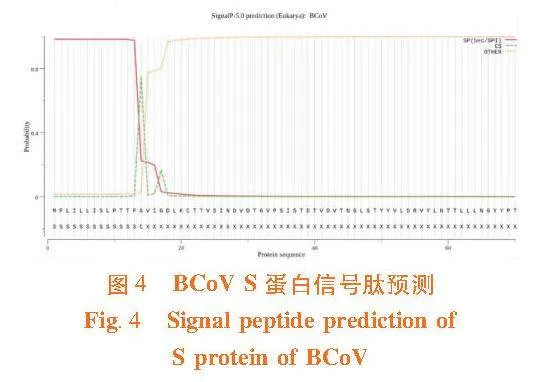
2.5"S蛋白亚细胞定位和信号肽预测
研究表明,内质网膜占44.4%、高尔基体占33.3%、细胞膜占22.2%。S蛋白具有信号肽的概率为0.984 2,远高于阈值0.5,说明该蛋白是分泌型蛋白。此外,信号肽切割位点位于A14和V15之间(TFA-VI),概率为0.752 1。图4
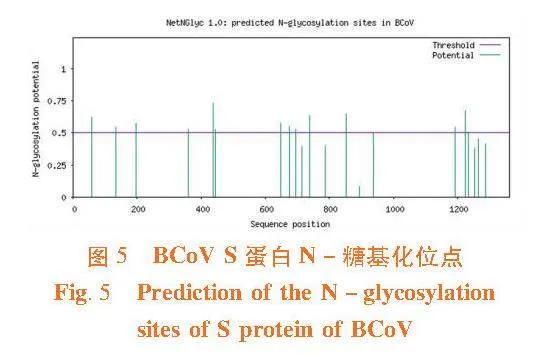
2.6"S蛋白糖基化位点预测
研究表明,采用在线软件对糖基化位点预测,发现S蛋白含有14个潜在的N糖基化位点,其位置分别为59、133、198、359、437、444、649、676、696、739、852、1 194、1 224和1 234。图5
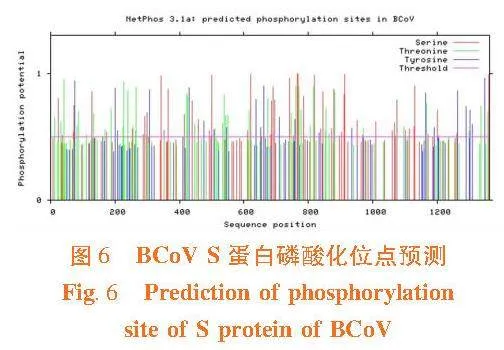
2.7"S蛋白磷酸化位点预测
研究表明,S蛋白共有132个磷酸化位点,各类氨基酸位点所占数量为:丝氨酸(Serine,S)63个,苏氨酸(Threonine,T)46个,酪氨酸(Tyrosine,Y)23个。图6
2.8"S蛋白结构域
研究表明,共有3个保守的功能结构域,分别是N端结构域(N-terminal Domain,NTD)、纤突RBD和S2糖蛋白。NTD位于I16~S292,纤突RBD(S1亚基)位于P326~T540,S2糖蛋白(S2亚基)位于E780~S1360。S蛋白在761~772 aa(序列为:STKRRSRRSITT)区域存在一个低复杂度区域(玫红色位点处)。768~769 aa之间存在一个蛋白酶切割位点。图7
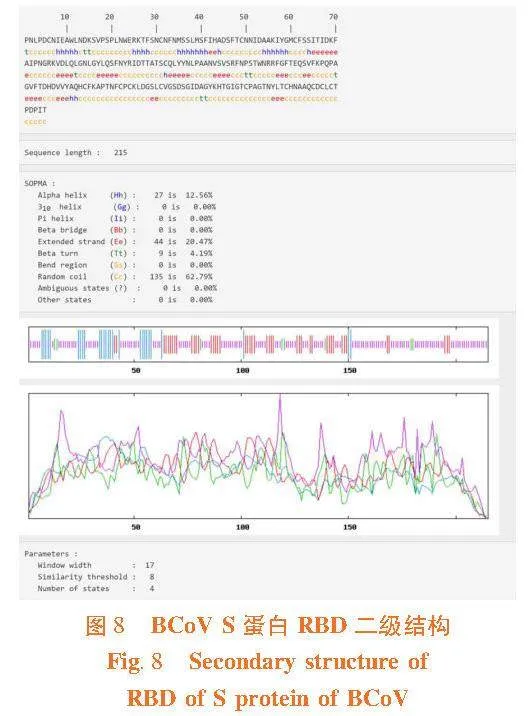
2.9"S蛋白RBD二级结构
研究表明,RBD共有215个aa,其中α-螺旋(α-helix, Hh)27个(12.56%),延伸链(Extended strand, Es)44个(20.47%),β-转角(β-turn, Tt)9个(4.19%),无规则卷曲(Coiled coil, Cc)135个(62.79%)。图8
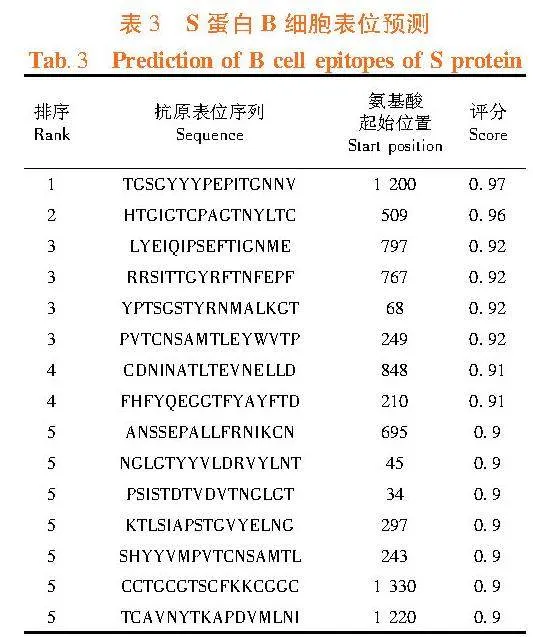
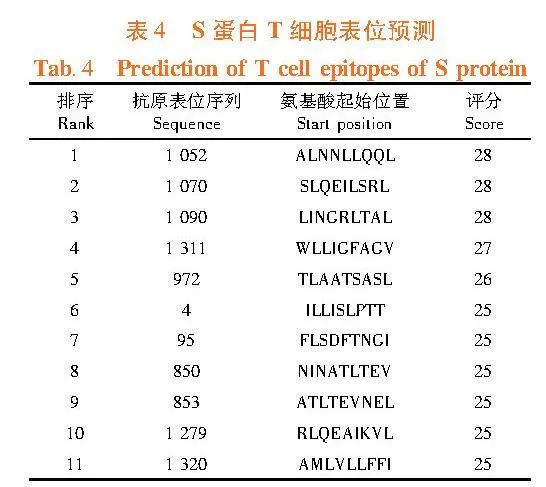
2.10"BCoV S蛋白B细胞和T细胞表位预测
研究表明,采用ABCpred软件预测可能的B细胞表位,Scoregt;0.80的B细胞表位数量为64个,Scoregt;0.90的B细胞表位数量为15个。在SYFPEITHI网站中HLA-A*0201条件下,筛选出11个细胞毒性T细胞(CLT)表位(Score≥25)。表3,表4
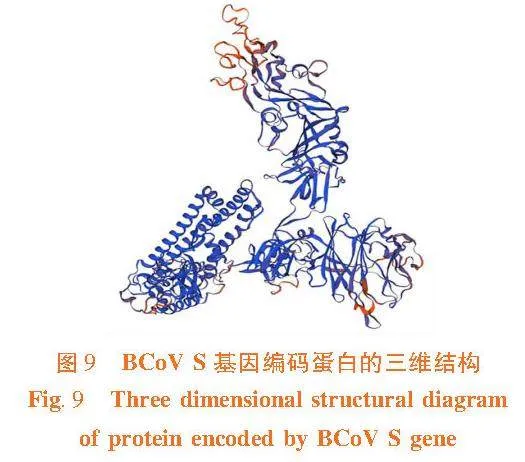
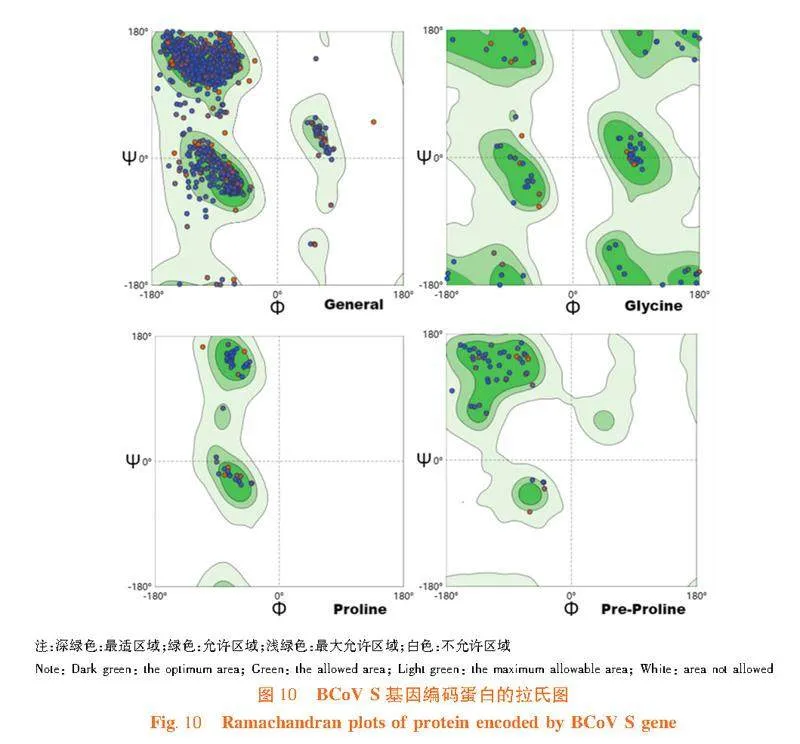
2.11"BCoV S蛋白三级结构同源建模
研究表明,在SWISS-MODEL数据库中选择模板(SMTL ID:7sbw.1.C),对BCoV S蛋白的氨基酸序列同源建模,获得BCoV S蛋白三维结构模型,两者序列一致性为92.00%,模型GMQE值为0.76,QMEAND值为0.82。利用拉氏图评价所建模型,Ramachandran favored值为96.14%,空间构象合理,模型准确可靠。图9,图10
2.12"BCoV S基因系统发生树的构建
研究表明,试验扩增的BCoV S基因序列,与2016年我国新疆南疆的BCV-AKS-01毒株(GenBank索引号:KU886219.1)处于同一小分支。利用DANMAN软件将两者S基因核苷酸序列比对,序列一致性为99.07%。图11,图12
3"讨 论
BCoV在牛群中广泛存在[16-17]。BCoV与新冠病毒(SARS-CoV-2)同属于β冠状病毒属,对SARS-CoV-2研究表明,S蛋白在病毒表面呈三聚体状态排列,对病毒入侵宿主细胞至关重要[20],是疫苗、治疗性抗体和诊断的关键靶点[18-19]。SARS-CoV-2的生物信息学已有报道[20],但未见对BCoV S蛋白生物信息学分析较全面的报道。我国尚无商品化BCoV疫苗,因此,有必要对BCoV S蛋白进行生物信息学分析,为疫苗研发提供参考。
BCoV S蛋白包含2个疏水区:一个位于蛋白质的N端作为分泌信号,另一个位于C端作为膜锚定区[21-22]。研究结果显示,S蛋白亲水性较弱,疏水性略强,推测与上述报道的2个疏水区有关。糖基化和磷酸化修饰是生物体内最重要的翻译后修饰方式。病毒的糖基化过程对病毒蛋白的折叠与稳定、病毒的感染和入侵、宿主细胞受体识别和病毒免疫逃逸等起着重要作用[23]。磷酸化修饰的病毒蛋白参与调控病毒复制、病毒增殖和病毒粒子装配等一系列代谢活动,在调控病毒与宿主的代谢中起着重要作用[24]。研究分析显示,BCoV S有14个潜在的N-糖基化位点,132个磷酸化位点;3类氨基酸在该蛋白中的磷酸化位点数量分别是:S63个、T46个、Y23个。这些位点为S蛋白糖基化和磷酸化的修饰提供了基础。
Parker等[21]认为,病毒感染细胞时BCoV S的初始切割发生在763~769 aa之间的某个位点,其中764~768 aa序列为RRSRR。Abraham S等[15]认为S蛋白在768~769 aa之间裂解为S1和S2两个小亚基。试验中BCoV S蛋白761~772 aa(序列为:STKRRSRRSITT)区域存在一个低复杂度区域(图7中玫红色位点处),其中764~768 aa(序列为:RRSRR)与上述报道相同,因此,推测其切割位点也在768~769 aa之间。BCoV S蛋白主要负责细胞的粘附、血凝、膜融合及诱导中和抗体,S1负责病毒-宿主细胞的识别与结合,S2与病毒-细胞间的融合有关[15]。冠状病毒进入细胞,依赖于病毒粒子表面的S蛋白三聚体与宿主细胞受体之间的特异性相互作用[25]。S1亚基的NTD在病毒附着到宿主细胞表面聚糖时起着关键作用,RBD负责特异性结合宿主蛋白受体;S1的 C端结构域(C-terminal domain,CTD)保持着无活性的“平放”构象,一旦S蛋白三聚体与宿主受体结合,CTD就会扩展为有活性的“直立”构象[18]。与宿主受体结合后,S蛋白三聚体被组织蛋白酶、TMPRRS2或其它蛋白酶切割,病毒与细胞膜融合,病毒进入宿主细胞[25]。上述过程是冠状病毒感染机制的关键步骤,因此,可针对RBD序列设计疫苗靶点,阻止病毒与受体的结合,从而阻止病毒进入宿主细胞。
S蛋白结构复杂,多种二级结构混合存在,为其功能提供了基础。通过表位预测,筛选出S蛋白优势B细胞表位15个,优势T细胞表位11个,可为疫苗靶点的设计提供参考。研究的BCoV S蛋白氨基酸序列,与SWISS-MODEL数据库模板(SMTL ID:7sbw.1.C)同源建模,GMQE值(0.76)和QMEAN值(0.82)较高,序列一致性为92.00%,说明二者相似度较高,经拉氏图评价,表明所建模型准确可靠。从预测图看出,S蛋白由三个单体结合而成。蛋白质序列一级结构的同源性高,相应结构的可靠性也高,这为S蛋白设计和改造提供了较为坚实的结构基础。遗传进化分析显示,研究扩增的序列与2016年我国新疆南疆的BCV-Aks-01毒株处于同一小分支,两者核苷酸序列同源性很高(99.1%),表明在局部地区,BCoV的遗传距离相对较近,毒株之间交叉保护的可能性会较高。
4"结 论
研究的BCoV S基因核苷酸序列与2016年我国新疆BCV-Aks-01株序列在同一分支,亲缘关系最近。S蛋白存在多个抗原表位,推测其免疫原性较强。RBD在病毒进入宿主细胞时具有重要作用,可针对RBD序列设计疫苗靶点,阻止病毒与宿主受体结合。BCoV S蛋白同源建模结果准确可靠。研究采用生物信息学方法,首次全面分析了BCoV S蛋白理化性质、信号肽和亚细胞定位、磷酸化位点、糖基化位点、结构域、抗原表位、三级结构和RBD二级结构等特征,并对S基因进行遗传进化分析。
参考文献"(References)
[1]"Maier G U, Breitenbuecher J, Gomez J P, et al.Vaccination for the prevention of neonatal calf diarrhea in cow-calf operations: a scoping review[J].Veterinary and Animal Science, 2022, 15: 100238.
[2] Woode G N, Bridger J C, Meyling A.Significance of bovine coronavirus infection[J].The Veterinary Record, 1978, 102(1): 15-16.
[3] Benfield D A, Saif L J.Cell culture propagation of a coronavirus isolated from cows with winter dysentery[J].Journal of Clinical Microbiology, 1990, 28(6): 1454-1457.
[4] Geng HL, Meng XZ, Yan WL.et al.Prevalence of bovine coronavirus in cattle in China: A systematic review
and meta-analysis, Microbial Pathogenesis [J].Microb Pathog, 2023, 176:106009.
[5] Saif L J.Bovine respiratory coronavirus[J].The Veterinary Clinics of North America Food Animal Practice, 2010, 26(2): 349-364.
[6] Lotfollahzadeh S, Madadgar O, Reza Mohebbi M, et al.Bovine coronavirus in neonatal calf diarrhoea in Iran[J].Veterinary Medicine and Science, 2020, 6(4): 686-694.
[7] Zhu Q H, Su M J, Li Z J, et al.Epidemiological survey and genetic diversity of bovine coronavirus in Northeast China[J].Virus Research, 2022, 308: 198632.
[8] 寇美玲, 谢佳芮, 杨佳萍, 等.牛冠状病毒的全基因组测序及遗传进化分析[J].动物医学进展, 2022, 43(10): 1-7.
KOU Meiling, XIE Jiarui, YANG Jiaping, et al.Whole genome sequencing and Genetic Evolution Analysis of Bovine Coronavirus[J].Progress in Veterinary Medicine, 2022, 43(10): 1-7.
[9] 张莹钰, 张迎春, 王青青, 等.新疆南疆牛冠状病毒BCV-Aks-01株分离及基因型鉴定[J].中国兽医杂志, 2018, 54(2): 12-14, 18, 2.
ZHANG Yingyu, ZHANG Yingchun, WANG Qingqing, et al.Isolation and genotype identification of bovine coronavirus BCV-aks-01 strain in southern Xinjiang[J].Chinese Journal of Veterinary Medicine, 2018, 54(2): 12-14, 18, 2.
[10] 张坤.新疆北疆地区规模化奶牛场犊牛病毒性腹泻相关病原的调查研究[D].石河子: 石河子大学, 2016.
ZHANG Kun.Investigation of Calves Viral Diarrhea Related Pathogen of Large-scale Dairy Farm in Northern Xin Jiang Region[D].Shihezi: Shihezi University, 2016.
[11] Masters P S.The molecular biology of coronaviruses[J].Advances in Virus Research, 2006, 66: 193-292.
[12] Gunn L, Collins P J, O’Connell M J, et al.Phylogenetic investigation of enteric bovine coronavirus in Ireland reveals partitioning between European and global strains[J].Irish Veterinary Journal, 2015, 68: 31.
[13] Franzo G, Drigo M, Legnardi M, et al.Bovine coronavirus: variability, evolution, and dispersal patterns of a No longer neglected betacoronavirus[J].Viruses, 2020, 12(11): 1285.
[14] Singh S, Singh R, Singh K P, et al.Immunohistochemical and molecular detection of natural cases of bovine rotavirus and coronavirus infection causing enteritis in dairy calves[J].Microbial Pathogenesis, 2020, 138: 103814.
[15] Abraham S, Kienzle T E, Lapps W, et al.Deduced sequence of the bovine coronavirus spike protein and identification of the internal proteolytic cleavage site[J].Virology, 1990, 176(1): 296-301.
[16] Boileau M J, Kapil S.Bovine coronavirus associated syndromes[J].The Veterinary Clinics of North America Food Animal Practice, 2010, 26(1): 123-146.
[17] Toftaker I, Holmy I, Ndtvedt A, et al.A cohort study of the effect of winter dysentery on herd-level milk production[J].Journal of Dairy Science, 2017, 100(8): 6483-6493.
[18] Yoshizawa N, Ishihara R, Omiya D, et al.Application of a photocatalyst as an inactivator of bovine coronavirus[J].Viruses, 2020, 12(12): 1372.
[19] Salem E, Dhanasekaran V, Cassard H, et al.Global transmission, spatial segregation, and recombination determine the long-term evolution and epidemiology of bovine coronaviruses[J].Viruses, 2020, 12(5): 534.
[20] Wrapp D, Wang N S, Corbett K S, et al.Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J].Science, 2020, 367(6483): 1260-1263.
[21] Yuan M, Wu N C, Zhu X Y, et al.A highly conserved cryptic epitope in the receptor binding domains of SARS-CoV-2 and SARS-CoV[J].Science, 2020, 368(6491): 630-633.
[22] 闫静静, 迟晓妍, 卢佳琪, 等.SARS-CoV-2结构蛋白S和N的生物信息学比较分析及应用研究[J].中国病原生物学杂志, 2023, 18(4): 377-384.
YAN Jingjing, CHI Xiaoyan, LU Jiaqi, et al.Comparative bioinformatics analysis of structural proteins s and N of SARS-CoV-2 and their application[J].Journal of Pathogen Biology, 2023, 18(4): 377-384.
[23] Parker M D, Yoo D, Cox G J, et al.Primary structure of the S peplomer gene of bovine coronavirus and surface expression in insect cells[J].The Journal of General Virology, 1990, 71 ( Pt 2): 263-270.
[24] St Cyr-Coats K S, Storz J, Hussain K A, et al.Structural proteins of bovine coronavirus strain L 9: effects of the host cell and trypsin treatment[J].Archives of Virology, 1988, 103(1/2): 35-45.
[25] 向田, 章晓联.病毒与宿主细胞的糖基化修饰及相关功能[J].生物化学与生物物理进展, 2017, 44(10): 898-907.
XIANG Tian, ZHANG Xiaolian.Glycosylation modification and related functions of virus and host cells[J].Progress in Biochemistry and Biophysics, 2017, 44(10): 898-907.
Structure and function analysis of spike protein ""of bovine coronavirus
LU Guili, MIAO Shukui, "WEI Jie, WEI Yurong, MI Xiaoyun, Hailiqiemu Maimaitiyiming
(Xinjiang Key Laboratory of Animal Infectious Diseases/ Institute of Veterinary Medicine, Xinjiang Academy of Animal Sciences, Urumqi 830013, China)
Abstract:【Objective】 ""The purpose of this paper is to grasp the genetic variation patterns of the prevalent strains of bovine coronavirus (BCoV) in Xinjiang, and analyze the characteristics of structural and functional of spike (S) protein.Providing data support for the genetic evolution, structure and function research, vaccine research and development, and targeted drug design of S gene of BCoV.
【Methods】 """The viral genomic RNA was extracted from the feces of BCoV positive calves in a cattle farm in Bachu County, Xinjiang, and the S gene was amplified by RT-PCR.The full length of the S gene was obtained through sequencing and splicing, and after that, the bioinformatics analysis and genetic evolution analysis were carried out.
【Results】 """The BCoV S gene nucleotide sequence (Published on GenBank.Accession number: OR136878.1) was successfully obtained, with a total length of 4 092 nucleotides (nt).The S gene was encoded by 1 363 amino acids (aa).The molecular weight of S protein was 150.67 Ku, and its isoelectric point was 5.29.It had a transmembrane helical region with weak hydrophilicity and slightly stronger hydrophobicity.It has a transmembrane spiral region, with weak hydrophilicity and slightly strong hydrophobicity.S protein was mainly located in the endoplasmic reticulum membrane and golgi apparatus of the host cell, and the probability of signal peptide in N-terminal was 0.9842.The S protein contained 14 potential N-glycosylation sites and 132 phosphorylation sites, and had 3 structural domains, among which the receptor binding domain (RBD) had a total of 215 aa.The proportion of random curls in RBD was the highest (62.79%), followed by extended chains (20.47%) and α-helices (12.56%), the lowest proportion comprised β-turns (4.19%).15 dominant B cell epitopes and 11 T cell epitopes were picked out by software ABCpred and SYFPEITHI.The S protein could be homologously modeled with the template (MTL ID: 7sbw.1.C) in the SWISS-MODEL database, with a sequence identity of 92.00%.The GMQE score of the model was 0.76, and the QMEAND score was 0.82, which indicated a high coincidence rate between them.The Ramachandran favored value of the ramachandran plot is 96.14%, indicating that the spatial conformation was reasonable and the model was accurate and reliable.Evolutionary analysis showed that the BCoV S gene amplified in this experiment was located in the same branch as BCV-AKS-01 strain in southern Xinjiang of China in 2016, and the nucleotide sequence identity of those S gene was 99.07%.
【Conclusion】 """The S protein of BCoV has multiple antigenic epitopes and immunogenicity.RBD plays an important role in the entry of viruses into host cells, and vaccine targets can be designed based on the RBD sequence to prevent the virus from binding to host receptors.The results of homologous modeling of the S protein of BCoV are accurate and reliable.In this study, the physicochemical properties, signal peptides and subcellular localization, phosphorylation sites, glycosylation sites, domains, antigenic epitopes, tertiary structures, and RBD secondary structures of the S protein of BCoV are analyzed using bioinformatics methods.
Key words:""bovine coronavirus; spike protein; bioinformatics analysis
Fund projects:"nbsp;Natural Science Foundation of Xinjiang Uygur Autonomous Region(2021D01A60)
Correspondence author:"""MIAO Shukui(1983- ), male,from Gansu,master, senior experimentalist, research direction:etiology and immunology of animal viruses, (E-mail) 903076760@qq.com
收稿日期(Received):
2024-04-11
基金项目:
新疆维吾尔自治区自然科学基金项目(2021D01A60)
作者简介:
陆桂丽(1977- ),女,江苏人,研究员,博士,研究方向为动物传染病防控,(E-mail)66498744@qq.com
通讯作者:
苗书魁(1983- ),男,甘肃人,正高级实验师,硕士,研究方向为动物病毒病原学及免疫学,(E-mail)903076760@qq.com
