再生障碍性贫血血清IFN-γ、IL-17、EPO、TPO水平的变化
2024-02-21郝文连吴少华徐和福
郝文连,吴少华,景 晔,徐和福,王 莉,胡 艳
(1.中国人民解放军联勤保障部队天津康复疗养中心,天津 300381;2.天津市第一中心医院检验科)
再生障碍性贫血(AA)是多种因素导致的骨髓造血异常性疾病,病理特征为骨髓脂肪化、造血功能降低、全血细胞水平减少,出血基本位于皮肤黏膜且程度较轻,较少患者出现内脏出血,但极易合并感染性疾病,呼吸系统感染为常见合并症,严重影响患者身体健康,但尚无研究分析其具体发病机制[1-2]。有研究提出,机体淋巴因子介导的造血干细胞凋亡及免疫异常均可能会导致骨髓衰竭,造血干细胞被大脂肪细胞取代后仅仅剩余少量小淋巴细胞及纤维黏附颗粒,诱发骨髓造血障碍[3]。有学者提出,一旦机体免疫反应被不同刺激物激活后将会释放一系列因子,进一步阻滞造血干细胞分裂凋亡,加重病情进展[4]。本研究拟分析血清血小板生成素(TPO)、白细胞介素-17(IL-17)、γ-干扰素(IFN-γ)、促红细胞生成素(EPO)在AA早期诊断及预后评估中的应用价值。
1 资料与方法
1.1一般资料:回顾性分析2019年7月~2020年9月在院进行治疗的259例AA患者一般临床资料,将AA患者纳入试验组,选取同期在我院健康体检者81例纳入对照组。其中试验组男132例,女127例;年龄22~75岁,平均(48.56±4.28)岁;病程1~3年,平均病程(1.26±0.25)年。对照组男41例,女40例;年龄23~74岁,平均年龄(48.57±4.21)岁;病程1~3年,平均病程(1.27±0.24)年。两组一般资料差异无统计学意义(P>0.05),具有可比性。纳入标准:①本次研究经过本院医学伦理委员会同意;②均经临床诊断及骨髓病理活检确诊为AA[5];③均符合手术指征。排除标准:①合并先天性心脏病者;②合并严重免疫功能障碍者;③一般临床资料缺乏者。
1.2方法:给予试验组患者Novartis Pharma Schweiz AG公司生产的环孢素软胶囊(H20140291,10 mg)饭后30 min服用,3 mg/(kg·d),2次/d;特一药业集团股份有限公司生产的司坦唑醇片(国药准字H44021119,2 mg),饭后30 min服用,0.1 mg/(kg·d),3次/d。
1.3观察指标:①比较试验组与健康对照组IFN-γ、IL-17、EPO、TPO水平:抽取两组受试者空腹静脉血,离心后取上清液保存待检,采用ELISA法测定IFN-γ、IL-17、EPO、TPO水平。②比较不同分型及不同分类AA患者血清IFN-γ、IL-17、EPO、TPO水平。③抽取治疗前、后试验组患者空腹静脉血,离心后取上清液采用酶联免疫吸附试验(ELISA)测定IFN-γ、IL-17、EPO、TPO水平,并绘制受试者工作特征(ROC)曲线探讨以上指标在AA预后评估中的效能。④分析IFN-γ、IL-17、EPO、TPO水平相关性。
1.4统计学方法:采用SPSS20.0软件进行χ2及t检验。血清IFN-γ、IL-17、EPO、TPO与AA患者预后相关性采用Spearman相关性分析;绘制受试者工作特征(ROC)曲线得到曲线下面积(AUC),以评价IFN-γ、IL-17、EPO、TPO在AA预后中的评估价值,敏感度及特异性均由ROC曲线得到。P<0.05为差异有统计学意义。
2 结果
2.1两组血清IFN-γ、IL-17、EPO、TPO水平比较:试验组IFN-γ、IL-17、EPO、TPO均显著高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组血清IFN-γ、IL-17、EPO、TPO、RORγ1水平比较
2.2试验组不同分型及分类患者血清IFN-γ、IL-17、EPO、TPO水平分析:极重型患者血清IFN-γ、IL-17、EPO、TPO水平均显著高于非重型、重型患者,重型患者血清IFN-γ、IL-17、EPO、TPO水平高于非重型患者,差异均有统计学意义(P<0.05);原发性、继发性两组血清IFN-γ、IL-17、EPO、TPO水平比较差异无统计学意义(P>0.05)。见表2。

表2 试验组不同分型及分类患者血清IFN-γ、IL-17、EPO、TPO水平分析
2.3试验组治疗前后血清IFN-γ、IL-17、EPO、TPO水平比较:治疗后试验组患者血清IFN-γ、IL-17、EPO、TPO水平明显低于治疗前,差异有统计学意义(P<0.05)。见表3。
表3 试验组治疗前后血清各指标水平比较
2.4Th17 Treg细胞表达与血清IFN-γ、IL-17、EPO、TPO水平相关性分析:Spearman相关性分析发现IFN-γ、IL-17、EPO、TPO均与RORγ1呈正相关(P<0.05)。见表4。
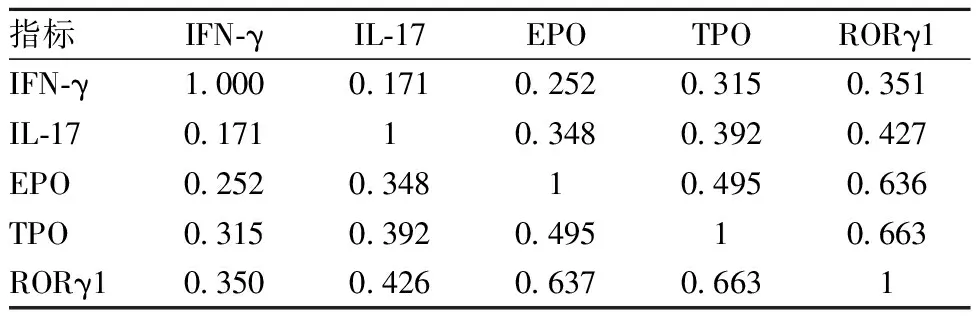
表4 Th17 Treg细胞表达与血清IFN-γ、IL-17、EPO、TPO水平相关性分析(r值)
2.5血清IFN-γ、IL-17、EPO、TPO在预后中的评估价值:血清IFN-γ、IL-17、EPO、TPO在预后评估中均具有一定价值(P<0.05)。见表5。
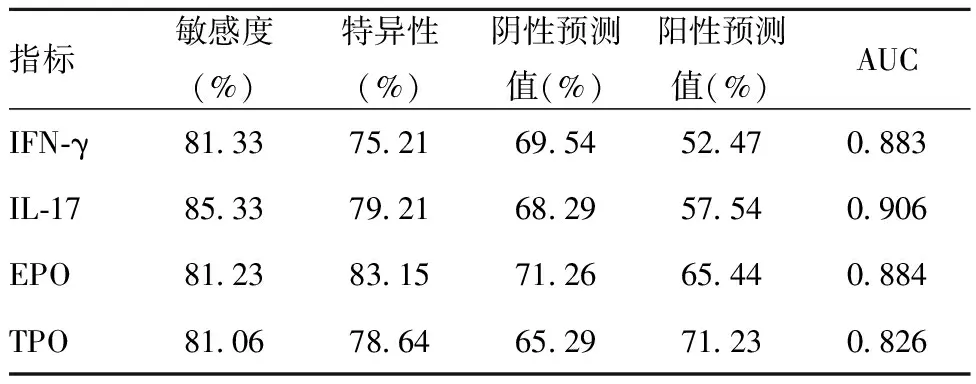
表5 血清IFN-γ、IL-17、EPO、TPO在预后中的评估价值
3 讨论
AA是造血干细胞异常导致骨髓造血功能降低引起的全血细胞减少,同时患者伴随出血、感染、发热等症状,好发于任何年龄阶段,极易继发性出现各种免疫系统疾病,临床对其病理机制尚无统一定论,多认为与骨髓造血环境异常、免疫机制损伤及造血干细胞异常相关[6-9]。
余艳丽等[10]研究中提出,AA患者体内均存在寡克隆扩增的细胞毒T细胞,其分泌的IFN-γ等1型淋巴因子均会明显升高,随后诱导造血干细胞表面的Fas抗原表达,与促凋亡因子发挥协同作用,诱导骨髓造血干细胞凋亡。且IFN-γ的增加则明显破坏了患者骨髓环境,表现为负性调节,最终抑制骨髓造血功能,减少全血细胞,促进AA疾病进展[11-12];IL-17在与受体结合后可促进各类趋化因子及黏附因子合成、释放,进一步导致嗜中性粒细胞大量异常聚集后产生炎性反应,促进疾病进展[13];EPO、TPO是评估骨髓功能状态及幼稚红细胞的相关指标,EPO为重要的造血调控因子,经肾小管周围毛细血管内皮细胞合成,EPO受体可与幼红细胞表面低亲和受体结合,会促进幼红细胞增殖,与高亲和性受体结合后则会促进幼红细胞分化、成熟,EPO为红系造血调控因子,缺氧及贫血均会增加EPO水平[14];TPO在产生后释放进入人血,在循环中保持一定浓度,且TPO可调节血小板生成及骨髓巨核细胞生长,AA患者因骨髓增生不良,导致巨核细胞数量绝对不足,明显减少血小板生成,而被血小板表面吸附的TPO明显减少,导致循环中TPO明显升高[15]。本研究发现临床在AA患者在治疗中可通过监测AA 患者血清IFN-γ、IL-17、EPO、TPO水平变化情况对预后进行评估。调节性T细胞(Treg)是维持机体免疫平衡的重要指标[16],有研究提出,Th17 Treg可能与Th1型细胞一样,产生间接或直接的抑制骨髓造血作用,Th17 Treg细胞可产生IL-17,促进CD4+细胞分化并生成Th17 Treg细胞,聚集大量中性粒细胞发挥生理作用,进一步促进黏附分子及趋化细胞因子的释放及合成,影响AA病理发展[17];Treg细胞可增强机体免疫监视功能,RORγ1为核激素受体中家族成员之一,为Th17细胞分化关键因子,另外IL-17还可在一定程度上诱导炎症因子的表达,介导炎性反应,加重组织损伤[18]。另外,本研究发现IFN-γ、IL-17、EPO、TPO水平变化也会影响AA患者机体免疫功能,进一步影响AA病理进展。
综上所述,IFN-γ、IL-17、EPO、TPO在AA患者血清中呈现明显高表达,且相互影响,共同参与AA的免疫发病。
