昆仑雪菊醇提物对不同模拟体系晚期糖基化终产物生成活性的影响
2024-02-15逄格雨徐硕张子豪张雨晴于少轩
逄格雨,徐硕,张子豪,张雨晴,于少轩
(山东理工大学 农业工程与食品科学学院,山东 淄博 255049)
晚期糖基化终产物(advanced glycation end products, AGEs)是非酶糖基化反应(Maillard反应)的终末产物,是蛋白质、脂质或核酸等大分子在没有酶参与的条件下,与葡萄糖或其他还原性单糖反应所生成的稳定的共价加成物[1]。研究表明[2-3],AGEs与糖尿病及其并发症、心血管疾病、阿尔茨海默症、动脉粥样硬化等多种疾病以及人体衰老密切相关,目前,AGEs已成为影响人类健康的一个慢性风险因素[4]。人体内AGEs的来源包括内源性和外源性两种途径,前者主要是指体内过量的糖和蛋白质反应生成的AGEs;后者是通过进食、吸烟等方式将食物或香烟中的AGEs吸收进入体内。与内源性AGEs相比,外源性AGEs在人体AGEs蓄积池中的占比要高得多[5]。因此,控制食品中AGEs的生成进而减少AGEs的膳食摄入对改善国民的健康状况,提高人们的生活质量,缓解医疗支出费用负担具有重要的社会与经济意义。在保证食品色、香、味的前提下,通过添加外源物质来抑制食品中AGEs生成是目前食品领域备受关注的研究内容之一。多种外源物质如维生素、黄酮、多酚、萜类和不饱和脂肪酸等已经被证明在食品加工过程中对抑制AGEs的生成具有巨大的潜力[6-7]。
昆仑雪菊,学名两色金鸡菊、蛇目菊,为菊科金鸡菊属(Coreopsis)多年生草本植物,在我国新疆和田地区、云南部分地区有一定栽培规模。昆仑雪菊是药食两用性植物,含有多种药理成分,其作为许多保健品的原料,近年来已成为营养学家、药理学家以及养生专家研究的热点。目前,国内外对昆仑雪菊的研究主要集中在黄酮、生物碱、挥发性油、有机酸、氨基酸等成分的分离鉴定和活性评价等方面[8]。虽然从当前研究可以看出昆仑雪菊中的黄酮类活性成分对糖基化反应和氧化反应具有一定的抑制作用[9],但是关于探究昆仑雪菊醇提物抑制食品加工过程中AGEs的生成鲜有报道。因此,本研究分别在40、60、80 ℃ 3个温度条件下对昆仑雪菊超微粉进行醇提,得到3种醇提物(E1、E2和E3)。通过测定三者的总黄酮含量,选取E1为本实验研究对象,然后建立乳糖-酪蛋白和葡萄糖-赖氨酸-亚油酸两种食品模拟体系,探究不同浓度的昆仑雪菊醇提物E1对模拟体系中AGEs生成的影响,以期为开发价格低廉、方便易得的食品级AGEs抑制剂提供参考。
1 材料与方法
1.1 材料与试剂
昆仑雪菊(干花,生产许可证号:QS650114020007),新疆雪菊生物科技有限公司;赖氨酸(纯度为98%),上海麦克林生物有限公司;BCA蛋白浓度测定试剂盒,北京康润诚业生物科技有限公司;3,5-二硝基水杨酸,上海研生生物技术有限公司;2,4-二硝基苯肼,上海诺泰化工有限公司;葡萄糖、α-乳糖、酪蛋白、亚油酸、茚三酮、亚硝酸钠、硝酸铝、氢氧化钠等,均为分析纯,国药集团化学试剂公司。
1.2 仪器与设备
XL-30C实验室超微粉碎机,广州市旭朗机械设备有限公司;UV-1750型紫外-可见分光光度计,岛津国际贸易有限公司;RG-18型磁力搅拌器,巩义市予华仪器有限责任公司;荧光分光光度计,岛津国际贸易有限公司;电热鼓风烘箱DHG-9070A,上海浦东物理光学仪器厂;旋转蒸发仪,上海況胜实业发展有限公司;循环水式真空泵,上海凌科实业发展有限公司。
1.3 昆仑雪菊醇提物的制备
将洗净的昆仑雪菊在40 ℃下烘干至恒重,用小型超微粉碎机粉碎后过200目筛,取10 g过筛的昆仑雪菊粉末,用75%乙醇进行索式提取,溶液分别在40 、60、80 ℃水浴上回流提取,固液比为1∶60,回流30 min。将醇提物在40 ℃、96 kPa条件下旋蒸浓缩后转移到直径为100 mm的玻璃平皿中,在40 ℃烘箱中干燥至恒重,得到昆仑雪菊醇提物E1、E2、E3,4 ℃冰箱密封避光保存备用。测定总黄酮含量时用75%乙醇溶液溶解并稀释至一定体积。
1.4 昆仑雪菊醇提物中总黄酮含量的测定
黄酮类化合物在适当的碱性条件下,与金属铝离子能形成稳定的黄色络合物,在可见光区域有较大的紫外吸收,该研究采用NaNO2-Al (NO3)3-NaOH比色法测定雪菊醇提物中的总黄酮含量。参考杜鹃等[10]的方法并适当加以改动。分别吸取0.3 mg/mL芦丁标准液0.3、0.5、0.7、0.9、1.1、1.3、1.5 mL于25 mL比色管中,用75%的乙醇将标准液稀释至5 mL。加入50 mg/mL的亚硝酸钠溶液2 mL,摇匀,放置6 min,再加入100 mg/mL的硝酸铝溶液2 mL,摇匀,放置 6 min,最后加入1 mol/L的氢氧化钠溶液15 mL,用乙醇定容至刻度,摇匀,放置15 min,于510 nm波长处测定其OD值并绘制出芦丁标准曲线。精确称取10 mg昆仑雪菊醇提物,溶解后按照以上方法测定OD值,按照芦丁标准曲线计算其中的总黄酮含量。平行测定3次取平均值,且根据测定结果选取总黄酮含量最高的醇提物E进行后续实验。
1.5 乳糖-酪蛋白反应体系的构建
参考葛辉[11]的方法并适当加以改动。以pH 6.7,0.2 mol/L磷酸盐缓冲溶液(PBS)配制24 mg/mL的酪蛋白溶液和50 mg/mL的乳糖溶液。以0.125、0.25、0.5 mg/mL不同质量浓度梯度的昆仑雪菊醇提物E1设置实验组,对照和空白组不添加昆仑雪菊醇提物。其他试剂的添加如表1所示。将混合溶液充分混匀后置于不同温度(100 ℃和140 ℃)条件下加热不同时间(4 h和1 h)。
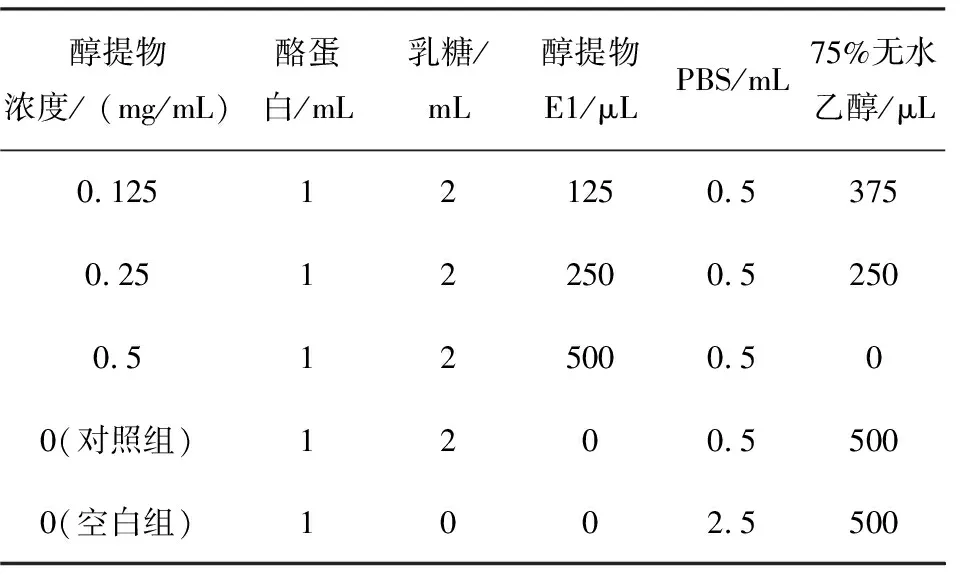
表1 乳糖-酪蛋白反应体系的构建
1.6 葡萄糖-赖氨酸-亚油酸反应体系的构建
参照岳璐[12]的方法并适当加以改动。精确称取2 g赖氨酸(20 mg/mL)和2 g葡萄糖用pH 6.7,0.2 mol/L PBS溶解并定容至100 mL,加入0.8 mL吐温-80,用磁力搅拌器持续搅拌30 min后,加入0.8 mL亚油酸并继续搅拌至溶液澄清,得到葡萄糖-赖氨酸-亚油酸体系。其他试剂的添加如表2所示。将混合溶液充分混匀后置于100 ℃反应条件下加热2 h。
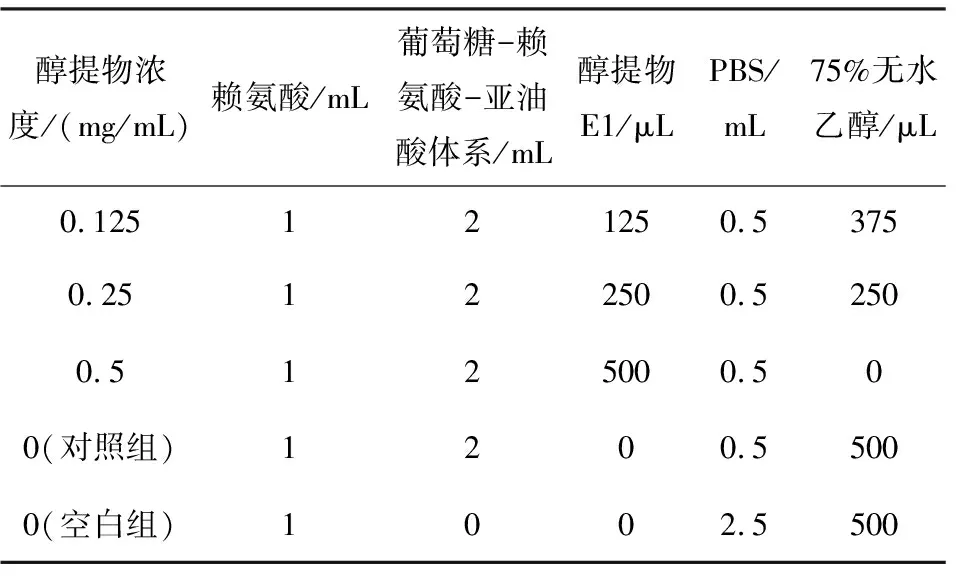
表2 葡萄糖-赖氨酸-亚油酸反应体系的构建
1.7 不同反应体系中荧光性AGEs的测定
该研究反应体系中的荧光性AGEs用荧光分光光度计测定[13-14], 精确吸取各反应体系样液1 mL于离心管中,用去离子水稀释5倍,设定的激发波长λex=345 nm、发射波长λem=420 nm,生成的荧光性AGEs强度用AU表示。昆仑雪菊醇提物对荧光性AGEs形成的抑制率[15]I1为
I1=(F2-F1)/(F2-F3)×100%,
(1)
式中:F2为对照组的荧光强度,F1为雪菊醇提物实验组的荧光强度,F3为空白组的荧光强度。
1.8 不同反应体系中赖氨酸/赖氨酸残基的测定
参考全红丽[16]的方法并适当加以改动。对各反应体系透析蛋白处理后,根据BCA蛋白浓度测定试剂盒操作说明,配制工作液并于波长562 nm处测定OD值,得到蛋白标准曲线。分别取2 mL各反应体系样液于离心管中对蛋白质定量后加入2 mL茚三酮试剂,充分混匀,80 ℃下水浴30 min,然后冷却至室温后用PBS定容至10 mL,摇匀,在562 nm处测定其OD值。以空白组中的赖氨酸/赖氨酸残基含量为1,实验组和对照组的赖氨酸/赖氨酸残基相对含量C为
C=A/A°×100%,
(2)
式中:A表示对照组或不同浓度雪菊醇提物实验组的吸光度,A°表示空白组的吸光度。
1.9 反应体系中酪蛋白羰基化程度的测定
参考段丽菊等[17]的方法并适当加以改动。选取乳糖-酪蛋白体系140 ℃反应1 h的各反应体系,对蛋白质定量后,取100 μL样液与400 μL、10 mmol/L 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)溶液充分混合后在室温下暗处孵育1 h,每隔10 min漩涡1次。反应完毕后,向混合溶液中加入500 μL、0.2 g/mL的三氯乙酸(TCA),在4 ℃下,以12 000g的转速离心15 min,弃上清。得到的沉淀用1 mL乙醇和乙酸乙酯混合物洗涤3次,后用1.25 mL、6 mol/L的盐酸胍在37 ℃条件下水浴15 min,使其溶解并以12 000g的转速离心15 min,取上清,在波长370 nm处测定其OD值。乳糖-酪蛋白反应体系中酪蛋白羰基化程度抑制率I2为
I2=(A2-A1)/(A2-A3)×100%,
(3)
式中:A2表示370 nm处对照组的吸光度,A1表示370 nm处雪菊醇提物实验组的吸光度,A3表示370 nm处空白组的吸光度。
1.10 反应体系中葡萄糖余量的测定
参考赵凯等[18]的方法并适当加以改动。将葡萄糖标准溶液由1 mg/mL稀释为0.5 g/L,吸取标准溶液5次,分别为0.2、0.4、0.6、0.8、1.0 mL,并逐一补水至1 mL,加入3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)试剂1.5 mL,摇匀,在波长550 nm处测定OD值,并绘制出葡萄糖标准曲线。取各反应体系样液1 mL,加入DNS试剂1.5 mL,其他操作与上述方法相同,并通过葡萄糖标准曲线计算出葡萄糖-赖氨酸-亚油酸各反应体系中的葡萄糖余量。
1.11 数据处理
本论文中所有试验重复3次,数据均用Origin作图,结果用均数±标准差(x±s)表示。使用SPSS 16.0进行统计分析,组间差异显著性分析采用方差分析,当P<0.05时认为差异显著。
2 结果与分析
2.1 昆仑雪菊醇提物中总黄酮含量
以吸光度y为纵坐标、浓度x为横坐标绘制出芦丁标准曲线(图1),通过线性拟合得到R2为0.999 7的标准曲线方程:y=27.67x+0.017 6。据此计算出不同温度条件下得到的昆仑雪菊醇提物E1、E2和E3中总黄酮含量(以芦丁当量表示)分别为0.438、0.416、0.384 mg/mL。由图2可以看出,E1中总黄酮含量最高,因此本研究选取了醇提物E1作为研究对象进行后续实验。徐莹等[19]报道过类似的结果,其发现提取温度超过55 ℃时,黄酮类化学物的结构遭到破坏,导致提取量降低。
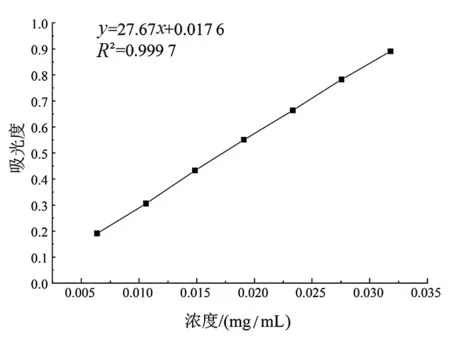
图1 芦丁标准曲线

注:a~c不同字母表示具有显著性差异(P<0.05)。图2 昆仑雪菊醇提物中总黄酮含量
2.2 昆仑雪菊醇提物E1对酪蛋白-乳糖体系中AGEs生成的影响
2.2.1 不同热处理条件下E1对酪蛋白-乳糖体系中荧光性AGEs生成的抑制作用
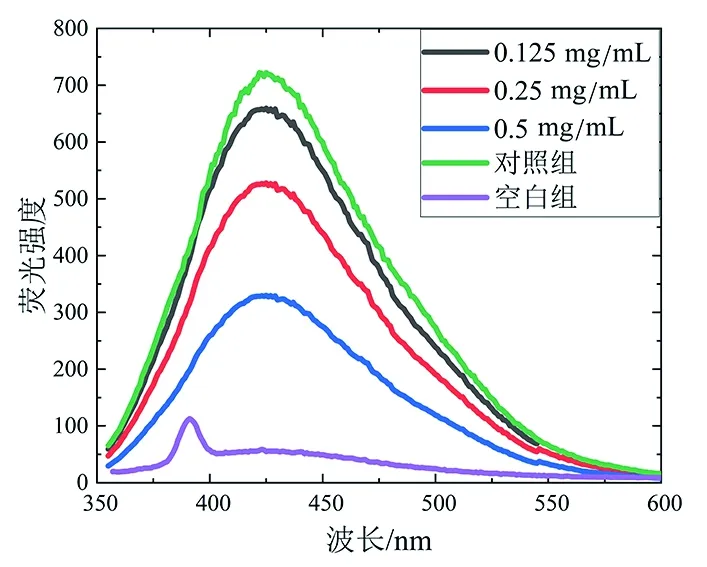
目前已被发现的AGEs有近40种,根据其是否具有特征性荧光,可以分为荧光性AGEs和非荧光性AGEs两大类[20]。其中,荧光性AGEs因具有检测方便、灵敏度高等特点而被大量研究作为目标物进行检测分析,间接反映体系中AGEs的总量。由图3(a)可以看出,与酪蛋白相比,酪蛋白-乳糖体系在100 ℃加热4 h后,其荧光光谱在420 nm处有一个显著的荧光发射峰。但是,添加了不同浓度的昆仑雪菊醇提物E1后,该荧光发射峰的荧光强度逐渐降低。由图3(b)可知,0.125、0.25、0.5 mg/mL醇提物E1对荧光性AGEs的抑制率分别为9.89%、21.44%、55.73%。因此,昆仑雪菊醇提物E1能够抑制酪蛋白-乳糖体系中荧光性AGEs的生成,且具有明显的浓度依赖性,这与夏秋琴[21]的研究结果有相同趋势,其发现在温度为100 ℃的酪蛋白-乳糖反应体系中,随着染料木黄酮添加量的增加,抑制荧光性AGEs产生的量逐渐增强。由图3(c)和图3(d)可知,在此前的基础上提高温度并缩短反应时间,昆仑雪菊醇提物E1在140 ℃加热1 h的条件下也能够抑制荧光性AGEs的生成,此时,0.125、0.25、0.5 mg/mL醇提物E1对荧光性AGEs的抑制率分别为14.30%、55.51%、70.44%,表明昆仑雪菊醇提物E1在该加热条件下对荧光性AGEs的抑制效果更强一些。
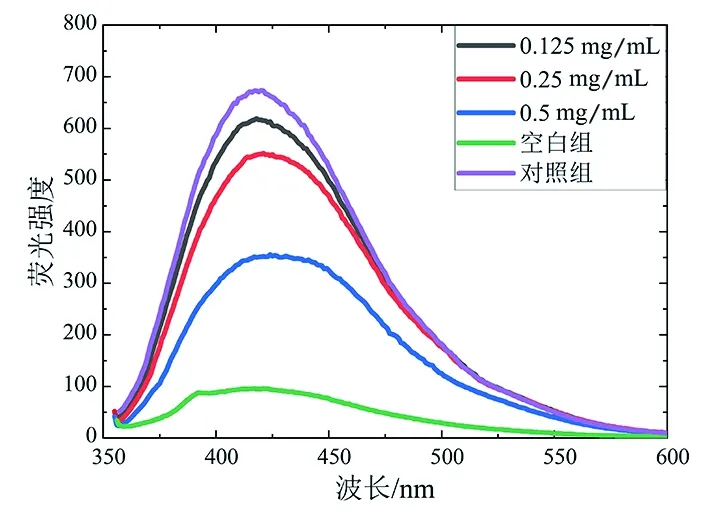
(a)100 ℃加热4 h的荧光光谱
2.2.2 E1对赖氨酸/赖氨酸残基的保护能力
赖氨酸是发生糖基化反应形成复杂的AGEs的主要氨基酸,游离赖氨酸含量能够反映反应体系的糖基化程度,赖氨酸含量越高,认为糖基化程度越低[22]。对照组因发生非酶糖基化反应,其所含赖氨酸相对含量为0.583%,随着反应体系中E1浓度从0.125 mg/mL上升到0.5 mg/mL,赖氨酸的相对含量由0.608%增加到0.927%(图4),说明随反应体系中醇提物E1浓度的逐渐升高,非酶糖基化反应进行的程度逐渐降低,E1对乳糖-酪蛋白反应体系中AGEs生成的抑制作用逐渐增强。张宇臣等[23]有过类似发现,即不同浓度的褐藻多酚可以有效提高牛血清蛋白与葡萄糖体外模拟体系中赖氨酸与葡萄糖的含量。
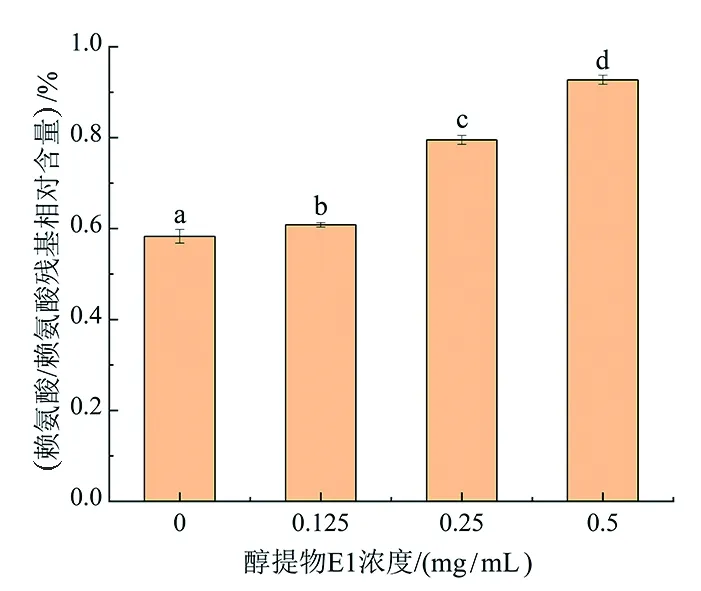
注:a~d不同字母表示具有显著性差异(P <0.05)。图4 E1对酪蛋白-乳糖体系中赖氨酸/赖氨酸残基保护能力对比图
2.2.3 E1对酪蛋白羰基化程度抑制率
蛋白质羰基化是在氧化损伤过程中表现出的蛋白质结构与功能不可逆的损伤[24],通过测定反应体系中酪蛋白羰基化程度可以判断美拉德反应进行的程度。如图5所示,添加3种不同浓度雪菊醇提物E1的反应体系中,酪蛋白羰基化程度抑制率从36.40%迅速上升到64.37%,且三者之间存在明显的显著性差异(P<0.05),表明昆仑雪菊醇提物E1能够抑制乳糖-酪蛋白体系中酪蛋白羰基化程度,具有明显的浓度依赖性。
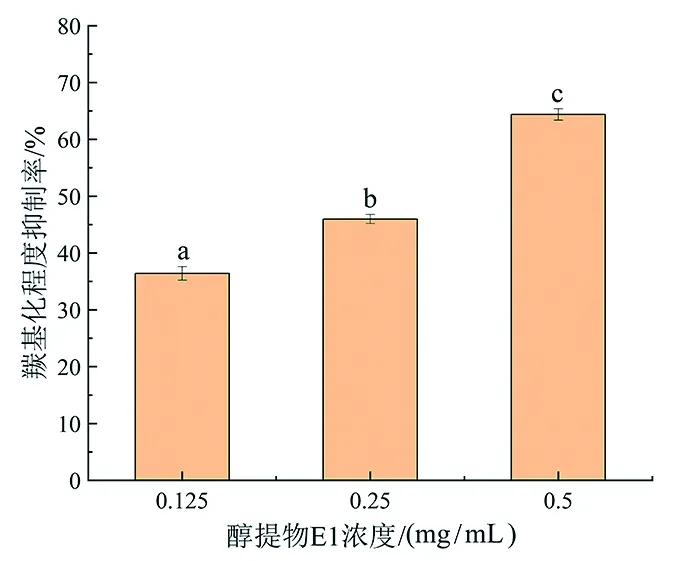
注:a~c不同字母表示具有显著性差异(P<0.05)。图5 E1对酪蛋白羰基化程度抑制率对比图
2.3 昆仑雪菊醇提物E1对葡萄糖-赖氨酸-亚油酸体系中AGEs生成的影响
2.3.1 不同热处理条件下E1对葡萄糖-赖氨酸-亚油酸体系中荧光性AGEs生成的抑制作用
由图6(a)可知,与酪蛋白-乳糖反应体系相似,100 ℃反应4 h后,该体系荧光光谱在420 nm处同样有一个非常明显的荧光发射峰。与对照组相比,添加醇提物E1的各反应体系荧光强度随着E1浓度的升高而逐渐降低。由图6(b)可知,添加浓度为0.5 mg/mL醇提物E1的实验组,抑制效果最为明显,抑制率达到58.25%。夏秋琴[21]得到过类似结果,其发现在赖氨酸-核糖体系中,随着抑制剂染料木黄酮浓度的不断增加,其对荧光性AGEs的抑制效果逐渐增强。
(a)荧光光谱
2.3.2 E1对赖氨酸/赖氨酸残基的保护能力
为进一步研究昆仑雪菊醇提物E1对AGEs生成的抑制作用,本研究测定了不同反应体系中赖氨酸的含量变化并进行比较分析。2.2.2中提到,赖氨酸为非酶糖基化反应的底物,对照组赖氨酸相对含量为0.586%,处于比较低的水平,添加0.125、0.25、0.5 mg/mL醇提物E1的反应体系中,赖氨酸的相对含量分别升高至0.691%,0.754%、0.892%(图7),均高于对照组,且四者之间具有显著性差异,表明E1对赖氨酸的保护效果较好。
2.3.3 E1对葡萄糖余量的影响
通过线性拟合得到R2为0.999的标准曲线方程:y=0.667x-0.066 2,据此计算出空白组的葡萄糖余量为4.81 mg/mL,反应体系中添加0.125、0.25、0.5 mg/mL E1时,体系中葡萄糖余量分别为4.51、4.03、3.55 mg/mL。葡萄糖余量最高的是添加E1的反应组,与2.1的实验结果相互印证,说明葡萄糖余量最高的实验组中添加的雪菊醇提物E中总黄酮含量最高。
3 结论
1)昆仑雪菊醇提物对AGEs的生成具有显著的抑制作用。热处理温度分别为100 ℃和140 ℃时,0.5 mg/mL雪菊醇提物E1对乳糖-酪蛋白和葡萄糖-赖氨酸-亚油酸反应体系中AGEs的抑制率分别可达70.44%和58.25%。
2)两反应体系中的赖氨酸/赖氨酸残基相对含量、酪蛋白羰基化抑制率以及葡萄糖余量均有很大程度提高。昆仑雪菊醇提物可能与赖氨酸残基反应抑制蛋白质的糖基化,从而降低AGEs的生成。
3)本研究探讨了昆仑雪菊醇提物在抗氧化、抗糖基化方面的食用价值,并将其应用到抑制AGEs生成的研究中,为AGEs抑制剂的研究提供了一定的数据参考。
