载脂蛋白C1 表达对人肝癌HepG2 细胞增殖和凋亡的影响及其机制
2024-02-12宋慧娟徐振华何东宁
宋慧娟, 徐振华, 何东宁
(1. 锦州医科大学生命科学研究院,辽宁 锦州 121000;2. 联勤保障部队三亚康复疗养中心检验病理科,海南 三亚 572000;3. 锦州医科大学附属第三医院肿瘤科,辽宁 锦州 121000)
载脂蛋白C1(apolipoprotein C1,APOC1)是最小的载脂蛋白(apolipoprotein,APO),相对分子质量6 600,APOC1 与癌症的发生发展有关联。前列腺癌组织中APOC1 的表达明显高于正常前列腺组织,沉默APOC1 可抑制前列腺癌细胞的增殖和克隆形成,阻止细胞周期进展,促进癌细胞凋亡[3];胃癌患者血清中APOC1 水平明显高于对照组,APOC1 蛋白在胃癌组织中的表达水平明显高于癌旁组织和正常组织,而且APOC1 表达水平升高与患者总生存率降低有关联[4-5];APOC1 表达水平降低可抑制食管癌的进展,并与患者预后和免疫微环境有关联[6-7]。研究[8-10]显示:结直肠癌、乳头状甲状腺癌和儿童肾母细胞瘤患者血清中APOC1 水平明显降低。但目前对肝癌中APOC1 作用的研究较少,其在肝癌中的作用尚不明确,调控肝癌进展的分子机制也尚未见报道。本研究拟通过生物信息学方法分析APOC1 在肝癌组织中的表达,并分析其与肝癌患者预后的关系,进一步在APOC1 低表达的HepG2 细胞中过表达APOC1,通过检测细胞增殖率、凋亡率及细胞中与增殖和凋亡相关蛋白的表达,探讨APOC1 对肝癌HepG2 细胞的影响,并初步阐明其作用机制,以期为肝癌的临床治疗提供新的靶点。
1 材料与方法
1.1 数据库分析临床肝癌患者样本来自癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)肝细胞癌(liver hepatocellular carcinoma, LIHC) 项目中level 3 HTSeq-FPKM 格式的RNAseq 数据。将FPKM 格式的RNAseq 数据进行Log2转化,保留50 例配对样本[11-12]。
1.2 细胞、主要试剂和仪器肝癌HepG2、PLC5和Huh7 细胞(中国科学院上海细胞库),人高转移肝癌HCCLM3 细胞和人胚胎肾HEK293T 细胞(中国医科大学染色质教研室惠赠)。过表达质粒pcDNA3.1-APOC1(长沙优宝生物科技有限公司构建),jetPRIME 转染试剂 (北京达科为生物技术有限公司),TRIzol 试剂、反转录试剂盒、ChamQ Universal SYBR 实时定量试剂盒和TUNEL BrightGreen 凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司),CellTiter96®Aqueous One Solution 细胞增殖检测试剂盒(美国Promega公司),5-乙炔基-2'-脱氧尿嘧啶核苷(5-ethynyl-2'-deoxyuridine,EdU) -488 细胞增殖检测试剂盒(上海雅酶生物医药科技有限公司),Annexin ⅤFITC/7-AAD 凋亡检测试剂盒(苏州四正柏生物科技有限公司), 细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、磷酸化ERK (phosphorylated ERK,p-ERK)、蛋白激酶B (protein kinase B, AKT)、 磷酸化AKT(phosphorylated AKT,p-AKT)、B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2) 和活化型含半胱氨酸的天冬氨酸蛋白水解酶3 (cleaved cysteinyl aspartate specific proteinase-3, cleaved caspase-3)抗体(美国Cell Signaling Technology 公司)。Transwell 小室(膜孔径8μm,美国Corning 公司),实时荧光定量 PCR (real-time fluorescence quantitative PCR,RT-qPCR) 仪(美国ABI 公司),凝胶成像仪(美国Bio-Rad 公司)。
1.3 RT-qPCR 法检测不同肝癌细胞中APOC1 mRNA 表达水平采用 TRIzol 试剂由细胞中分离总 RNA,采用反转录试剂盒进行逆转录,使用ChamQ Universal SYBR 实 时 定 量 试 剂 在QuantStudio 3 仪器上进行RT-qPCR 检测,采用2-△△Ct法计算不同细胞中APOC1 mRNA 表达水平。引物序列:APOC1,上游引物5'-TCCTGGTGGTGGTTCTGTCGATC-3',下游引物5'-TTTGATGCGGCTGATGAGTTCCC-3'; 18S, 上游 引物5'-TTGACGGAAGGGCACCACCAG-3',下游引物5'-GCACCACCACCCACGGAATC-3'。引物由深圳华大基因科技有限公司合成。
1.4 细胞培养、转染和分组细胞在含有10% 胎牛血清的DMEM 培养基中,置于 37 ℃、5% CO2培养箱中孵育。肝癌HepG2 细胞分为APOC1 过表达组(转染pcDNA3.1-APOC1 质粒) 和对照组(转染pcDNA3.1 质粒)。转染按照jetPRIME 转染试剂说明书进行操作:HepG2 细胞采用胰酶消化后接种于6 孔细胞培养板中,当细胞密度达到约80%时进行转染,24 h 后收集细胞进行RT-qPCR检测,48 h 后收集细胞进行Western blotting 检测。
1.5 MTS 法检测2 组细胞增殖活性转染后将2 组细胞以每孔 2×103个细胞的密度接种于96 孔细胞培养板中,每组设3 个复孔,于培养不同时间点进行细胞增殖实验, 具体步骤按照CellTiter96®Aqueous One Solution 细胞增殖检测试剂盒说明书进行。采用酶标仪检测490 nm 波长处每孔吸光度(A)值,并以0 d 平均A 值进行均一化处理后采用GraphPad Prism 7.0 软件绘制增殖曲线,以相对A 值代表细胞增殖活性。
1.6 EdU 染色法检测2 组细胞增殖率转染后取对数生长期细胞接种于共聚焦培养皿中,每孔2×104个细胞,培养24 h 后按照试剂说明书进行EdU 标记、细胞固定、染色和荧光检测。采用Image J 软件分析荧光强度,计算细胞增殖率。细胞增殖率=EdU 荧光强度/DAPI 荧光强度×100%。
1.7 Transwell 小室实验检测2 组细胞中迁移细胞数转染后将2 组细胞用无血清培养基以每孔5×104个细胞(100 μL)的密度接种于24 孔Transwell培养板的上层小室内,下层小室内加入600 μL 含10%血清的培养基,培养24 h 后,取出上层小室,弃培养基,用干净棉签轻轻擦拭上层小室内表面,上层小室外表面为迁移细胞,用0.1%结晶紫染色后倒置显微镜下观察并拍照,计数各自上层小室外穿膜细胞数,即迁移细胞数,代表细胞迁移能力。
研究者根据不同应用模式和技术提出了多种移动学习定义。郭绍青[3]教授认为移动学习是指学习者利用无线移动通信网络技术以及无线移动通信设备获取教育信息、教育资源和教育服务,并在适当的情境下通过移动技术实现教与学的丰富交互,随时随地进行的数字化学习形式,明确了移动学习的便捷、互动、数字化、情境化、及时性等特征。
1.8 流式细胞术检测2 组不同细胞周期细胞百分率和凋亡率取对数生长期2 组HepG2 细胞接种于6 孔细胞培养板中,37 ℃、5% CO2孵箱中培养过夜后进行转染,转染后48 h 收集细胞,用不含EDTA 的胰酶进行消化,离心后沉淀细胞。细胞周期检测:加入1 mL 70%冰预冷的乙醇,混匀后4 ℃固定过夜;次日,离心收集细胞,PBS 缓冲液洗涤2 次,加入500 μL PI 染液室温避光孵育15 min 后上机检测2 组不同细胞周期细胞百分率。细胞凋亡率检测:加入100 μL 结合缓冲液重悬细胞,加入5 μL Annexin V FITC 和5 μL 7-AAD 避光孵育30 min 后加入400 μL 结合缓冲液混匀,上机检测2 组细胞凋亡率。
1.9 TUNEL 法检测2 组细胞凋亡情况将盖玻片无水乙醇浸泡过夜后铺入6 孔细胞培养板中,接种1×105个HepG2 细胞,达到对数生长期进行转染。转染48 h 后,取出孔板进行TUNEL 实验,具体步骤按照TUNEL BrightGreen 凋亡检测试剂盒进行。共聚焦激光扫描显微镜下于488 nm 波长处观察绿色荧光,于405 nm 波长处观察蓝色荧光,细胞核中见绿色荧光的细胞代表凋亡细胞。
1.10 Western blotting 法检测2 组细胞中增殖和凋亡相关蛋白表达水平2 组HepG2 细胞转染48 h后用RIPA 裂解缓冲液提取细胞总蛋白,定量后进行8% SDS-PAGE 电泳,转膜,1% BSA 封闭1 h后加入一抗4 ℃孵育过夜,次日加入 HRP 标记二抗,室温孵育 1 h,ECL 显影。采用 Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值 ×100%。
1.11 统计学分析采用Graphpad Prism 7.0 统计软件进行统计学分析。2 组细胞中APOC1 mRNA表达水平、细胞增殖活性、迁移细胞数、不同细胞周期细胞百分率、细胞凋亡率、细胞中增殖和凋亡相关蛋白表达水平均符合正态分布,以表示,2 组间样本均数比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 APOC1 在肝癌患者癌组织中的表达水平及其与患者预后的相关性TCGA 数据库分析结果显示:肝癌患者癌组织中APOC1 mRNA 表达水平明显低于正常肝组织,2 组差值中位数为-0.347(-0.736~-0.017),组间比较差异有统计学意义(P=0.042)。预后分析结果表明:APOC1 高表达组和低表达组肝癌患者生存时间比较差异有统计学意义(P=0.004),APOC1 高表达组肝癌患者预后更好。见图1。

图1 肝癌患者癌组织和正常肝组织中APOC1 mRNA表达水平(A)及其与肝癌患者预后的相关性(B)Fig. 1 Expression levels of APOC1 mRNA in cancer tissue and normal liver tissue of liver cancer patients(A)and its correlation with prognosis of liver cancer patients(B)
2.2 不同肝癌细胞和转染后2 组HepG2 细胞中APOC1 mRNA 表达水平HEK293T 细胞和不同肝癌细胞中均有APOC1 mRNA 表达, 与HEK293T 细胞比较,不同肝癌细胞中APOC1 mRNA 表达水平均降低(P<0.05),HepG2 细胞中APOC1 mRNA 表达水平最低。见图2。与对照组(1.04±0.37) 比较,APOC1 过表达组细胞中APOC1 mRNA 表达水平(110.17±8.41)明显升高(P<0.01)。

图2 不同肝癌细胞中 APOC1 mRNA 表达水平Fig. 2 Expression levels of APOC1 mRNA in different liver cancer cells
2.3 2 组细胞增殖活性、增殖率和迁移细胞数MTS 法检测结果显示:与对照组(1.78±0.07)比较,APOC1 过表达组细胞增殖活性(1.30±0.03)明显降低(P<0.01)。EdU 染色结果显示:与对照组(81.83%±8.72%)比较,APOC1 过表达组细胞增殖率(43.58%±17.02%) 明显降低(P<0.05)。见图3。Transwell 小室实验结果显示:与对照组(509.7 个±83.2 个) 比较,APOC1 过表达组细胞中迁移细胞数(191.7 个±34.5 个)明显减少(P<0.01)。见图4。
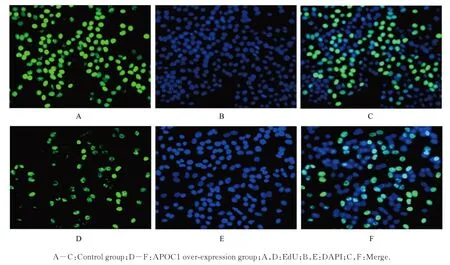
图3 EdU 染色法检测2 组细胞增殖情况(×100)Fig. 3 Proliferation of cells in two groups detected by EdU staining(×100)
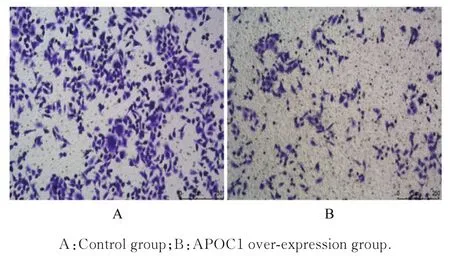
图4 Transwell 小室实验检测2 组细胞迁移情况(结晶紫,×100)Fig. 4 Migration of cells in two groups detected by Transwell chamber assay(Crystal violet,×100)
2.4 2 组不同细胞周期细胞百分率、细胞凋亡率和凋亡情况与对照组(26.26%±2.06%和5.80%±1.37%)比较,APOC1过表达组细胞中S期细胞百分率(37.40±1.96%)和细胞凋亡率(20.20%±1.41%) 明显升高(P<0.01)。见图5。TUNEL法检测结果显示:与对照组比较,APOC1 过表达组细胞中凋亡细胞数明显增多。见图6。

图5 流式细胞术检测2 组不同细胞周期细胞百分率和凋亡率Fig. 6 Percentages of cells at different cell cycles and apoptotic rates of cells in two groups detected by flow cytometry

图6 TUNEL 法检测2 组细胞凋亡情况(×400)Fig. 6 Apoptosis of cells in two groups detected by TUNEL method(×400)
2.5 2 组细胞中增殖和凋亡相关蛋白表达水平与对照组比较,APOC1 过表达组细胞中p-ERK、p-AKT 和Bcl-2 蛋白表达水平明显降低(P<0.05),ERK 和AKT 蛋白表达水平差异无统计学意义(P>0.05),cleaved caspase-3 蛋白表达水平明显升高(P<0.01)。见图7。

图7 Western blotting 法检测2 组细胞中增殖和凋亡相关蛋白表达电泳图(A)及直条图(B)Fig. 7 Electrophoregram (A) and histogram (B) of expressions of proliferation and apoptosis related proteins in cells in two groups detected by Western blotting method
3 讨 论
我国肝炎发病率较高,故原发性肝癌严重威胁着人们的生命健康。目前肝癌早期治疗困难,预后不良,因此发现与原发性肝癌发生发展和预后相关的潜在生物标志物,探索其可能涉及的分子机制,对肝癌的治疗具有重要意义。
APO 家族异常可以导致肿瘤细胞增殖和侵袭能力改变[13-15]。APOC1 是富含甘油三酯的脂蛋白和高密度脂蛋白的组成部分。近期研究[4,16]表明:APOC1 与癌症的发生发展有关,包括胃癌和肺癌等。但目前APOC1 在肝癌中的差异表达、与肝癌患者预后的关系及可能的分子机制尚未见系统性研究。本研究通过TCGA 数据库分析结果显示:APOC1 在肝癌组织中表达水平降低,并且APOC1高表达组肝癌患者生存期较低表达组患者延长,表明AOPC1 可能是肝癌的重要分子标志物和预后因子。本研究结果显示:与对照组比较,过表达APOC1 后可抑制HepG2 细胞的增殖和迁移能力,并且S 期细胞百分率和细胞凋亡率明显升高,表明APOC1 高表达可导致细胞周期S 期阻滞,并诱导细胞凋亡。
研究[17-20]显示:ERK/AKT 信号通路涉及多个复杂的生物学过程,如细胞增殖、迁移、侵袭和抗凋亡等。为了明确 APOC1 是否通过调节ERK/AKT 信号通路活性影响肝癌的进展,本文作者检测HepG2 细胞中ERK/AKT 信号通路相关蛋白表达水平,结果显示:APOC1 过表达组细胞中增殖相关蛋白p-ERK 和p-AKT 表达水平明显降低,凋亡相关蛋白Bcl-2 表达水平明显降低,cleaved caspase-3 表达水平明显升高,表明APOC1 可能通过ERK/AKT 信号通路的失活来抑制肝癌细胞的增殖和侵袭[21-22],抑制 ERK/AKT 信号通路可降低抗凋亡和增殖相关蛋白的表达,进而促进肝细胞凋亡并抑制其迁移。
综上所述,APOC1 上调能够通过抑制ERK/AKT 信号通路进而抑制肝癌HepG2 细胞增殖和迁移,并诱导细胞凋亡,APOC1 可能是肝癌治疗的潜在靶点。本研究结果为肝癌的靶向治疗提供了理论依据,但关于APOC1 的临床价值还有待进一步研究。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
宋慧娟参与实验操作和论文撰写,徐振华参与数据库分析和统计学分析,何东宁参与实验设计和论文修改。
