桔梗元参汤对过敏性哮喘小鼠气道炎症和黏液分泌的影响及其机制
2024-02-12唐红梅李月蛟王志彬袁谢芳王孝芸
唐红梅, 李月蛟, 王 星, 王志彬, 袁谢芳, 王孝芸
(西南医科大学附属医院炎症与变态反应实验室,四川 泸州 646000)
哮喘是由多种细胞和炎症因子介导的慢性呼吸系统疾病,是危害全球数百万人健康的全球公共卫生问题。目前哮喘临床治疗以西医治疗为主,包括糖皮质激素、β-受体激动剂和白三烯受体拮抗剂等。虽然上述药物可以缓解哮喘症状,但也存在产生耐药性、药物疗效明显下降、机体代谢紊乱和免疫力降低等不良反应。与西药比较,中药具有作用温和、作用时间长和治疗成本低等优势[1]。
桔 梗 元 参 汤 (Jiegeng Yuanshen Tang,JGYST)出自清朝名医黄元御《四圣心源》,主要成分包括桔梗、元参、杏仁、橘皮、法半夏、茯苓、甘草和生姜,具有清咽解毒、宣肺平喘及和胃降逆的功效。研究[2-5]表明:JGYST 对小儿化脓性扁桃体炎、变应性鼻炎、急性咽炎和急性呼吸道感染均有治疗作用。关于JGYST 对过敏性哮喘的治疗目前尚未见报道。本研究通过建立过敏性哮喘小鼠模型,采用JGYST 进行干预,观察JGYST 对哮喘小鼠的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器健康雄性C57BL/J 小鼠40 只,体质量20~35 g,6~8 周龄,由重庆腾鑫生物技术有限公司提供,动物使用许可证号:SYXK(川)2018-065。卵清蛋白(ovalbumin,OVA) 购自美国Sigma 公司,活性氧(reactive oxygen species,ROS) 检测试剂盒购自上海碧云天生物技术有限公司,桔梗、玄参、杏仁、陈皮、法半夏、茯苓、甘草和生姜购自北京同仁堂(集团) 有 限 公 司, 抗 CD4、 抗 CD45、 抗CD11c、抗CD11b、抗CD86、抗白细胞介素4(interleukin-4,IL-4)、抗Siglec-F (CD170)、抗Ly6G 和抗干扰素γ(interferon-γ,IFN-γ)抗体购自美国Invitrogen 公司,RNA 提取试剂盒和实时荧光定量PCR (real-time fluorescence quantitative PCR, RT-qPCR)检测试剂盒购自南京诺维赞生物技术有限公司。流式细胞仪购自美国ACEA Biosciences 公司, RT-qPCR 仪购自瑞士Roche公司。
1.2 实验分组和哮喘模型制备40 只雄性C57BL/J 小鼠随机分为对照组、JGYST组、OVA组和OVA+JGYST 组, 每组10 只。 OVA 组和OVA+JGYST 组小鼠采用OVA 联合氢氧化铝[Al (OH)3]腹腔注射致敏,每只小鼠50 μg OVA+2.5 mg Al(OH)3,每周2 次;致敏后每只小鼠连续7 d 用20 μg OVA 滴鼻激发哮喘[6],OVA+JGYST 组小鼠在每次OVA 激发前1 h 用JGYST 200 μL 灌胃,共灌胃7 次;对照组小鼠用相同剂量的PBS 缓冲液腹腔注射、滴鼻和灌胃;JGYST 组小鼠用相同剂量PBS 缓冲液腹腔注射和滴鼻,用相同剂量JGYST 灌胃。造模期间密切观察各组小鼠的健康状况。
1.3 HE 染色和过碘酸-雪夫(periodic acid-Schiff,PAS)染色观察各组小鼠肺组织病理形态表现并计算炎症评分和PAS 评分收集各组小鼠肺组织,4%多聚甲醛固定,石蜡包埋切片后行HE 染色和PAS 染色,进行炎症评分和黏液分泌情况评估(PAS 评分)。①炎症评分。每张切片选取10 个区域对气道和血管周围组织炎症细胞浸润严重程度和浸润总体范围进行评分。浸润严重程度评分:0 分,无炎症细胞;1 分,<3 个炎症细胞;2 分,4~10 个炎症细胞;3 分,>10 个炎症细胞;浸润总体范围评分:0 分,无炎症细胞浸润;1分,炎症细胞浸润范围<25%;2分,炎症细胞浸润范围25%~75%;3分,炎症细胞浸润范围>75%。结合炎症细胞浸润严重程度和浸润总体范围对炎症进行评分,最高评分可达9 分[7]。②PAS 评分。每张切片选取10 个区域,对PAS 阳性杯状细胞进行PAS 评分:0 分,PAS 阳性杯状细胞百分率<5%;1 分,PAS阳性杯状细胞百分率5%~25%;2 分,PAS 阳性杯状细胞百分率26%~50%;3 分,PAS 阳性杯状细胞百分率51%~75%;4 分,PAS 阳性杯状细胞百分率>75%[8]。
1.4 流式细胞术检测各组小鼠肺组织中中性粒细胞、嗜酸性粒细胞、辅助性T 淋巴细胞1(helper T lymphocyte 1,Th1)、辅助性T 淋巴细胞2(helper T lymphocyte 2, Th2)和树突状细胞(dendritic cells, DCs)数取各组小鼠肺组织,用Ⅰ型胶原酶和DNA 酶消化过滤获得单细胞,用相应抗体在4 ℃条件下进行染色,0.5 h 后上机检测中性粒细胞(CD45+ Siglec-F-Ly6G+CD11b+)、嗜酸性粒细胞(CD45+ Siglec-F+Ly6G-CD11c-)、Th1细胞 (CD45+ CD4+IFN- γ + )、 Th2 细胞(CD45+ CD4+IL-4+ )、 成熟 DCs (CD45+CD11c+CD86+) 和总DCs (CD45+CD11c+)数。结果以各组荧光阳性细胞数表示,采用Flowjo软件对流式细胞术检测结果进行分析,计算成熟DCs 百分率。成熟DCs 百分率=成熟DCs 数/总DCs 数×100%。
1.5 2',7'-二 氯 荧 光 素 二 乙 酸 酯(2', 7'-dichlorodihydrofluorescein diacetate,DCFH-DA) 荧光探针检测各组小鼠肺组织中ROS水平取各组小鼠肺组织,用Ⅰ型胶原酶和DNA酶裂解,过滤获得单细胞。收集细胞悬浮于用无血清培养液稀释的DCFH-DA (1∶1 000,100 μL)中,37 ℃细胞培养箱中孵育20 min。每隔3~5 min颠倒混匀,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3 次以充分去除未进入细胞内的DCFH-DA。洗涤后加100 μL 流式上样缓冲液,流式细胞术检测ROS 水平。ROS 水平以各组细胞的平均荧光强度(mean fluorescence intensity,MFI)表示,采用Flowjo 软件对流式细胞术检测结果进行分析。
1.6 RT-qPCR 法检测各组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平采用RNA 提取试剂盒分离各组小鼠肺组织总RNA。以RNA 为模板,采用逆转录试剂盒合成cDNA。以cDNA 为模板,采用SYBR qPCR 试剂盒检测IL-4、IL-10 和TNF-α mRNA 表达水平。反应条件:95 ℃、10 s,58 ℃、 10 s, 72 ℃、 10 s, 共40 个循环。 以GAPDH 为内参,采用2-ΔΔCt法计算各组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平。引物序列见表1。
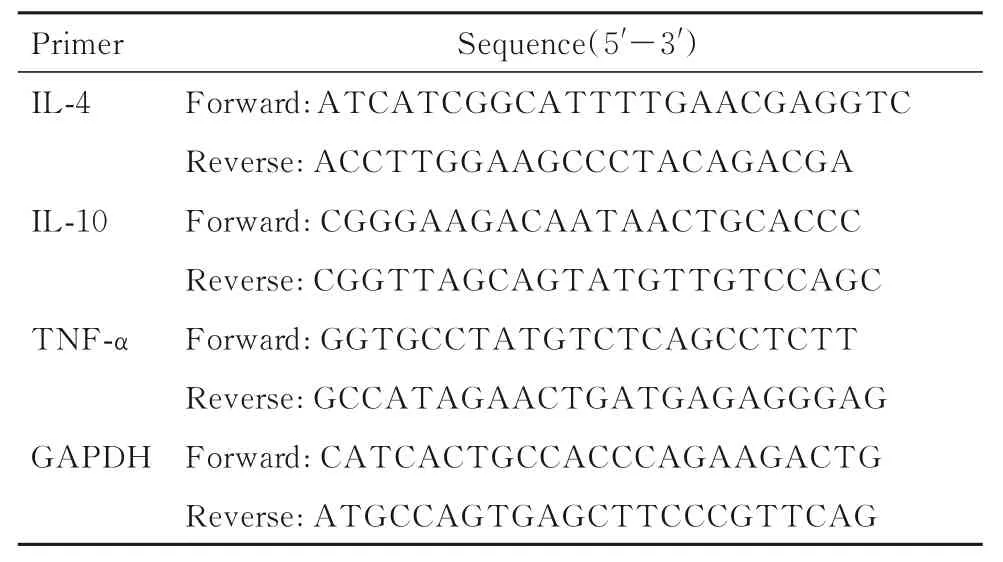
表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.7 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组小鼠肺组织炎症评分和PAS 评分,各组小鼠肺组织中中性粒细胞、嗜酸性粒细胞、Th1 细胞、Th2 细胞和DCs 数,成熟DCs 百分率和ROS 水平,各组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平,均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠肺组织病理形态表现、炎症评分和PAS 评分HE 染色和PAS 显示:对照组小鼠气道和肺泡结构完整、清晰,无炎症细胞浸润,无黏液分泌;与对照组比较,OVA 组小鼠气道变窄,管壁增厚,黏液分泌增加,气道组织和血管周围有大量炎症细胞浸润,炎症评分和PAS 评分明显升高(P<0.01);与OVA 组比较,JGYST 组和OVA+JGYST 组小鼠气道组织炎症细胞浸润和黏液分泌明显减少,炎症评分和PAS 评分明显降低(P<0.01)。见图1 和表2。
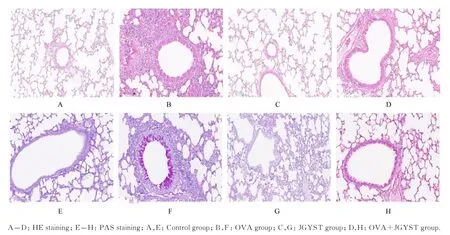
图1 各组小鼠肺组织HE 染色和PAS 染色结果(×200)Fig. 1 HE staining and PAS staining results of lung tissue of mice in various groups(×200)
表2 各组小鼠肺组织炎症评分和PAS 评分Tab. 2 Inflammation scores and PAS scores of lung tissue of mice in various groups (n=6,)

表2 各组小鼠肺组织炎症评分和PAS 评分Tab. 2 Inflammation scores and PAS scores of lung tissue of mice in various groups (n=6,)
*P<0.01 compared with control group; △P<0.01 compared with OVA group.
?
2.2 各组小鼠肺组织中嗜酸性粒细胞和中性粒细胞数与对照组比较,OVA 组小鼠肺组织中嗜酸性粒细胞数明显增加(P<0.01);与OVA 组比较,JGYST 组和OVA+JGYST 组小鼠肺组织中嗜酸性粒细胞数明显减少(P<0.01)。各组小鼠肺组织中中性粒细胞数比较差异均无统计学意义(P>0.05)。见表3。
表3 各组小鼠肺组织中嗜酸性粒细胞和中性粒细胞数Tab. 3 Numbers of eosinophils and neutrophils in lung tissue of mice in various groups(n=6,)
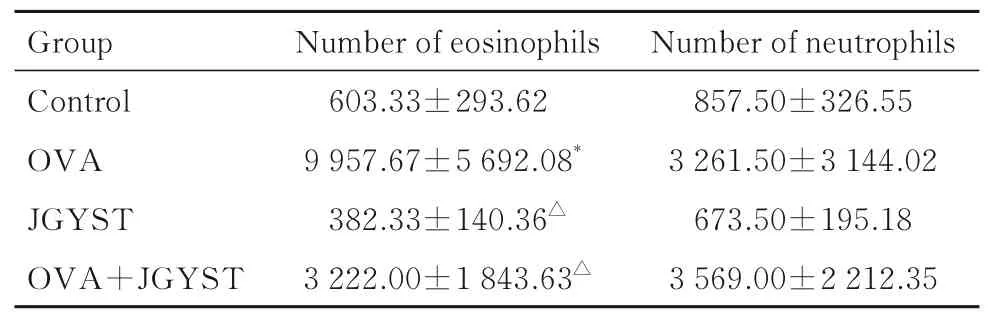
表3 各组小鼠肺组织中嗜酸性粒细胞和中性粒细胞数Tab. 3 Numbers of eosinophils and neutrophils in lung tissue of mice in various groups(n=6,)
*P<0.01 compared with control group; △P<0.01 compared with OVA group.
?
2.3 各组小鼠肺组织中Th1 和Th2 细胞数与对照组比较,OVA 组小鼠肺组织中Th2 细胞数明显增加(P<0.01);与OVA 组比较,JGYST 组和OVA+JGYST 组小鼠肺组织中Th2 细胞数明显减少(P<0.01)。各组小鼠肺组织中Th1 细胞数比较差异均无统计学意义(P>0.05)。见表4。
表4 各组小鼠肺组织中Th1 和Th2 细胞数Tab. 4 Numbers of Th1 and Th2 cells in lung tissue of mice in various groups(n=6,)

表4 各组小鼠肺组织中Th1 和Th2 细胞数Tab. 4 Numbers of Th1 and Th2 cells in lung tissue of mice in various groups(n=6,)
*P<0.01 compared with control group; △P<0.01 compared with OVA group.
?
2.4 各组小鼠肺组织中DCs 数与对照组比较,OVA 组小鼠肺组织中总DCs 数和成熟DCs 数明显增加(P<0.05 或P<0.01),成熟DCs 百分率明显升高(P<0.01);与OVA 组比较,JGYST 组和OVA+JGYST 组小鼠肺组织中总DCs 数和成熟DCs 数明显减少(P<0.01),成熟DCs 百分率明显降低(P<0.01)。见表5。
表5 各组小鼠肺组织中总DCs 数、成熟DCs 数和成熟DCs 百分率Tab. 5 Numbers of total DCs, mature DCs and percentages of mature DCs in lung tissue of mice in various groups(n=6,)
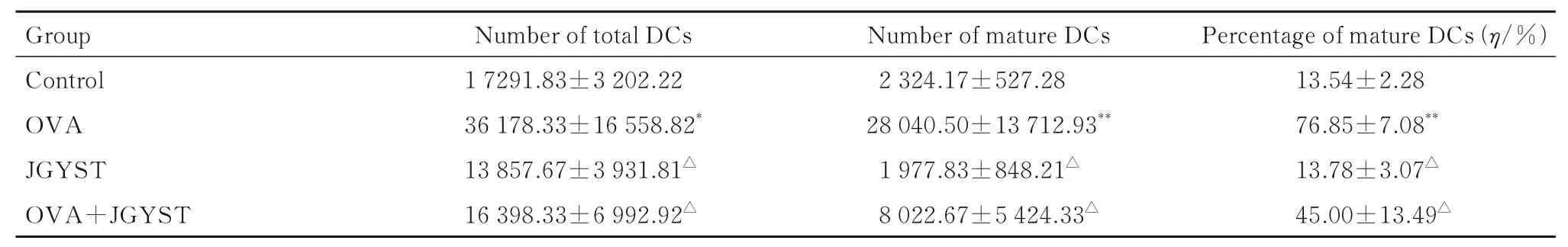
表5 各组小鼠肺组织中总DCs 数、成熟DCs 数和成熟DCs 百分率Tab. 5 Numbers of total DCs, mature DCs and percentages of mature DCs in lung tissue of mice in various groups(n=6,)
*P<0.05, **P<0.01 compared with control group; △P<0.01 compared with OVA group.
?
2.5 各组小鼠肺组织中ROS 水平与对照组比较,OVA 组小鼠肺组织中ROS 水平明显升高(P<0.01);与OVA 组比较,JGYST 组和OVA+JGYST 组小鼠肺组织中ROS 水平明显降低(P<0.01)。见图2 和表6。
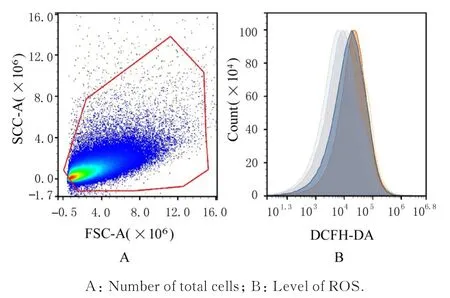
图2 DCFH-DA 荧光探针检测各组小鼠肺组织中ROS 水平Fig. 2 Levels of ROS in lung tissue of mice in various groups detected by DCFH-DA fluorescence probe
表6 各组小鼠肺组织中ROS 水平Tab. 6 Levels of ROS in lung tissue of mice in various groups (n=6,, ×104)

表6 各组小鼠肺组织中ROS 水平Tab. 6 Levels of ROS in lung tissue of mice in various groups (n=6,, ×104)
*P<0.01 compared with control group; △P<0.01 compared with OVA group.
?
2.6 各组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平与对照组比较,OVA 组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平均明显升高(P<0.01);与OVA 组比较,JGYST 组小鼠组织中IL-4、IL-10 和TNF-α mRNA 表达水平均明显降低(P<0.01);OVA+JGYST 组小鼠肺组织中IL-4 和TNF-α mRNA 水平明显降低(P<0.01),IL-10 mRNA 表达水平明显升高(P<0.01)。见图3。

图3 各组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平Fig. 3 Expression levels of IL-4,IL-10,and TNF-α mRNA in lung tissue of mice in various groups
3 讨 论
中药在防治哮喘方面积累了丰富的经验,且具有较好的临床效果[9-11]。研究[2-4]表明:JGYST 可用于治疗小儿化脓性扁桃体炎、变应性鼻炎和急性咽炎等,然而JGYST 是否对哮喘有效尚未见文献报道。本研究采用JGYST 对过敏性哮喘小鼠进行干预,结果显示:JGYST 可减轻哮喘小鼠气道组织炎症细胞浸润,减少嗜酸性粒细胞数量并且抑制组织气道黏液分泌,表明JGYST 可减轻过敏性哮喘小鼠气道炎症和黏液分泌,改善过敏性哮喘小鼠症状。
CD4+T 淋巴细胞主要分为Th1 细胞和Th2 细胞2 个亚群,二者在正常人体内呈动态平衡,Th1/Th2 细胞免疫失衡是过敏性哮喘的经典途径[12]。Th1 细胞主要分泌IFN-γ,抑制由IL-4 诱导的IgE 的生成。Th2 细胞主要分泌IL-4,可激活嗜酸性粒细胞,促进气道炎症、气道重塑和黏液分泌[13-16]。本研究结果显示:OVA 组小鼠肺组织中Th2 细胞数明显增加,JGYST 干预可减少小鼠肺组织中Th2 细胞数,提示JGYST 可以改善小鼠体内Th1/Th2 细胞的免疫失衡状态。
DCs 是免疫系统中最重要的抗原提呈细胞,在固有免疫和获得性免疫中起桥梁作用。过敏原可刺激气道组织上皮细胞产生警报素和炎症因子,激活DCs 进而启动和维持Th2 免疫反应[17-18]。CD11c 通常被视为小鼠DCs 的标记物[19]。研究[20-21]表明:在OVA 诱导的过敏性哮喘小鼠中,与野生型小鼠比较,CDs 敲除小鼠气道高反应和气道组织嗜酸性粒细胞浸润均有降低。本研究结果显示:OVA 可增加小鼠肺组织中DCs 数,JGYST 干预可以明显减少小鼠肺组织的DCs 数,表明JGYST 可通过下调过敏性哮喘小鼠的DCs 表达减轻Th2 免疫反应。
ROS 具有代谢调节功能,过量的ROS 会对细胞造成损害,促进细胞死亡和疾病的发生[22]。研究[23]显示:ROS 可通过多种细胞内信号途径促进气道炎症,因此抑制ROS 并减轻气道炎症是哮喘治疗的思路之一。研究[24]表明:JGYST 含药血清可明显降低人中性粒细胞弹性蛋白酶(human neutrophil elastase, HNE) 诱导的ROS 增加。本研究结果显示:OVA 组小鼠肺组织中ROS 水平明显升高,JGYST 干预可以明显降低小鼠肺组织中ROS 水平,进而减轻过敏性哮喘小鼠的气道组织炎症。
IL-4 由Th2 细胞分泌,是一种促炎细胞因子,可刺激B 淋巴细胞合成IgE[15]。TNF-α 是免疫反应中重要的细胞因子,在各种慢性炎症性疾病中均有表达,是中性粒细胞和嗜酸性粒细胞的化学趋化因子,也可激活T 淋巴细胞[25-26]。研究[27-28]表明:IL-10 作为一种抗炎细胞因子,可减少嗜酸性粒细胞和中性粒细胞的浸润。本研究结果显示:OVA组小鼠肺组织中IL-4、IL-10 和TNF-α mRNA 表达水平明显升高,JGYST 干预后可明显降低小鼠肺组织中IL-4 和TNF-α mRNA 表达水平,升高IL-10 mRNA 表达水平,表明JGYST 可通过减少过敏性哮喘小鼠肺组织中IL-4 和TNF-α 表达,增加IL-10 表达,进而减轻气道炎症。
综上所述,JGYST 可以减轻过敏性哮喘小鼠气道炎症和黏液分泌,其机制可能与减少Th2 细胞和DCs 数量、降低ROS 水平和IL-4 及TNF-α mRNA 表达水平以及升高IL-10 mRNA 表达水平有关。本研究为采用JGYST 治疗过敏性哮喘提供了理论和实验依据,未来应进一步通过临床试验研究JGYST 抑制过敏性哮喘气道炎症和黏液分泌的具体机制,为哮喘的治疗提供新的线索和思路。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
唐红梅参与论文设计、撰写和修改,唐红梅、李月蛟、王星、王志彬和袁谢芳参与实验数据的获取和分析,王孝芸参与实验设计。
