小檗碱对人胶质瘤T98G 细胞迁移和侵袭的抑制作用及其机制
2024-02-12孙玉学刘自强赵黎明黄海燕栗超跃
孙玉学, 刘自强, 吴 豪, 赵黎明, 高 涛, 黄海燕, 栗超跃
(1. 河南省人民医院神经外科,河南 郑州 450000;2. 河南省人民医院重症医学科,河南 郑州 450000;3. 吉林大学第一医院神经外科,吉林 长春 130021)
胶质瘤是最常见的颅内原发性恶性肿瘤,由于其浸润性生长和放化疗抵抗,预后较差,因此胶质瘤的治疗一直是研究的热点[1-2]。研究[3]显示:脂肪酸合成酶(fatty acid synthetase,FASN)水平与胶 质 瘤 的 世 界 卫 生 组 织 (World Health Organization,WHO)分级呈正相关关系,减肥药奥利司他可明显抑制FASN 表达,进而有效抑制胶质瘤的增殖。 YASUMOTO 等[4]报道: 抑制FASN 表达能有效抑制胶质瘤干细胞球的形成,表明FASN 与胶质瘤细胞增殖、侵袭及其恶性程度有密切关联。因此,干扰胶质瘤脂肪酸合成的药物具有治疗胶质瘤的潜在价值。
TAN 等[5]研究发现: 小檗碱(berberine,BBR) 具有抑制乳腺癌细胞中脂肪酸合成关键酶FASN 的作用,可通过抑制脂类合成有效抑制乳腺癌生长。BBR 为黄连提取物,是天然中药,安全性高且对脑部缺血再灌注损伤具有保护作用[6]。既往研究[7-8]显示:BBR 可以通过多个位点抑制胶质瘤生长。目前胶质瘤化疗药物主要为替莫唑胺,但O6-甲 基 鸟 嘌 呤 -DNA 甲 基 转 移 酶(O6-methylguanine-DNA methyltransferase, MGMT)能够修复替莫唑胺导致的DNA 损害,使替莫唑胺化疗效果减弱,因此本研究选取MGMT 高表达且对替莫唑胺敏感性较差的T98G 胶质瘤细胞[9],探讨BBR 通过调控胶质瘤细胞中脂肪酸合成进而抑制胶质细胞瘤迁移和侵袭的作用,为治疗MGMT高表达的胶质瘤提供新的思路。
1 材料与方法
1.1 细胞、主要试剂和仪器人胶质瘤T98G 细胞和293T 细胞购自美国典型菌种保藏中心(American Type Culture Collection,ATCC) 细胞库。BBR(四川克洛玛生物科技有限公司) 溶于DMSO 制备100 mg·L-1母液备用。DMEM、MEM和Opti MEM 培养基及胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司),磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、蛋白激酶B(protein kinase B, AKT)、 磷 酸 化 AKT(phosphorylated AKT, p-AKT) 和β-actin 抗体(美国Cell Signaling公司),固醇调节元件结合蛋白1(sterol regulatory element-binding protein-1,SREBP-1) 和FASN 抗体(英国Abcam 公司),RIPA 裂解液和BCA 蛋白定量试剂盒(南京碧云天生物技术有限公司),shFASN 空载质粒、shFASN干扰质粒1 和shFASN 干扰质粒2(上海权阳生物科技有限公司), Lipo2000 转染试剂(美国Thermofisher 公司)。倒置显微镜(日本Olympus公司),电泳仪和转膜仪(美国Bio-Rad 公司)。
1.2 细胞培养及传代人胶质瘤T98G 细胞采用含有10 % FBS 的MEM 培养基培养,293T 细胞采用含有10 % FBS 的DMEM 培养基培养。细胞在37 ℃、5% CO2和饱和湿度的培养箱中培养,2~3 d更换1 次培养基,融合度达到80%时进行传代,取对数生长期细胞进行后续实验。
1.3 细胞划痕愈合实验检测各组细胞迁移率收集对数生长期T98G 细胞并调整细胞密度为1×106mL-1,接种于6 孔细胞培养板中,分为对照组和不同浓度(25、50 及100 mg·L-1) BBR 组,每组设3 个复孔,恒温培养箱中过夜。观察细胞长满,白色10 μL 枪头垂直划痕。洗除划下的细胞,分别加入含0、25、50 和100 mg·L-1BBR 的无血清培养基,置于37 ℃、5% CO2和饱和湿度的恒温培养箱中培养,0 和24 h 时取样,采集图像。实验重复3 次,计算各组细胞迁移率。细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.4 Transwell 小室实验检测各组细胞侵袭率实验前1 d 将基质胶(8~12 g·L-1) 置于4 ℃冰箱中融化过夜,基质胶采用预冷的无血清MEM 按1∶9 稀释(稀释至1 g·L-1),每孔中加入40 μL 稀释好的基质胶,于37 ℃培养箱中孵育5 h。水化基底膜:吸出小室中残余液体,每孔加入70 μL 无血清MEM 培养液,37 ℃作用30 min,吸去培养基;取对数生长期T98G 细胞,细胞分组见“1.3”,每孔中加2×105个细胞,24 孔细胞培养板下室加入600 μL 含10%胎牛血清的培养基,继续培养24 h。避光处分别将0、25、50 和100 mg·L-1BBR 加入各孔中,每组设3 个复孔。24 h 后弃去孔中培养基,PBS 缓冲液洗涤2 次,甲醇固定,0.1%结晶紫染色,取下Transwell 滤膜。200 倍显微镜下随机选取5 个视野观察细胞并计数,采集图像。计算细胞侵袭率。细胞侵袭率=实验组穿膜细胞数/对照组穿膜细胞数×100%。
1.5 质谱法检测2 组细胞中脂肪酸含量色谱柱:TG-5MS (30 m×0.25 mm×0.25 μm);升温程序:80 ℃保持1 min,以10℃·min-1的速率升温至200 ℃,然后以5 ℃·min-1的速率升温至250 ℃,再以2 ℃·min-1的速率升温至270 ℃,保持3 min。进样口温度290 ℃,载气流速1.2 mL·min-1,不分流进样,开阀时间1 min。质谱条件:离子源温度280 ℃,传输线温度280 ℃,溶剂延迟时间5 min。扫描范围30~400 amu,电子轰击离子源(electron impact ion source,EI) 70 eV。对数生长期T98G细胞培养至细胞融合70% 左右,分为对照组和100 mg·L-1BBR 组,分别加入等量DMSO 和100 mg·L-1BBR,培养48 h,洗涤收集冻存,共收集约100 mg 细胞样品。称取80 mg 样品加入100 μL 十九烷酸甲酯内标。继续加入2%氢氧化钠甲醇溶液2 mL,85 ℃水浴锅中水浴30 min,加入14%三氟化硼甲醇溶液3 mL,于85 ℃水浴锅中水浴30 min。水浴完成后,温度降至室温,将1 mL正己烷加入至离心管中,震荡萃取静置分层。取上层清液加入100 μL 正己烷定容至1 mL,滤膜滤过上机检测细胞中各类脂肪酸含量。
1.6 Western blotting 法检测各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 和FASN 蛋白表达水平对数生长期T98G 细胞分为对照组和不同浓度(50、100 及150 mg·L-1)BBR 组,于冰上收集各组细胞,采用预冷的PBS 缓冲液漂洗细胞。适量RIPA 裂解液裂解细胞,取上清,采用BCA 法测定蛋白浓度备用。聚丙烯酰胺凝胶电泳,蛋白上样量为30~50 μg,PVDF 膜转膜。TBS 配置的5%脱脂奶粉常温封闭1 h,加入对应稀释的一抗p-PI3K、 PI3K、 p-AKT、 AKT、 SREBP-1 和FASN 抗体,4 ℃孵育过夜,加入对应的二抗孵育1 h,洗膜;加入ECL 显色液作用20 s。应用凝胶成像系统采集条带图集。采用AlphaEaseFC 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值×100%。
1.7 shFASN 慢病毒包装质粒及转染T98G 细胞收集对数生长期293T 细胞进行计数,调整细胞密度为1×106mL-1,培养箱中过夜。将1.5 μg包装混合质粒和0.5 μg 表达质粒(空载质粒、shFASN1 质粒和shFASN2 质粒) 加入至250 μL无血清Opti MEM 中。轻轻吹打混匀,室温孵育5 min。取1.5 mL灭菌EP管,Lipo2000 溶于250 μL无血清Opti MEM 培养基,吹打混匀。室温孵育5 min。将DNA 溶液和Lipo2000 溶液吹打混匀,室温孵育20 min。 将DNA-Lipo2000 加入1 mL Opti MEM 培养基中,轻柔混匀。去除原培养基,将1.5 mL 含有DNA-Lipo2000 复合物的培养基加入至培养孔中,培养过夜。移除原培养基,补充含10% FBS 的新鲜MEM 培养基1.5 mL。转染后48 h 收获含病毒的上清,离心后测定病毒滴度备用。细胞转染:收集对数生长期T98G 细胞并计数,调整细胞密度为5×104mL-1。接种于6 孔细胞培养板中,每孔1 mL 细胞混悬液,在37 ℃、5% CO2和饱和湿度的恒温培养箱中过夜。根据细胞数量加入适量慢病毒,继续培养过夜。荧光显微镜(激发波长为460~550 nm)观察绿色荧光蛋白(green fluorescent protein,GFP) 表达情况,转染慢病毒细胞呈绿色,去除含病毒培养基,加入2 mL 新鲜培养基继续培养24 h。加入适量嘌呤霉素进行转染细胞筛选。根据病毒转染情况将T98G细胞分为对照组、shFASN1 组和shFASN2 组,采用Western blotting 法检测各组细胞中FASN 蛋白表达水平,方法见“1.6”。
1.8 克隆形成实验及细胞划痕愈合实验检测各组细胞克隆形成情况和细胞迁移率收集shFASN 稳定转染的各组T98G 细胞进行计数,调整细胞密度为1×103mL-1,接种于6 孔细胞培养板中,每组设3 个复孔, 每孔1 mL 细胞混悬液, 于37 ℃、5% CO2和饱和湿度的恒温培养箱中过夜。当培养皿中出现肉眼可见的克隆时,约10 d 终止培养。加入4% 多聚甲醛2 mL 室温避光固定细胞20 min,加入适量1%结晶紫溶液染色10 min,洗去染色液干燥。低倍显微镜观察大于50 个细胞的克隆形成情况。细胞分组同上,采用细胞划痕愈合实验检测各组细胞迁移率,方法见“1.3”。
1.9 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组细胞迁移率和细胞侵袭率,各类脂肪酸含量和各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 及FASN 蛋白表达水平,均呈正态分布,以表示,2 组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用 SNK-q 检验。以P<0. 05 为差异有统计学意义。
2 结 果
2.1 各组细胞迁移率和侵袭率与对照组比较,不同浓度BBR 组细胞迁移距离呈浓度依赖性减少,细胞迁移率呈浓度依赖性降低(P<0.01)。见图1 和2。

图1 细胞划痕愈合实验检测各组细胞迁移情况(×100)Fig. 1 Migration of cells in various groups detected by cell scratch healing assay(×100)

图2 各组细胞迁移率Fig. 2 Migration rates of cells in various groups
与对照组比较,不同浓度BBR 组跨膜细胞数呈浓度依赖性减少,细胞侵袭率呈浓度依赖性降低(P<0.01)。见图3 和4。
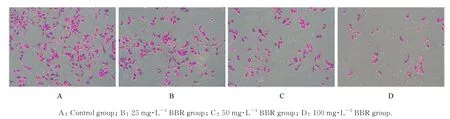
图3 Transwell 小室实验检测各组细胞侵袭情况(结晶紫,×200)Fig. 3 Invasion of cells in various groups detected by Transwell chamber assay (Crystal violet, ×200)
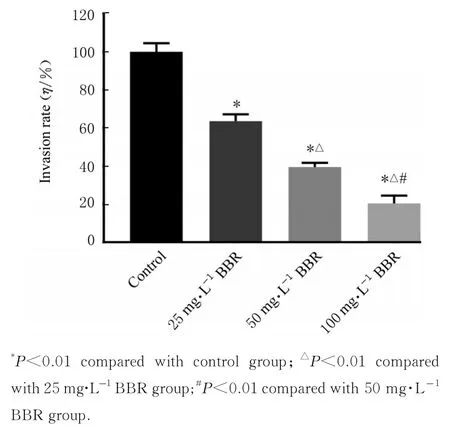
图4 各组细胞侵袭率Fig. 4 Invasion rates of cells in various groups
2.2 2 组细胞中脂肪酸含量与对照组比较,100 mg·L-1BBR 组细胞中各类脂肪酸含量明显降低(P<0.01)。见表1。
表1 2 组细胞中各类脂肪酸含量Tab. 1 Contents of fatty acids in cells in two groups(n=3,,η/%)

表1 2 组细胞中各类脂肪酸含量Tab. 1 Contents of fatty acids in cells in two groups(n=3,,η/%)
*P<0.01 compared with control group.
?
2.3 各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 和FASN 蛋白表达水平与对照组比较,100 和150 mg·L-1BBR 组细胞中p-PI3K、p-AKT和FASN 蛋白表达水平明显降低(P<0.05 或P<0.01),150 mg·L-1BBR 组细胞中SREBP-1 蛋白表达水平明显降低(P<0.01),不同浓度BBR 组细胞中PI3K 和AKT 蛋白表达水平差异均无统计学意义(P>0.05)。见图5 和表2。
表2 各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 和FASN 蛋白表达水平Tab. 2 Expression levels of p-PI3K,PI3K,p-AKT,AKT,SREBP-1,and FASN proteins in cells in various groups(n=3,,η/%)
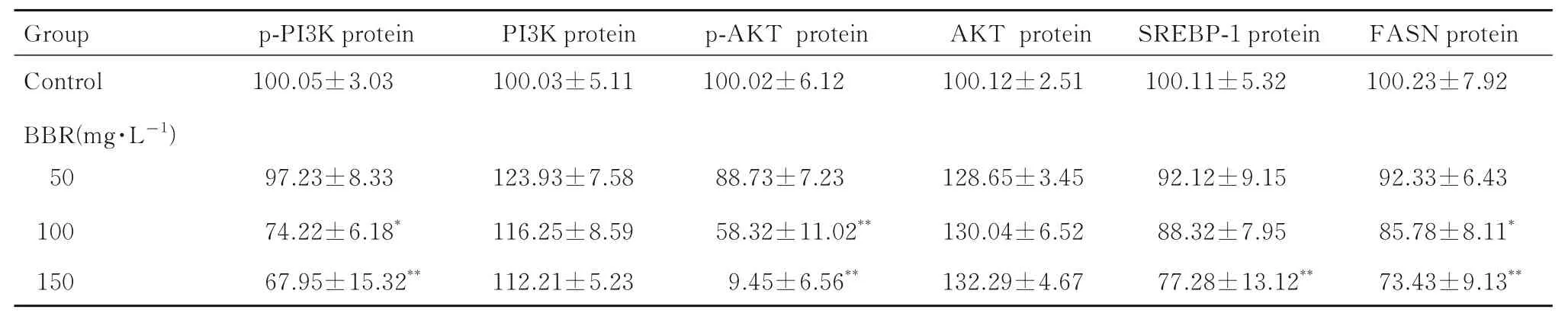
表2 各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 和FASN 蛋白表达水平Tab. 2 Expression levels of p-PI3K,PI3K,p-AKT,AKT,SREBP-1,and FASN proteins in cells in various groups(n=3,,η/%)
*P<0.05,**P<0.01 compared with control group.
?
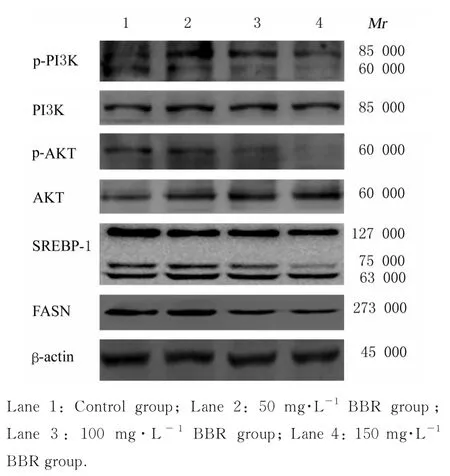
图5 Western blotting 法检测各组细胞中p-PI3K、PI3K、p-AKT、AKT、SREBP-1 和FASN 蛋白表达电泳图Fig. 5 Electrophoregram of expressions of p-PI3K,PI3K,p-AKT,AKT,SREBP-1,and FASN proteins in cells in various groups detected by Western blotting method
2.4 沉默FSAN 基因后各组细胞中FSAN 蛋白表达水平与对照组(100.12%±6.22%) 比较,shFASN1 组和shFASN2 组细胞中FASN 蛋白表达水平(65.75%±12.34%和50.26% ±8.15%)明显降低 (P<0.01); 与 shFASN1 组比较,shFASN2 组细胞中FASN 蛋白表达水平降低(P<0.05)。见图6。

图6 沉默FSAN 基因后各组细胞中FSAN 蛋白表达电泳图Fig. 6 Electrophoregram of expression of FASN protein in cells in various groups after silencing FASN gene
2.5 沉默FSAN 基因后各组细胞中克隆形成数和细胞迁移率与对照组比较,shFASN1 组和shFASN2 组细胞中克隆形成数明显减少;与shFASN1 组比较,shFASN2 组细胞中克隆形成数进一步减少。见图7。与对照组(75%±3%) 比较, shFASN1 组和shFASN2 组细胞迁移率(52%±3% 和30%±2%) 明显降低(P<0.01);与shFASN1 组比较,shFASN2 组细胞迁移率进一步降低(P<0.05)。
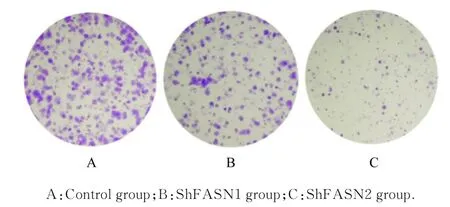
图7 克隆形成实验检测沉默FSAN 基因后各组细胞中克隆形成情况(结晶紫)Fig. 7 Clone formation of cells in various groups after silencing FASN gene detected by clone formation assay(Crystal violet)
3 讨 论
胶质瘤的快速生长和侵袭给胶质瘤的治疗带来了众多挑战,而胶质瘤的特点之一是过多合成和利用脂类物质,尤其是脂肪酸在胶质瘤细胞突触形成和生物合成中发挥重要作用[10]。研究[3]显示:FASN 的表达水平与胶质瘤WHO 分级呈正相关关系。在星形胶质瘤细胞、反应性星形胶质细胞和巨噬细胞共存的组织中,脂肪酸生物合成增加,并与复发性胶质母细胞瘤患者生存期较短有密切关联[1],而肿瘤的生长能力也主要取决于肿瘤本身蛋白质和脂肪合成的能力[11]。脂肪酸是细胞器和生物膜的重要组成成分,在肿瘤增殖和迁移过程中发挥重要作用[10,12],下调脂肪酸合成能够抑制肿瘤生长[13],脂肪酸合成可促进胶质瘤恶性进展[14]。因此抑制胶质瘤脂肪酸合成对于胶质瘤的治疗具有重要的临床价值。
MGMT 高表达的T98G 胶质瘤细胞对替莫唑胺相对不敏感[9]。本研究结果显示:BBR 作用于胶质瘤T98G 细胞后,其迁移和侵袭能力明显降低,表明BBR 对T98G 细胞有明显的抑制作用。采用胶质瘤GL261 细胞制备脑内成瘤模型,质谱成像法定量检测结果[15]显示:胶质瘤组织中脂肪酸延长酶活性是周围健康脑组织的8 倍,表明FASN在胶质瘤中发挥重要作用。本研究采用质谱法对胶质瘤T98G 细胞中脂肪酸含量进行检测,结果显示:与对照组比较,BBR 作用于胶质瘤T98G 细胞后细胞中脂肪酸含量明显降低,说明BBR 具有降低胶质瘤细胞内脂肪酸含量作用。在脂肪酸合成过程中FASN 发挥重要作用,是脂肪酸合成的关键酶[16],研究[17-18]显示:肿瘤细胞通过激活PI3K/AKT 信号通路,进一步提高FASN 表达,促进肿瘤细胞中脂肪酸合成。SREBP-1 为FASN 上游蛋白,在脂肪酸合成和脂肪酸链延伸过程中发挥重要作用[19-20],SREBP-1 可出现可变剪切,显示为多条带。抑制SREBP-1 表达与减少脂肪酸合成有关。研究[21]显示:降低SREBP-1 的表达可抑制胶质瘤C6 细胞脂肪酸合成。因此,SREBP-1 和FASN 在胶质瘤的脂肪酸合成过程中发挥关键作用。
本研究进一步探讨BBR 降低T98G 细胞中脂肪酸含量的机制。当BBR 作用于胶质瘤T98G 细胞后,p-PI3K 蛋白呈现双条带,显示p85 和p55 2 个磷酸化位点均受到BBR 抑制[22],p-PI3K 蛋白表达水平降低,而p-AKT、SREBP-1 和FASN 蛋白均出现下调,表明BBR 在胶质瘤T98G 细胞中可以抑制p-PI3K、p-AKT、SREBP-1 和FASN 蛋白表达,并且呈浓度依赖性。脂肪酸合成的主要转录调控因子SREBP-1 的断裂和核易位由AKT 介导[16],在结肠癌中,放射治疗敏感性增加与抑制FASN 活性和PI3K/AKT 磷酸化有关联[23],而SREBP-1/FASN 受PI3K/AKT 信号通路调控[24]。本研究结果表明:BBR 降低胶质瘤T98G 细胞中脂肪酸含量及抑制胶质瘤细胞迁移和侵袭,与PI3K/AKT/SREBP-1/FASN 信号通路调控有关联。为进一步验证FASN 表达与T98G 胶质瘤细胞迁移和侵袭能力的关系,采用基因沉默技术干扰胶质瘤T98G 细胞中FASN 蛋白表达,结果显示:抑制FASN 蛋白表达后T98G 细胞克隆形成数明显减少,而细胞克隆可以反映细胞群体依赖性和增殖能力,也可以反映肿瘤的恶性程度,表明抑制FASN 蛋白表达可明显抑制胶质瘤细胞增殖;同时胶质瘤T98G 细胞迁移率明显降低,表明通过抑制FASN 蛋白表达可以有效抑制胶质瘤T98G 细胞的迁移能力。
综上所述,BBR 可通过PI3K/AKT/SREBP-1/FASN 信号通路干扰胶质瘤细胞中脂肪酸合成,进而抑制MGMT 高表达的胶质瘤T98G 细胞迁移及侵袭能力。本研究结果将为研发以BBR 为有效成分的天然药物治疗胶质瘤提供参考。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
孙玉学和刘自强参与研究实施过程、数据采集和论文撰写,吴豪和高涛参与数据的统计学分析,赵黎明参与文献整理和分析,黄海燕参与研究方案制定,栗超跃参与论文修订和审校。
