PD-L1 对人口腔鳞状细胞癌细胞增殖、迁移和侵袭的影响
2024-02-12俞雪燕
曾 洁, 俞雪燕, 罗 婷, 徐 江
(1. 石河子大学第一附属医院口腔科,新疆 石河子 832000;2. 石河子大学第一附属医院病理科,新疆 石河子 832000;3. 新疆维吾尔自治区儿童医院检验科,新疆 乌鲁木齐 830000)
口 腔 鳞 状 细 胞 癌 (oral squamous cell carcinoma, OSCC) 约占口腔癌的90%,是一个严重的全球健康问题,也是世界范围内重大的公共健康威胁[1-2],其5 年生存率仅为30%,局部和远处转移及局部复发是OSCC 患者不良预后的主要影响因素[3],因此研究OSCC 的发生发展机制和寻找新的诊疗靶标至关重要。
程序性细胞死亡配体1 (programmed cell death-ligand 1,PD-L1)常与程序性细胞死亡受体1 (programmed cell death receptor-1,PD-1) 相互作用,进而导致针对肿瘤细胞的免疫应答失活[4]。研究[5-6]显示:PD-L1 在多种癌症中过表达,如黑色素瘤、肾上腺皮质癌和脑肿瘤等,并与患者的预后呈负相关关系。田国永等[7]研究发现:PD-L1在OSCC 组织中高表达,其高表达可缩短患者的生存期,并与淋巴结转移等有关。但关于PD-L1 在OSCC 中发挥作用的具体分子机制尚未完全阐明。本研究探讨PD-L1 在OSCC 细胞系中的表达,通过敲低PD-L1 表达分析其对OSCC CAL27 细胞增殖、克隆形成、迁移和侵袭能力的影响,为OSCC的诊断和治疗提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器口腔上皮HOK 细胞购自河北北纳生物科技有限公司, OSCC CAL27 和SCC15 细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)细胞库,OSCC TCA8113 细胞购自上海吉凯基因医学科技有限公司。兔抗PD-L1 单克隆抗体购自美国Abcam 公司,β-actin 抗体、辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗鼠IgG 和山羊抗兔IgG/FITC 二抗均购自北京中杉金桥生物技术有限公司,CCK-8 试剂盒购自米鼠(西安)生物科技有限公司, 小干扰RNA (small interfering RNA,siRNA)片段购自苏州吉玛基因股份有限公司,引物序列见表1。

表1 PD-L1 siRNA 引物序列Tab. 1 Primer sequences of PD-L1 siRNA
1.2 Western blotting 法检测口腔上皮HOK 细胞和OSCC 细胞中PD-L1 蛋白表达水平收集生长状态良好的HOK、CAL-27、SCC-15 和TCA8113细胞,采用RIPA 裂解液分离总蛋白,蛋白定量后,将总蛋白(约0.8 g)上样进行SDS-PAGE 电泳,湿转至PVDF 膜,无蛋白快速封闭液封闭15 min,采用稀释的一抗PD-L1 (1∶1 000) 和β-actin(1∶5 000) 4 ℃下孵育过夜。隔天采用含0.2%吐温的TBS(TBST)洗涤6次,每次5 min,将膜与二抗山羊抗兔IgG(H+L)-HRP(1∶15 000)和山羊抗鼠IgG(H+L)-HRP(1∶20 000)孵育2 h,再次将膜洗净,采用蛋白成像系统(Tanon5200)检测蛋白条带灰度值,采用Image J 软件进行灰度值分析,计算细胞中PD-L1 蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值。
1.3 免疫荧光染色法检测CAL27 细胞中PD-L1 蛋白表达和定位情况常规培养HOK 和CAL27 细胞,12 孔细胞培养板爬片,培养24 h 后细胞密度为60%~70%,1×PBS 缓冲液漂洗2 min,共3 次,室温下多聚甲醛固定15 min,再次1×PBS缓冲液漂洗,0.2%Triton-X-100 透化3 min,1×PBS 缓冲液洗净,37 ℃条件下采用5%BSA 封闭30 min,吸尽封闭液后加入一抗PD-L1(1∶500),4 ℃湿盒内孵育过夜。第2 天室温下复温30 min,PBS 缓冲液洗净,暗室内孵育二抗(1∶50)2 h,PBS 缓冲液漂洗,DAPI 染核30min 后立即用抗荧光淬灭剂封片,倒置荧光显微镜下观察PD-L1 蛋白表达和定位情况并拍照,其中绿色荧光代表PD-L1 蛋白表达。
1.4 CAL27 细胞分组和转染取对数生长期CAL27 细胞分为对照组(转染si-NC)和si-PD-L1组(转染si-PD-L1),消化离心后于6 孔细胞培养板内铺板,保证培养24 h 后细胞密度约为70%,PBS 缓冲液洗净后加入2 mL 无血清培养基,分别加入Lipofectamine 2000 和PD-L1 siRNA 混匀的转染试剂,静置15 min,加入弃去原培养基且PBS 缓冲液洗净的6 孔细胞培养板中,培养4~6 h 后直接更换为完全培养基,48 h 转染结束后收集细胞,进行后续研究。
1.5 CCK-8 法检测2 组CAL27 细胞增殖活性细胞分组见“1.4”。细胞转染后,以每孔2 000 个细胞的密度铺板于96 孔细胞培养板中,每组至少3 个复孔,最边缘孔加入PBS 缓冲液,37 ℃培养2 h 使细胞贴壁,避光条件下每孔加入CCK-8 试剂10 μL,继续培养24、48、72 和96 h,采用分光光度计检测波长450 nm 处吸光度(A)值,重复测量3 次,计算平均值,以A 值平均值表示细胞增殖活性。
1.6 平板克隆形成实验检测2 组CAL27 细胞克隆形成率细胞分组见“1.4”。6 孔细胞培养板中每孔加入3 000 个细胞,每组重复3 孔,37 ℃继续培养10 d 终止,PBS 缓冲液温和洗涤3 次,4%冰多聚甲醛固定15 min,PBS 缓冲液再次温和洗涤,4 ℃冰箱内结晶紫染色15 min,PBS 缓冲液洗净多余染色,晾干后拍照。细胞克隆计数的标准为显微镜下每个克隆含有的细胞数大于50 个。
1.7 细胞划痕实验检测2 组CAL27 细胞划痕愈合率细胞分组见“1.4”。6 孔细胞培养板中接种细胞,确保第2 天细胞密度达90%以上,200 μL 无菌枪头竖直划痕,PBS 缓冲液轻轻洗除划痕细胞,加入无血清培养基继续培养,0、24 和48 h 时显微镜下观察拍照,采用Image J 软件计算划痕部位的迁移面积,并计算划痕愈合率。划痕愈合率=(起始划痕面积-迁移后划痕面积)/起始划痕面积×100%。
1.8 Transwell 小室实验检测2 组CAL27 细胞中迁移和侵袭细胞数细胞迁移实验:于Transwell 小室上层加入5×104个悬浮于200 μL 无血清培养基的细胞,在下室添加600 μL 完全培养基,培养24 h后,取出小室,PBS 缓冲液洗涤2 次,冰甲醇固定20 min,然后用0.5%结晶紫室温染色30 min,棉签轻轻擦拭小室内部并晾干,显微镜下观察染色细胞并随机选取5 个视野进行细胞计数,5 个视野迁移细胞数均值即为迁移细胞数,代表细胞迁移能力。 细胞侵袭实验: 将Matrigel 基质胶加入Transwell 小室内均匀平铺,然后将小室置于37 ℃培养箱静置2 h,使胶充分凝固,取出小室,小心吸去上层液体,再加入100 μL 无血清培养基,继续在37 ℃培养箱中静置30 min,使胶充分水化,再次吸尽小室上层液体,后续实验步骤和侵袭细胞计数同细胞迁移实验。
1.9 统计学分析采用SPSS 26.0 和GraphPad Prism 9.0 统计软件进行统计学分析。细胞中PD-L1 蛋白表达水平、细胞增殖活性、克隆形成率、划痕愈合率、迁移细胞数和侵袭细胞数均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验,2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 OSCC 细胞中PD-L1 蛋白表达水平及CAL27细胞中PD-L1 蛋白表达和定位情况与HOK 细胞比较,CAL27、SCC15 和TCA8113 细胞中PD-L1蛋白表达水平明显升高(P<0.05 或P<0.01)。CAL27 细胞中PD-L1 蛋白表达水平最高,且CAL27 易培养,生长分裂增殖快,细胞状态佳,故选择CAL27 细胞进行后续实验。免疫荧光染色显示:CAL27 细胞的细胞质和细胞核中均有PD-L1 表达,与HOK 细胞比较,PD-L1 在CAL27细胞的细胞质中表达较强。见图1 和2。
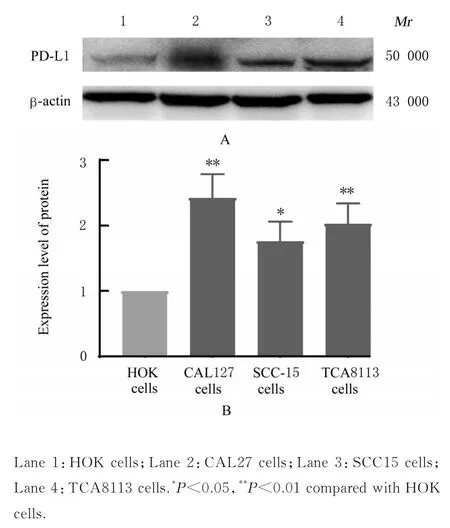
图1 Western blotting 法检测不同细胞中PD-L1 蛋白表达电泳图(A)和直条图(B)Fig. 1 Electrophoregram(A) and histogram(B) of expression of PD-L1 protein in different cells detected by Western blotting method
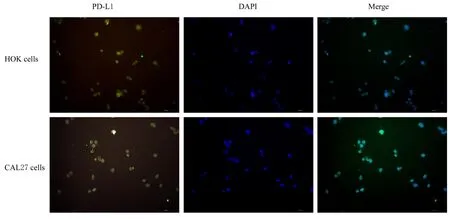
图2 HOK 细胞和CAL27 细胞中PD-L1 蛋白表达情况(免疫荧光,×200)Fig. 2 Expression of PD-L1 protein in HOK cells and CAL27 cells (Immunofluorescence,×200)
2.2 2 组CAL27 细胞中PD-L1 蛋白表达水平与对照组比较,si-PD-L1 组细胞中PD-L1 蛋白表达水平明显降低(P<0.05),表明si-PD-L1 在CAL27细胞中干扰有效。见图3。
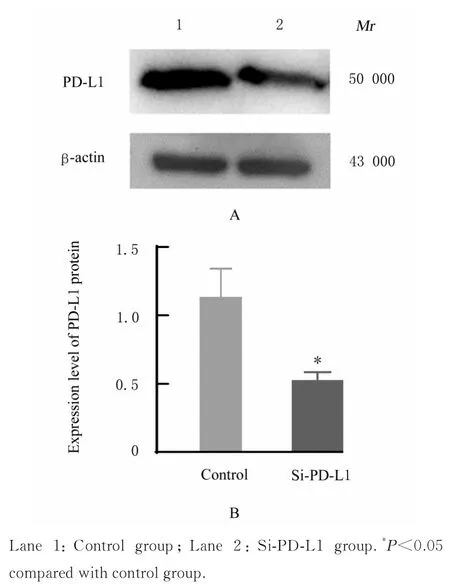
图3 Western blotting 法检测2 组CAL27 细胞中PD-L1 蛋白表达电泳图(A)和直条图(B)Fig. 3 Electrophoregram (A)and histogram(B) of expression of PD-L1 protein in CAL27 cells in two groups detected by Western blotting method
2.3 2 组CAL27 细胞增殖活性和克隆形成数CCK-8 作用24、48、72 和96 h 后,与对照组比较,si-PD-L1 组CAL27 细胞增殖活性明显降低(P<0.05 或P<0.01)。平板克隆形成实验结果显示:与对照组(534.2个±4.3个)比较,si-PD-L1 组CAL27 细胞克隆形成数(257.8 个±2.5 个)明显减少(P<0.01)。见图4 和5。
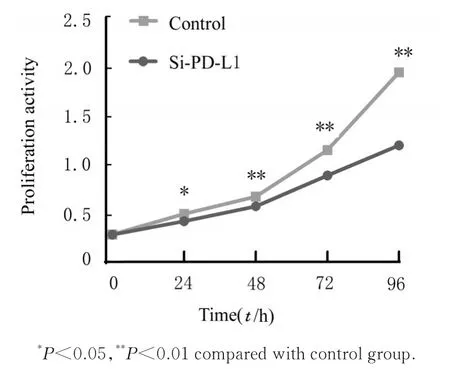
图4 CCK-8 法检测不同时间点2 组CAL27 细胞增殖活性Fig. 4 Proliferation activities of CAL27 cells in two groups at different time points detected by CCK-8 assay
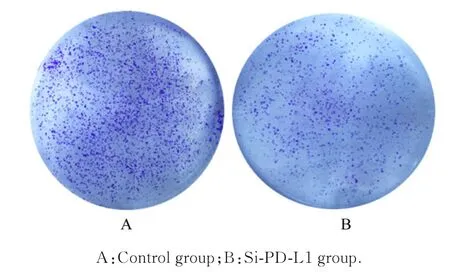
图5 平板克隆形成实验检测2 组CAL27 细胞克隆形成情况(结晶紫)Fig. 5 Clone formation of CAL27 cells in two groups detected by plate clone formation assay(Crystal violet)
2.4 2 组CAL27 细胞划痕愈合率划痕后24 和48 h,与对照组比较,si-PD-L1 组细胞划痕距离更宽,划痕面积更大,划痕愈合率明显降低(P<0.05 或P<0.01)。见图6 和7。

图6 细胞划痕愈合实验检测2 组CAL27 细胞划痕愈合情况(Bar= 200 μm)Fig. 6 Scratch healing of CAL27 cells in two groups detected by cell scratch healing assay(Bar=200 μm)
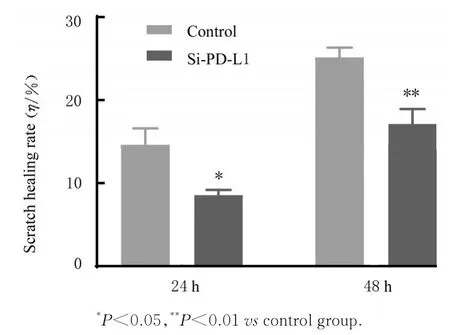
图7 2 组CAL27 细胞划痕愈合率Fig. 7 Scratch healing rates of CAL27 cells in two groups
2.5 2 组CAL27 细胞中迁移细胞数和侵袭细胞数与对照组 (274.2 个±11.4 个) 比较,si-PD-L1 组细胞中迁移细胞数(115.3 个±5.0 个)明显减少(P<0.01);与对照组(247.9个±8.2个)比较, si-PD-L1 组 细 胞 中 侵 袭 细 胞 数(154.7 个±13.7 个) 明显减少(P<0.01)。见图8 和9。

图8 Transwell 小室实验检测2 组CAL27 细胞迁移情况(结晶紫,×100)Fig. 8 Migration of CAL27 cells in two groups detected by Transwell chamber assay(Crystal violet, ×100)

图9 Transwell 小室实验检测2 组CAL27 细胞侵袭情况(结晶紫,×100)Fig. 9 Invasion of CAL27 cells in two groups detected by Transwell chamber assay (Crystal violet, ×100)
3 讨 论
近年来,尽管OCSS 在外科手术和放化疗等综合治疗方面取得了很大的进步,但OSCC 患者的预后仍较差[8]。研究OSCC 发生发展的分子生物学机制,可为OSCC 患者的治疗和预后判断提供理论依据[9]。免疫治疗逐渐成为癌症治疗的有效手段,且抗PD-1/PD-L1 治疗前景良好,PD-L1 已成为免疫肿瘤学中的关键蛋白[10-11],其与PD-1 的相互作用发生于肿瘤微环境,能够抑制下游信号传导和T 淋巴细胞多种生物学功能,包括细胞活化、增殖和分泌细胞因子等[12]。PD-L1 与肿瘤的进展有紧密关联[13],但目前关于PD-L1 在OSCC 中作用的报道较少。
为了探讨PD-L1 与OSCC 之间的关系,本研究采用Western blotting 法检测PD-L1 在3 种OSCC细胞中的表达情况,结果显示:在OSCC 细胞中PD-L1 蛋白特异性高表达;免疫荧光染色结果显示:PD-L1 蛋白在CAL27 细胞的细胞质和细胞核中均有表达,且在口腔上皮HOK 细胞中PD-L1蛋白表达较弱,提示PD-L1 有可能参与OSCC 的发生发展过程。为进一步研究PD-L1 是否影响OSCC 细胞的生物学行为,本研究利用siRNA 技术敲低CAL27 细胞中的PD-L1 表达后,细胞的增殖能力减弱,单个细胞克隆形成能力明显减弱,细胞迁移和侵袭能力均降低,本研究结果与ZHENG等[14]研究结果一致。本研究结果表明:PD-L1 通过促进细胞增殖、克隆形成、迁移和侵袭在OSCC中发挥重要作用,提示敲低PD-L1 可能是OSCC的潜在治疗方法。
PD-L1 作为B7 蛋白家族中的一员,在多种肿瘤细胞中发挥重要的调控作用[15-18]。LIU 等[19]发现:PD-L1 可促进乳腺癌细胞的生长,沉默PD-L1可导致乳腺癌细胞自发凋亡和多柔比星诱导的细胞凋亡增加。上调PD-L1 表达可促进胃癌细胞生长[20],下调PD-L1 表达后胃癌细胞的黏附、迁移和侵袭能力均减弱,并且PD-L1 在胃癌细胞中可以通过上皮-间质转化(epithelial-mesenchymal transition,EMT)促进其侵袭和迁移[21]。QU 等[22]证实:PD-L1 在卵巢癌细胞中高表达,通过特异性siRNA 敲低PD-L1 基因,可抑制卵巢癌细胞的生长和迁移,降低肿瘤的增殖、抑制肿瘤的细胞周期进展和肿瘤的侵袭。在前列腺癌中,上调PD-L1表达可以增强肿瘤微环境中的免疫抑制,从而促进癌症的发生发展[23]。
综上所述,PD-L1 在OSCC 细胞中特异性高表达,敲低PD-L1 表达可以抑制OSCC 细胞的增殖、迁移和侵袭。本研究结果为OSCC 的靶向治疗提供了理论依据,但PD-L1 调控OSCC 生物学行为的具体机制有待进一步研究。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
曾洁参与论文选题、实验设计、数据分析和论文撰写,俞雪燕和罗婷参与实验操作和数据收集,徐江参与论文中统计学分析和论文审校。
