白屈菜红碱对人卵巢癌SKOV3 细胞迁移、侵袭和上皮-间质转化的影响
2024-02-12邱智东律广富许佳明王可欣王雨辰黄晓巍
周 佳, 邱智东, 林 喆, 律广富, 许佳明, 林 贺, 王可欣, 王雨辰, 黄晓巍,3
(1. 长春中医药大学药学院临床药学与中药药理教研室,吉林 长春 130117;2. 长春中医药大学吉林省人参科学研究院中药药理组,吉林 长春130117;3. 长春中医药大学东北亚中医药研究院基础研究所,吉林 长春 130117)
卵巢恶性肿瘤是女性常见的生殖器官肿瘤之一[1]。由于卵巢组织结构复杂且周围神经分布少,卵巢肿瘤很难在发病早期监测到,60%以上患者发现即为晚期,导致卵巢癌的治愈率在妇科肿瘤中最低,致死率最高[2]。随着医学的进步,肿瘤的治疗呈现多样化和个体化,但在临床实践中,化疗、放疗和手术切除仍是卵巢癌的主要治疗手段,且上述方法普遍存在特异性差、不良反应严重和耐药性强等缺陷[3]。白屈菜红碱(chelerythrine,CHE)是一种由罂粟科植物白屈菜中提取的季铵型苯并啡啶类生物碱,具有抗炎、抗病毒和抗肿瘤作用[4-7],但其对卵巢癌细胞增殖、侵袭和转移的影响及作用机制尚未完全阐明。本研究采用转化生长因子β1(transforming growth factor-β1,TGF-β1) 诱导人卵巢癌SKOV3 细胞发生上皮-间质转化(epithelialmesenchymal transition, EMT), 探讨 CHE 对TGF-β1 诱导后的SKOV3 细胞增殖、迁移、侵袭和EMT 的影响,为抗卵巢癌新药的研发提供理论依据。
1 材料与方法
1.1 细胞、药物、主要试剂和仪器卵巢癌SKOV3细胞(武汉普诺赛生命科技有限公司)。CHE(上海源叶生物科技有限公司,批号:B20052)。胎牛血清(澳大利亚Clark 公司),RPMI 1640 培养基(美国Hyclone 公司),TGF-β1(美国Cell Signaling公司),Transwell 小室和Matrigel 基质胶(美国Corning 公司),二甲基亚砜(dimethyl sulfoxide,DMSO) 和 噻 唑 蓝 (methylthiazolydiphenyltetrazolium,MTT)(北京索莱宝科技有限公司),E-钙黏 蛋 白 (E-cadherin)、 N- 钙 黏 蛋 白(N-cadherin)、波形蛋白(Vimentin) 和β-肌动蛋白(β-actin)(武汉三鹰生物技术有限公司),Alexa Fluor 488 标记山羊抗兔IgG (H+L) 和Alexa Fluor 647 标记山羊抗兔IgG(H+L)(上海碧云天生物科技有限公司)。超净工作台(型号:SW-CJ-1FD,苏州净化设备公司),二氧化碳培养箱(型号:MCO-17AIC,美国SANYO 公司),荧光显微镜(型号:Ⅸ73,日本Olympus 公司),蛋白电泳仪(型号:BE6085,美国Bio-Rad 公司),多功能化学发光成像仪(型号:Q9-Aliance,英国UVltec 公司), 多功能微孔酶标仪(型号:Multiskan FC,美国Thermo 公司)。
1.2 细胞培养卵巢癌SKOV3 细胞采用含10%胎牛血清和1%青-链霉素的RPMI 1640 培养基在37 ℃、5% CO2孵箱中培养。
1.3 MTT 法检测各组细胞增殖抑制率取对数生长期SKOV3 细胞,以1×104mL-1密度接种于96 孔细胞培养板中,24 h 后向各组加入0、2.5、5.0、10.0、20.0 和40.0 μmol·L-1CHE,每组5 个复孔,0 μmol·L-1CHE 组为对照组,孵育24、48 和72 h 后,每孔加入10 μL MTT 溶液,4 h 后弃上清,加入150 μL DMSO 充分溶解甲臜,酶标仪测定570 nm 波长处吸光度(A)值,计算各组细胞增殖抑制率。细胞增殖抑制率= [1- (实验孔A 值-空白孔A 值) / (对照孔A 值- 空白孔A 值)]×100%。
1.4 细胞划痕实验检测各组细胞迁移率取对数生长期SKOV3 细胞,以1×105mL-1密度接种于6 孔细胞培养板中,分为对照组、TGF-β1组、TGF-β1+5 μmol·L-1CHE 组和TGF-β1+10 μmol·L-1CHE组。对照组:无血清培养基培养;TGF-β1 组:在细胞培养基中加入20 ng·L-1TGF-β1;TGF-β1+5 μmol·L-1CHE 组:在细胞培养基中分别加入20 ng·L-1TGF-β1 和5 μmol·L-1CHE;TGF-β1+10 μmol·L-1CHE 组:在细胞培养基中分别加入20 ng·L-1TGF-β1 和10 μmol·L-1CHE。干预24 h后进行实验。当细胞生长至80% 融合时,用200 μL 移液枪枪头沿小孔中轴划线,PBS 缓冲液润洗后拍照。24 h 后对同一位置再次拍照,计算细胞迁移率。细胞迁移率=(0 h 空白面积-24 h 空白面积)/0 h 空白面积×100%。
1.5 Transwell 小室实验检测各组细胞中迁移细胞数和侵袭细胞数细胞分组见“1.4”。将消化后的SKOV3 细胞用无血清培养基重悬,以2.5×105mL-1密度接种于Transwell 小室上层,每孔100 μL;下层分别加入含10%血清的培养基配制的TGF-β1、TGF-β1+5 μmo·lL-1CHE 和TGF-β1+10 μmol·L-1CHE,每孔500 μL。继续培养24 h后,PBS 缓冲液清洗小室,4%多聚甲醛固定细胞并用结晶紫溶液染色,棉签轻柔擦去小室上层细胞后,显微镜下观察并拍照计数。3 个随机选取视野的穿膜细胞数均值即为迁移和侵袭细胞数,代表细胞迁移和侵袭能力。其中,侵袭实验要提前将小室上层铺好Matrigel 基质胶,后续操作同上。
1.6 Western blotting 法检测各组细胞中EMT 相关蛋白表达水平细胞分组见“1.4”。将处于对数生长期的SKOV3 细胞以1×105mL-1密度接种于6 孔细胞培养板中,当细胞生长至80%融合时,弃上清,按照分组方法进行给药处理。24 h 后,用预冷的PBS 缓冲液洗涤细胞,每孔中加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液150 μL,细胞刮刀收集细胞,12 000 r·min-1离心5 min,得到含有细胞蛋白的上清液。BCA 蛋白浓度检测试剂盒测定蛋白质浓度并定量。进行SDS-PAGE 电泳时,凝胶浓度为12%,每孔上样量为15 μL,电泳条件为150 V、80 min;湿法转膜,转膜条件为200 mA、45 min。5%脱脂奶粉封闭2 h,TBST 洗涤后,分别加入E-cadherin、N-cadherin、Vimentin和β-actin 抗体,按照说明书比例稀释,4 ℃冰箱孵育过夜;次日回收一抗,TBST 洗涤,二抗孵育2 h,ECL 发光液显色,多功能化学发光成像仪拍照,采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 免疫荧光染色法检测各组细胞中E-cadherin 和N-cadherin 荧光强度细胞分组见“1.4”。将处于对数生长期的SKOV3 细胞以1×105mL-1密度接种于6 孔细胞培养板中,当细胞生长至80%融合时,弃上清,按照分组方法进行给药处理。24 h 后,PBS 缓冲液洗涤细胞,4%多聚甲醛固定细胞,并用0.1% Triton X-100 进行细胞打孔。5% BSA 封闭60 min 后,分别加入E-cadherin 和N-cadherin 抗体,按照说明书比例稀释,4 ℃冰箱孵育过夜。次日回收一抗,TBST 洗涤,Alexa Fluor 488 标记山羊抗兔IgG (H+L) 孵育E-cadherin 组,Alexa Fluor 647 标记山羊抗兔IgG (H+L) 孵育N-cadherin 组,荧光二抗孵育2 h,并用DAPI 染色10 min。采用荧光显微镜对荧光信号进行观察并拍照。采用Image J 软件检测荧光强度,以荧光强度表示各组细胞中E-cadherin 和N-cadherin 蛋白表达情况。
1.8 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组细胞增殖抑制率、细胞迁移率、迁移和侵袭细胞数及EMT 相关蛋白表达水平均符合正态分布并方差齐,以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组细胞增殖抑制率CHE 处理24、48 和72 h 时,与对照组比较,5.0、10.0、20.0 和40.0 μmol·L-1CHE 组细胞增殖抑制率明显升高(P<0.05 或P<0.01)。见表1。
表1 各组细胞增殖抑制率Tab. 1 Inhibitory rates of proliferation of cells in various groups(n=3,,η/%)
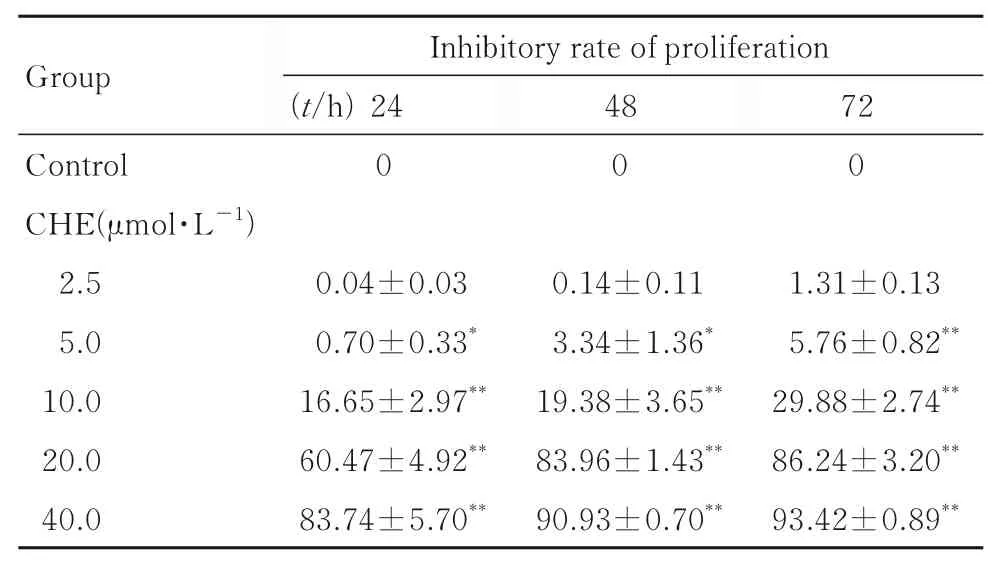
表1 各组细胞增殖抑制率Tab. 1 Inhibitory rates of proliferation of cells in various groups(n=3,,η/%)
*P<0.05,**P<0.01 vs control group.
?
2.2 各组细胞迁移率与对照组比较,TGF-β1组细胞迁移率明显升高(P<0.01);与TGF-β1 组比较,TGF-β1+5 μmol·L-1CHE 组和TGF-β1+10 μmol·L-1CHE 组细胞迁移率明显降低(P<0.01)。见图1 和表2。

图1 细胞划痕实验检测各组细胞划痕愈合情况(Bar=200 μm)Fig. 1 Scratch healing of cells in various groups detected by cell scratch assay(Bar=200 μm)
表2 各组细胞迁移率Tab.2 Migration rates of cells in various groups(n=3,,η/%)
*P<0.01 vs control group;△P<0.01 vs TGF-β1 group.
?
2.3 各组细胞中迁移细胞数和侵袭细胞数与对照组比较,TGF-β1 组细胞中迁移细胞数和侵袭细胞数明显增加(P<0.05);与TGF-β1 组比较,TGF- β 1+5 μ mol·L-1CHE 组和TGF- β 1+10 μmo·lL-1CHE 组细胞中迁移细胞数和侵袭细胞数明显减少(P<0.01)。见图2 和表3。

图2 各组细胞迁移和侵袭情况(结晶紫,Bar=200 μm)Fig. 2 Migration and invasion of cells in various groups(Crystal violet,Bar=200 μm)
表3 各组细胞中迁移细胞数和侵袭细胞数Tab. 3 Numbers of migration and invasion cells in various groups(n=3,)
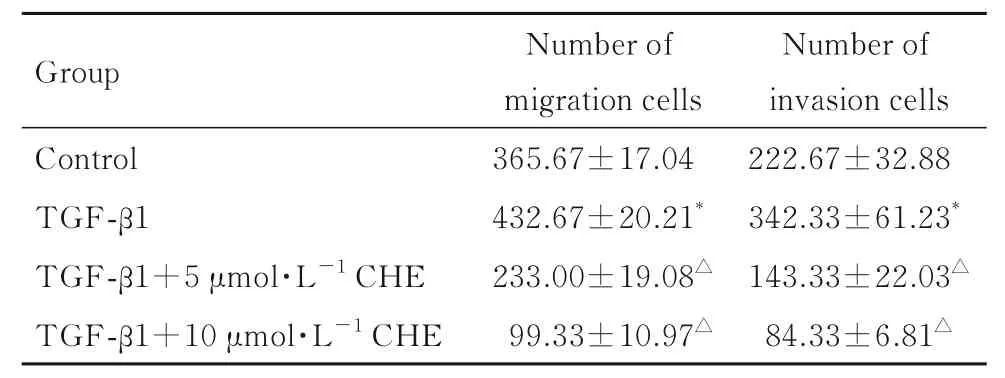
表3 各组细胞中迁移细胞数和侵袭细胞数Tab. 3 Numbers of migration and invasion cells in various groups(n=3,)
*P<0.05 vs control group;△P<0.01 vs TGF-β1 group.
?
2.4 各组细胞中EMT 相关蛋白表达水平与对照组比较,TGF-β1 组细胞中E-cadherin 蛋白表达水平明显降低(P<0.01),N-cadherin 和Vimentin蛋白表达水平明显升高(P<0.05 或P<0.01);与TGF-β1 组比较,TGF-β1+5 μmol·L-1CHE 组和TGF-β1+10 μmol·L-1CHE 组细胞中E-cadherin 蛋白表达水平明显升高(P<0.01),N-cadherin 和Vimentin 蛋白表达水平明显降低(P<0.01)。见图3 和表4。
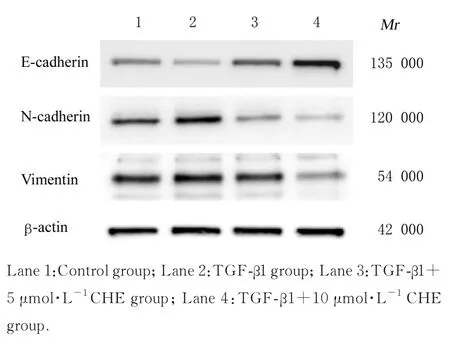
图3 Western blotting 法检测各组细胞中EMT 相关蛋白表达电泳图Fig. 3 Electrophoregram of expressions of EMT related proteins in cells in various groups
表4 各组细胞中EMT 相关蛋白表达水平Tab. 4 Expression levels of EMT related proteins in cells in various groups(n=3,)

表4 各组细胞中EMT 相关蛋白表达水平Tab. 4 Expression levels of EMT related proteins in cells in various groups(n=3,)
*P<0.05,**P<0.01 vs control group;△P<0.01 vs TGF-β1 group.
?
2.5 各组细胞中E-cadherin 和N-cadherin 荧光强度与对照组比较,TGF-β1 组E-cadherin 荧光强度明显降低,N-cadherin 荧光强度明显升高;与TGF-β1 组比较,TGF-β1+5 μmol·L-1CHE 组和TGF-β1+10 μmol·L-1CHE 组细胞中E-cadherin 荧光强度明显升高,N-cadherin 荧光强度明显降低。见图4。

图4 各组细胞中E-cadherin 和N-cadherin 荧光强度(免疫荧光,×100)Fig. 4 Fluorescence intensities of E-cadherin and N-cadherin in cells in various groups (immunofluorescence,×100)
3 讨 论
CHE 是中药白屈菜的主要活性成分之一,具有抗炎、抗菌和抗病毒等多种药理活性[8-11]。近年来研究[12-18]显示:CHE 在抗肿瘤方面表现出很强的生物活性,可以通过不同的机制广泛地抑制肿瘤细胞的增殖、迁移和侵袭,在宫颈癌、肺癌和肝癌等多种常见肿瘤中可通过促细胞凋亡、改变细胞周期、诱导自噬发生和激活线粒体凋亡等多种途径发挥抗肿瘤作用。卵巢癌是女性最致命的妇科癌症之一,由于卵巢癌临床症状隐匿和早期筛查困难,易转移和复发,其5 年生存率<50%[19-20]。虽然可以采取减瘤术结合化疗和维持治疗等综合疗法治疗卵巢癌,但多数患者会在3 年内出现复发和转移[21]。肿瘤细胞的侵袭和转移已经成为癌症患者死亡的主要因素[22]。因此,探索更多的能够有效抑制卵巢癌细胞增殖、侵袭和转移的药物,可以为其治疗提供更多选择。本研究采用MTT 法检测CHE 对卵巢癌SKOV3 细胞增殖抑制率的影响,当CHE 浓度超过5.0 μmol·L-1时,SKOV3 细胞增殖抑制率呈剂量-时间依赖性升高,表明CHE 可以抑制卵巢癌细胞增殖。
在恶性肿瘤的治疗中,除抑制细胞增殖外,阻断细胞的侵袭也是预后的决定因素之一[23]。研究[24]表明:EMT 是导致卵巢癌细胞侵袭和转移的主要原因。EMT 是一种动态且可逆的分子机制,在正常生理状态下,发挥着胚胎发生、器官发育和伤口愈合等基本生理作用。当肿瘤发生时,EMT的原始功能被肿瘤细胞利用,肿瘤的侵袭能力增加[25-27]。本研究选用EMT 强诱导剂TGF-β1 诱导卵巢癌细胞发生EMT,采用细胞划痕实验和Transwell 小室实验检测CHE 处理后SKOV3 细胞迁移和侵袭能力的变化情况,结果显示:CHE 可以抑制TGF-β1 对SKOV3 的EMT 促进作用,减少迁移和侵袭细胞数,表明CHE 能够抑制卵巢癌SKOV3 细胞的迁移和侵袭。
在肿瘤EMT 的进程中,细胞形态学发生改变,失去极性、黏性和细胞间连接,上皮标志物E-cadherin 表达水平降低, 间充质标志物N-cadherin 和Vimentin 表达水平升高[28]。E-cadherin是一种钙依赖性胞间连接蛋白,在EMT 触发时,其上游的转录因子Snail、Slug 和E 盒结合锌指蛋白(zinc finger E-box binding homeobox,ZEB) 及TGF-β 均可下调E-cadherin 的表达[29]。研究[30]表明:EMT 参与癌细胞的侵袭转移级联反应,在此阶段,癌细胞将扩散到周围的基质环境中并发生内渗,通过体液循环向远处细胞转移,导致原发癌症演变为更高级别的肿瘤。因此,抑制肿瘤的EMT过程是抑制肿瘤转移的重要手段。本研究采用Western blotting 法和免疫荧光染色法检测各组细胞中EMT 主要生物标志物的表达情况,结果显示:CHE 可以通过增加E-cadherin 表达并减少N-cadherin 和Vimentin 表达,逆转卵巢癌SKOV3细胞EMT 的进程。
综上所述,CHE 能够抑制SKOV3 细胞增殖、迁移和侵袭活性,阻止或缓解SKOV3 细胞EMT的发生。本研究结果为CHE 治疗卵巢癌的研究提供了理论依据,CHE 有望作为一种新型抗卵巢癌的药物在临床中应用,但关于其具体作用机制还有待进一步研究。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
周佳参与选题、数据收集整理和论文撰写,邱智东、林喆和黄晓巍参与指导论文撰写和提供基金资助,律广富和王雨辰参与实验操作和研究过程,许佳明和林贺参与论文审校,王可欣参与论文中数据的统计学分析。
