APOE 多态性在炎症因子诱导的神经毒性反应性星形胶质细胞中的差异作用
2024-02-12李晓慧崔理立蔡玉洁
王 岩, 李晓慧, 季 瑶, 崔理立, 蔡玉洁
(广东医科大学附属医院 广东省衰老相关心脑疾病重点实验室,广东 湛江 524001)
阿尔茨海默病(Alzheimer’s disease,AD)作为多发于老年人的以痴呆为主要症状的神经退行性疾病,是一种主要由遗传和环境等因素共同引起的复杂疾病, 其主要临床特征是渐进性记忆功能减退和认知能力下降,是危害我国老年人群健康的重大疾病[1-2]。在发病机制上,AD 是由于神经元外毒性淀粉样蛋白寡聚体和蛋白质及过度磷酸化Tau蛋白导致神经元内神经原纤维缠结、神经炎症、突触功能障碍和神经元丢失,最终导致认知功能下降[3-5]。目前已确定AD 的致病风险基因有多种[6],其中载脂蛋白E4 (apolipoprotein E4,APOE4)是目前已知的最高危致病基因。APOE4 基因存在于约15%的人群中,增加了AD 的发病风险,降低了AD 患者的发病年龄[7]。中枢神经系统中载脂蛋白E(apolipoprotein E,APOE) 主要由星形胶质细胞分泌,并通过受体介导的内吞作用将含有APOE 的脂蛋白颗粒递送至神经元,以支持膜稳态、突触完整性和损伤修复等[8]。研究[9-10]显示:神经慢性炎症对AD 发病具有重要的推动作用,活化的星形胶质细胞可分泌多种炎症因子影响AD 的病理进程。因此,研究APOE 多态性在神经毒性反应性星形胶质细胞中的差异作用对探讨AD 发病机制具有重要意义。本研究通过细胞实验分析APOE基因多态性对神经毒性反应性星形胶质细胞中产生的突触生长因子、神经损伤因子、神经营养因子和细胞凋亡的影响,为AD 提供新的治疗途径。
1 材料与方法
1.1 实验动物、主要试剂和仪器APOE 敲除(APOE-/-)小鼠购自苏州赛业生物科技有限公司,生产许可证号:SCXK (苏) 2020-0006,饲养于SPF 级动物房。本研究经广东医科大学实验动物中心动物伦理委员会批准,用于繁殖乳鼠。DMEM高糖培养基、双抗、胰酶和胎牛血清购自美国Gibco 公司,转染试剂Liposuction LTX 和白细胞介素1α(interleukin-1α,IL-1α) 购自美国Thermo 公司,补体C1q、一抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和APOE 购自美国Abcam 公司,TRIzol 购自美国Invitrogen 公司,反转录试剂盒和SYBR Green PCR 试剂盒购自日本TaKaRa 公司,载脂蛋白E3 (apolipoprotein E3,APOE3) 和APOE4 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒购自美国RB 公司,肿瘤坏死因子(tumor necrosis factor, TNF)、 一抗B 细胞淋巴瘤2 (B-cell lymphoma-2,Bcl-2)、含半胱氨酸的天冬氨酸蛋白水解酶3 (cysteinyl aspartate specific proteinase-3,Caspase-3) 和内参β-actin 购自美国CST 公司,HRP 标记的二抗购自美国Jackson 公司,荧光微珠购自美国Sigma 公司,蛋白裂解液购自上海碧云天生物科技有限公司,ECL 试剂盒购自美国密理博公司。C600 多功能荧光分子成像系统购自美国Azure Biosystems 公司,实时荧光定量PCR(realtime fluorescence quantitative PCR,RT-qPCR) 仪购自瑞士Roche 公司。
1.2 APOE-/-原代星形胶质细胞的提取、分离、培养和鉴定按照参考文献[11]中的方法,从出生1~3 d APOE-/-小鼠大脑中分离出原代皮层星形胶质细胞。将分离出的APOE-/-星形胶质细胞在含有10% 灭活胎牛血清和1%双抗的新鲜DMEM 高糖培养基中培养7~8 d,每3 d 换液1 次。待细胞长满培养瓶,180 r·min-1摇动30 min,240 r·min-1摇动6 h 除去小胶质细胞和少突胶质细胞。更换新鲜培养液培养,胰酶消化传代。星形胶质细胞的纯度通过细胞免疫荧光染色对细胞标记物GFAP 表达进行表征,显微镜下观察细胞形态表现。
1.3 质粒的构建、转染和转染效率根据APOE 蛋白112 位氨基酸的差异构建APOE3 (Cys112,Arg158)和 APOE4(Arg112,Arg158)过表达质粒。分别将空载质粒、APOE3 和APOE4 质粒转染至原代APOE-/-星形胶质细胞,分别为APOE-/-组、转染APOE3 组和转染APOE4 组,转染后48 h 在荧光倒置显微镜下观察活细胞中增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP) 表达情况。收集细胞采用Western blotting 法检测转染效率。收集细胞上清,采用ELISA 法检测各组细胞分泌至细胞外的APOE 水平。
1.4 神经毒性A1 型星形胶质细胞模型建立采用IL-1α+TNF+C1q 联合刺激星形胶质细胞建立神经毒性A1 型星形胶质细胞模型:分别转染APOE3和APOE4 过表达质粒的原代APOE-/-星形胶质细胞培养至实验需要时间,更换为含终浓度3 μg·L-1IL-1α+30 μg·L-1TNF+400 μg·L-1C1q 的新鲜DMEM 高糖完全培养基,加入等量PBS 缓冲液作为对照组,培养24 h 后荧光显微镜下观察各组(APOE3+PBS 组、APOE4+PBS 组、APOE3+IL-1α+TNF+C1q 组和APOE4+IL-1α+TNF+C1q 组)细胞形态表现,收集各组星形胶质细胞用于后续实验。
1.5 RT-qPCR 法检测各组细胞中突触生长因子、胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)、C3 和S100 钙结合蛋白 B(S100 calcium binding protein B,S100B)mRNA 表达水平细胞分组见“1.4”。 采用TRIzol 提取细胞总RNA,使用反转录试剂盒反转录合成cDNA。采用RT-qPCR 法,通过Roche 96荧光定量PCR 仪和SYBR Green PCR 试剂盒检测各组星形胶质细胞中磷脂酰肌醇蛋白聚糖4(glypican 4, Gpc4)、 磷脂酰肌醇蛋白聚糖6(glypican 6,Gpc6)、SPARC 样蛋白1 (SPARC like protein 1, Sparcl1)、 血小板反应蛋白1(thrombospondin 1,Thbs1)、血小板反应蛋白 2(thrombospondin 2, Thbs2)、 GDNF、 C3 和S100B mRNA 表达水平。引物由上海生工生物工程有限公司合成,以GAPDH 作为内参,采用2-ΔΔCt法计算目的基因mRNA 表达水平,实验重复3 次。引物序列见表1。

表1 RT-qPCR 引物序列Tab. 1 Primer sequences of RT-qPCR
1.6 ELISA 法检测各组细胞培养上清中APOE 水平收集各组细胞的培养上清, 采用APOE ELISA 检测试剂盒,按照试剂盒说明书中的方法检测星形胶质细胞分泌的APOE 水平,实验重复3 次。
1.7 Western blotting 法检测各组细胞中APOE、GFAP、Bcl-2 和Caspase-3 蛋白表达水平各组细胞处理后加入蛋白裂解液裂解离心收集总蛋白。聚丙烯酰胺凝胶电泳,转膜,5%牛奶封闭后加入APOE、GFAP、Bcl-2、Caspase-3 和β-actin 抗体,4 ℃孵育过夜,分别加入HRP 标记的二抗稀释液室温孵育1 h;采用ECL 化学发光显色试剂盒进行检测,使用C600 多功能荧光分子成像系统曝光并拍照。采用Quantity One 软件分析各蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值, 实验重复3 次。
1.8 荧光微珠吞噬实验检测各组细胞吞噬能力将荧光微珠以终浓度0.01% (V/V) 添加至新鲜的DMEM 完全培养基中,充分混匀,置于37 ℃细胞培养箱孵育1 h,随后加入各组处理的星形胶质细胞中,置于37 ℃细胞培养箱孵育3 h。用PBS 缓冲液洗涤3 次洗去多余的荧光微珠,4%多聚甲醛固定, 倒置荧光显微镜下观察,计数细胞吞噬微珠数量,代表星形胶质细胞的吞噬能力。
1.9 统计学分析采用GraphPad Prism 5.0 和Quantity One 统计软件进行统计学分析。各组细胞培养上清中APOE 水平,各组细胞中Gpc4、Gpc6、Thbs1、 Thbs2、 Sparcl1、 GDNF、 C3 和S100B mRNA 表达水平,各组细胞中APOE、GFAP、Bcl-2 和Caspase-3 蛋白表达水平,均以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 星形胶质细胞的纯化和鉴定对APOE-/-小鼠的星形胶质细胞进行提取纯化。 培养 21 d 后,荧光显微镜下观察:星形胶质细胞表现出明显的形态特征,形状不规则,边界清晰,细胞体形态丰满扁平,细胞相互连接。免疫荧光染色法检测细胞中GFAP 蛋白呈阳性表达。见图1。
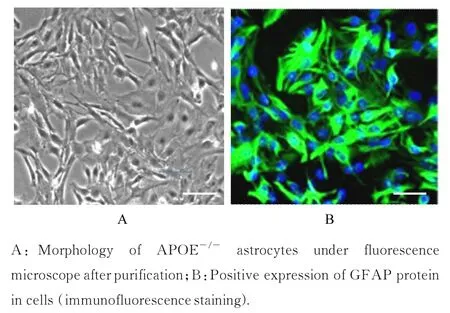
图1 星形胶质细胞的纯化和鉴定(Bar=50 μm)Fig. 1 Purification and identification of astrocytes(Bar=50 μm)
2.2 转染APOE3 和APOE4 过表达质粒后各组细胞中APOE 和GFAP 蛋白表达水平及细胞培养上清中APOE 水平EGFP-N1-APOE3 和EGFP-N1-APOE4 质粒转染至APOE-/-星形胶质细胞中,结果显示:与APOE-/-组比较,转染APOE3 组和转染APOE4 组细胞中APOE 和GFAP 蛋白表达水平明显升高(P<0.01),细胞培养上清中APOE 水平明显升高(P<0.01);转染APOE3 组和转染APOE4 组组间上述各指标比较差异无统计学意义(P>0.05)。见图2。
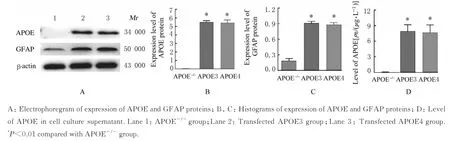
图2 Western blotting 法和ELISA 法检测各组细胞中APOE 和GFAP 蛋白表达水平及细胞培养上清中APOE 水平Fig. 2 Expression levels of APOE and GFAP proteins and level of APOE in cell culture supernatant detected by Western blotting and ELISA methods
2.3 炎症因子刺激后各组星形胶质细胞形态表现荧光显微镜观察显示:分别与APOE3+PBS组和APOE4+PBS 组比较, APOE3+IL-1α +TNF+C1q 组和APOE4+ IL-1α+TNF+C1q 组星形胶质细胞突起变短,胞体变大;与APOE3+IL-1α +TNF+C1q 组比较, APOE4+IL-1α +TNF+C1q 组星形胶质细胞突起更短。见图3。
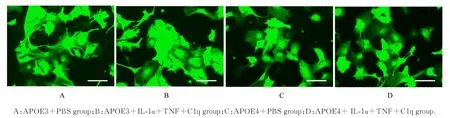
图3 荧光显微镜观察炎症因子刺激后各组星形胶质细胞形态表现(Bar=100 μm)Fig. 3 Morphology of astrocytes in various groups after stimulated with inflammatory factors observed by fluorescence microscope(Bar=100 μm )
2.4 各组星形胶质细胞中突触生长因子mRNA 表达水平分别与APOE3+PBS 组和APOE4+PBS组 比 较 , APOE3+IL-1α +TNF+C1q 组 和APOE4+IL-1α+TNF+C1q 组星形胶质细胞中Gpc4、Gpc6、Thbs1、Thbs2 和Sparcl1 mRNA 表达水平明显降低(P<0.01);与APOE3+IL-1α+TNF+C1q 组比较,APOE4+IL-1α+TNF+C1q组星形胶质细胞中Gpc4、Gpc6、Thbs1、Thbs2 和Sparcl1 mRNA 表达水平明显降低(P<0.05 或P<0.01)。见图4。
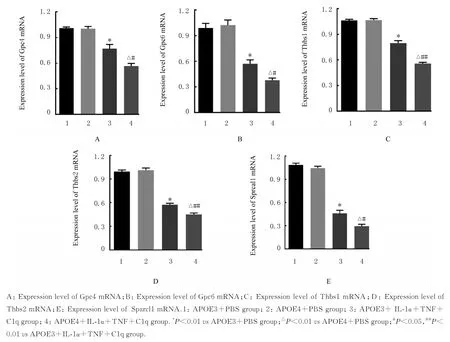
图4 各组星形胶质细胞中突触生长因子mRNA 表达水平Fig. 4 Expression levels of synaptic growth factor mRNA in astrocytes in various groups
2.5 各组星形胶质细胞中GDNF、C3 和S100B mRNA 表达水平分别与APOE3+PBS 组和APOE4+PBS 组比较,APOE3+IL-1α+TNF+C1q 组和APOE4+ IL-1α+TNF+C1q 组星形胶质细胞中GDNF mRNA表达水平明显降低(P<0.01),C3 和S100B mRNA 表达水平明显升高(P<0.01);与APOE3+IL-1α+TNF+C1q 组比较,APOE4+ IL-1α+TNF+C1q 组星形胶质细胞中GDNF mRNA 表达水平明显降低(P<0.05),C3 和S100B mRNA 表达水平明显升高(P<0.05)。见图5。
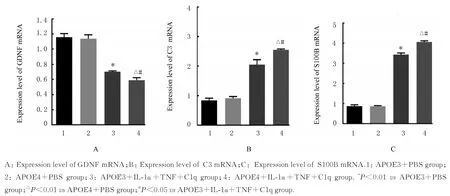
图5 各组星形胶质细胞中GDNF、C3 和S100B mRNA 表达水平Fig. 5 Expression levels of GDNF,C3, and S100B mRNA in astrocytes in various groups
2.6 各组星形胶质细胞吞噬微珠数量荧光微珠吞噬实验结果显示:分别与APOE3+PBS 组和APOE4+PBS 组比较,APOE3+ IL-1α+TNF+C1q 组和APOE4+IL-1α+TNF+C1q组星形胶质细胞吞噬微珠数量明显减少;与APOE3+IL-1α+TNF+C1q 组比较,APOE4+IL-1α+TNF+C1q组星形胶质细胞吞噬微珠数量明显减少。见图6。

图6 荧光微珠吞噬实验检测各组星形胶质细胞吞噬能力(Bar=20 μm)Fig. 6 Phagocytic abilities of astrocytes in various groups detected by fluorescence microsphere phagocytosis test(Bar=20 μm)
2.7 各组星形胶质细胞中Bcl-2 和Caspase-3 蛋白表达水平分别与APOE3+PBS 组和APOE4+PBS 组比较,APOE3+ IL-1α+TNF+C1q 组和APOE4+IL-1α+TNF+C1q 组星形胶质细胞中Bcl-2 蛋白表达水平明显降低(P<0.05 或P<0.01),Caspase-3 蛋白表达水平明显升高(P<0.01);与APOE3+ IL-1α+TNF+C1q 组比较,APOE4+IL-1α+TNF+C1q 组星形胶质细胞中Bcl-2 蛋白表达水平明显降低(P<0.01),Caspase-3 蛋白表达水平明显升高(P<0.05)。见图7。
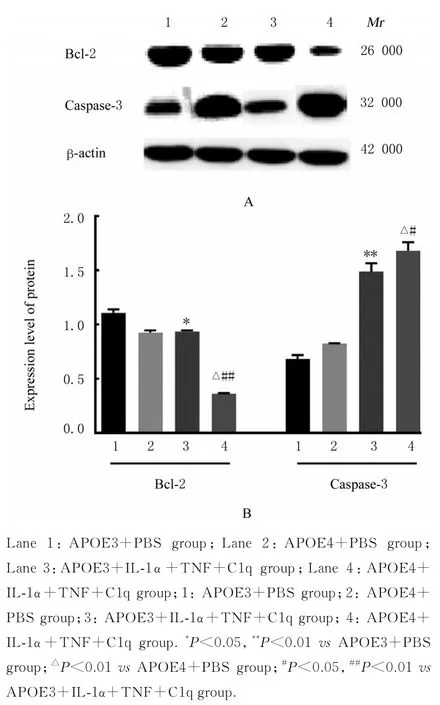
图7 Western blotting 法检测各组星形胶质细胞中Bcl-2和Caspase-3 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A) and histogram (B) of expressions of Bcl-2 and Caspase-3 proteins in astrocytes in various groups detected by Western blotting method
3 讨 论
世界卫生组织(World Health Organization,WHO) 数据[12]显示:2019 年AD 患者人数为5 500 万,预计至2050 年将增至1.39 亿。AD 患者的临床特征主要包括认知衰退、运动障碍和生活自理能力严重下降,给家庭和整个社会造成沉重的负担。因此,AD 的致病机制和药物研发一直是研究热点。
研究[13]显示:神经胶质细胞(小胶质细胞和星形胶质细胞)产生神经炎症并随着AD 的退行性进展而加重。神经毒性反应性星形胶质细胞(A1 型)获得毒性功能,同时丧失神经营养功能。星形胶质细胞功能障碍导致细胞因子和炎症介质释放增加、神经变性、谷氨酸摄取减少和神经元突触丧失,并最终导致 AD 认知缺陷[14]。神经毒性反应性星形胶质细胞是反应性星形胶质细胞的一个亚型,由 脂多糖(lipopolysaccharide,LPS)刺激而活化的小胶质细胞诱导。活化的小胶质细胞通过分泌 IL-1α、TNF 和 C1q 诱导 A1 型星形胶质细胞表型[15]。上述3 种细胞因子共同刺激可诱导 A1 型星形胶质细胞形成。星形胶质细胞可控制突触的形成、功能和消除。A1 型星形胶质细胞失去了促进突触生成和神经元存活的能力,并诱导神经元和少突胶质细胞死亡[16]。大脑中的APOE 蛋白主要由星形胶质细胞分泌[17],而A1 型星形胶质细胞随着APOE4 水平升高而增加[18]。
人APOE 的合成由3 个等位基因(ε2、ε3 和ε4)控制,产生6 种基因表型(ε2/2、ε2/3、ε2/4、ε3/3、ε3/4 和ε4/4)。 APOE 基因的 112 位和158 位氨基酸的置换可产生3 种不同的蛋白APOE2、APOE3 和APOE4,APOE2 的112 位氨基酸是半胱氨酸(cysteine,Cys),158 位氨基酸是精氨酸(arginine, Arg), APOE3 的112 位和158 位氨基酸均为Cys,APOE4 则均为Arg。结构上的区别导致了APOE2、APOE3 和APOE4 功能的不同。
本研究结果显示:由IL-1α、TNF 和 C1q 诱导的A1 型星形胶质细胞中的突触生长因子Gpc4、Gpc6、Sparcl1、Thbs1、Thbs2 和GDNF mRNA表达水平明显降低,而神经损伤标志物C3 和S100B mRNA 表达水平明显升高;与APOE3 亚型比较,APOE4 亚型变异体加重了A1 型星形胶质细胞的毒性,下调突触生长因子mRNA 表达水平,上调神经损伤标志物如C3 和 S100B mRNA 表达水平。
本研究结果表明:APOE4 基因型比APOE3 更容易诱导炎症因子导致的神经毒性反应性星形胶质细胞表型,增加神经毒性,影响星形胶质细胞的凋亡,而加剧神经元损伤。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
王岩参与实验设计和论文撰写,李晓慧参与实验研究和数据采集,季瑶参与实验操作,崔理立参与实验操作和材料整理,蔡玉洁参与数据分析、文章审阅和统计学分析。
