下调富含脯氨酸蛋白11 表达对食管癌耐药细胞EC9706/DDP耐药性的影响及其机制
2024-02-12亢春彦张秀芝周慧聪
亢春彦, 张秀芝, 周慧聪, 陈 洁
(1. 河南医学高等专科学校病理学教研室,河南 郑州 451191;2. 郑州大学第二附属医院消化内科,河南 郑州 450000)
食管癌是目前全世界最常见的癌症之一,尽管目前的医疗技术已经有很大进展,但食管癌患者5 年生存率仍然较差[1-2]。针对晚期/转移性食管癌,通常采用顺铂(cisplatin,DDP)、紫杉醇和5-氟尿嘧啶等药物进行化疗,然而对上述药物的化疗耐药性是治疗食管癌的主要障碍[3-4]。人食管癌DDP 耐药性的产生可能是食管癌临床化疗失败的重要原因[5-6]。因此,研究逆转食管癌细胞DDP 耐药的有效方法对于提高食管癌临床化疗效果具有重要价值。
研究[7]显示:富含脯氨酸蛋白11 (prolinerich protein 11,PRR11)是一种肿瘤相关蛋白,在食管癌组织中呈高表达,其表达水平与食管癌预后有密切关联。体外研究[8]证实:敲低食管癌细胞中PRR11 的表达,可抑制癌细胞的增殖、迁移和侵袭,表明PRR11 在食管癌发生发展过程中发挥重要作用。但PRR11 与食管癌DDP 耐药的关系尚未阐明。本研究通过构建食管癌DDP 耐药细胞株,采用慢病毒干扰耐药细胞中PRR11 的表达,旨在探讨下调食管癌DDP 耐药细胞中PRR11 表达对细胞耐药性的影响,为逆转食管癌DDP 耐药提供理论依据。
1 材料与方法
1.1 细胞和主要试剂人食管癌EC9706 细胞株购自中国科学院上海生命科学研究院细胞资源中心。DDP 由山东齐鲁制药有限公司生产。胎牛血清、DMEM、Lipofectamine RNAiMax 和TRIzol 试剂购自美国Ausbian 公司, MTT 购自美国APExBIO 公司,PRR11 shRNA 慢病毒及空载慢病毒由上海吉凯基因公司提供(慢病毒滴度均为2×108TU·mL-1),SYBR®Premix Ex Taq 购自宝生物工程(大连)有限公司,Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自美国eBioscience 公司,兔抗人PRR11 (ab237526)、 兔 抗 人 P- 糖 蛋 白(P-glycoprotein,P-gp)(ab235954)、兔抗人多药耐药相关蛋白1 (multidurg resistance associated protein1, MRP1)(ab260038)、 山羊抗兔IgG(ab205718) 和兔抗人GAPDH (ab181603) 抗体购自英国Abcam 公司,兔抗人磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K) p110α 抗体、兔抗人蛋白激酶B(protein kinase B,AKT)抗体和兔抗人磷酸化AKT (phosphorylated AKT,p-AKT)抗体购自美国CST 公司。
1.2 细胞培养和耐药细胞株构建采用含10%胎牛血清、100 U·mL-1青霉素和100 g·L-1链霉素的DMEM 培养基培养人食管癌EC9706 细胞株。收集对数生长期EC9706 细胞,采用DDP 浓度递增间断刺激细胞,建立DDP 耐药细胞株EC9706/DDP:从低浓度(0.05 mg·L-1)DDP 作用48 h 开始,当细胞出现死亡时,PBS 缓冲液清洗细胞,将含药培养液更换为新鲜不含药培养液;待细胞恢复正常生长,无明显死亡细胞时,加入浓度递增的DDP 作用48 h,每次增加0.05 mg·L-1,间断作用直至细胞在含0.5 mg·L-1DDP 的培养液中长期正常生存,则DDP 耐药细胞株EC9706/DDP 构建成功。
1.3 MTT 法检测EC9706/DDP 细胞药敏性分别收集对数生长期EC9706/DDP 和亲本EC9706 细胞,接种于96 孔细胞培养板中,约每孔5×103个细胞。待细胞贴壁后,弃去培养液,加入含有不同浓度(0、2、4、8、16 和32 mg·L-1)DDP 的新鲜培养液继续培养24 h。每孔加入20 μL MTT 溶液(5 g·L-1),37 ℃继续培养4 h。弃去培养液,加入100 μL DMSO,结晶溶解后,酶标仪检测490 nm波长处吸光度(A) 值。根据A 值计算DDP 对EC9706/DDP 细胞和EC9706 细胞的半数抑制浓度(50% inhibitory concentration,IC50),计算耐药指数。耐药指数=IC50(EC9706/DDP 细胞)/IC50(EC9706细胞)。
1.4 细胞转染和分组收集对数生长期EC9706/DDP 细胞,接种于6 孔细胞培养板中,待细胞贴壁且密度达到80%时进行慢病毒转染,按照感染复数50∶1 取PRR11 shRNA 慢病毒和空载慢病毒分别转染EC9706/DDP 细胞,分别为PRR11 干扰(sh-PRR11) 组和阴性对照干扰(sh-NC) 组,另取未进行病毒转染的EC9706/DDP 细胞作为对照组。慢病毒转染6~8 h 后更换新鲜培养基继续培养48 h, 采用实时荧光定量 PCR (real-time fluorescence quantitative PCR, RT-qPCR) 法和Western blotting 法检测各组细胞中PRR11 mRNA和蛋白表达水平,以验证干扰效果。此外,采用不同浓度(0、2、4、8、16 和32 mg·L-1)DDP 处理各组细胞24 h 后,采用MTT 法检测各组细胞增殖活性,并计算IC50值。
1.5 RT-qPCR 法检测各组细胞中PRR11 mRNA表达水平分别收集EC9706 细胞、EC9706/DDP细胞和转染后的3 组细胞,采用TRIzol 法提取细胞总RNA。采用反转录试剂盒合成cDNA,采用SYBR 荧光定量试剂盒进行扩增反应。反应条件:95 ℃、20 s,60 ℃、30 s,72 ℃、30 s,40 个循环。引物序列: PRR11, 上游引物 5'-GAAGCTGGCTAACATCCTG-3',下游引物5'-CTCTGGGTTATGCAGTTCTGG-3';GAPDH,上游引物5'-ATGACCCCTTCATTGACCTCA-3',下游引物5'-GAGATGATGACCCTTTTGGCT-3'。采用2-ΔΔCt法计算各组细胞中PRR11 mRNA 表达水平。
1.6 Western blotting 法检测各组细胞中PRR11、PI3K/AKT 信号通路相关蛋白和耐药相关蛋白表达水平①收集耐药EC9706/DDP 细胞及其亲本EC9706 细胞,检测细胞中PRR11 蛋白表达水平;②收集“1.4”中3 组细胞,检测各组细胞中PRR11 蛋白表达水平;③转染后的EC9706/DDP细胞分为sh-NC组、sh-NC+DDP组、sh-PRR11 组和sh-PRR11+DDP 组,其中sh-NC+DDP 组和sh-PRR11+DDP 组EC9706/DDP 细胞慢病毒转染后采用4 mg·L-1DDP 处理24 h,检测各组细胞中PI3K p110α、AKT、p-AKT、P-gp 和MRP1 蛋白表达水平。操作步骤如下:收集细胞沉淀,加入RIPA 裂解液于冰上裂解30 min, 10 000 g、4 ℃离心20 min,收集上清液。BCA 法进行蛋白定量后, 以25 μ g 蛋白的上样量进行10%SDS-PAGE 分离,将蛋白转移至硝酸纤维薄膜。采用5%脱脂奶粉室温封闭1 h。加入一抗PRR11(1∶500)、PI3K p110α(1∶1 000)、AKT(1∶1 000)、p-AKT (1∶2 000)、P-gp (1∶1 000)、MRP1(1∶1 000)和GAPDH(1∶5 000),室温孵育2 h。PBS 缓冲液洗膜3 次,加入二抗(1∶20 000),室温孵育2 h。PBS 缓冲液洗膜3 次,加入化学发光试剂,于暗室中曝光显影,分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值;p-AKT 蛋白表达水平以p-AKT/AKT 比值表示。
1.7 流式细胞术检测各组细胞凋亡率收集sh-NC 组、 sh-NC+DDP 组、 sh-PRR11 组 和sh-PRR11+DDP 组细胞,各组取1×106个细胞,加入1 mL 预冷PBS 缓冲液混匀,400 g、4 ℃ 离心5 min。收集细胞沉淀,200 μL 预冷PBS 缓冲液重悬,分别加入10 μL Annexin Ⅴ-FITC 和PI,混匀,避光孵育30 min。加入300 μL PBS 缓冲液混匀,采用流式细胞仪检测细胞凋亡率。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.8 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组细胞IC50,各组细胞中PRR11 mRNA 和PRR11、PI3K p110α、p-AKT、P-gp 及MRP1 蛋白表达水平,各组细胞凋亡率,均符合正态分布,以表示,2 组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 表示差异有统计学意义。
2 结 果
2.1 EC9706/DDP 细胞对DDP 的耐药指数EC9706 细胞和EC9706/DDP 细胞DDP 的IC50值分别为(0.96±0.11) mg·L-1和(6.85±0.14) mg·L-1,EC9706/DDP 细胞对DDP 的耐药指数为7.23±0.86。
2.2 EC9706 细胞和EC9706/DDP 细胞中PRR11 mRNA 及蛋白表达水平与EC9706 细胞(PRR11 mRNA:1.03±0.15,PRR11 蛋白:0.28±0.03 )比较,EC9706/DDP 细胞中PRR11 mRNA 表达水平(1.78±0.11) 和蛋白表达水平(0.63±0.08)均升高(P<0.05)。见图1。
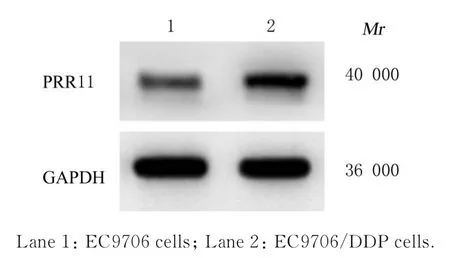
图1 Western blotting 法检测2 组细胞中PRR11 蛋白表达电泳图Fig. 1 Electrophoregram of expression of PRR11 protein in cells in two groups detected by Western blotting method
2.3 下调PRR11 基因表达后各组细胞中PRR11 mRNA 和蛋白表达水平及IC50与对照组比较,sh-NC 组EC9706/DDP 细胞中PRR11 mRNA 和蛋白表达水平差异无统计学意义(P>0.05);与sh-NC 组比较,sh-PRR11 组EC9706/DDP 细胞中PRR11 mRNA 和蛋白表达水平降低(P<0.05)。见图2。
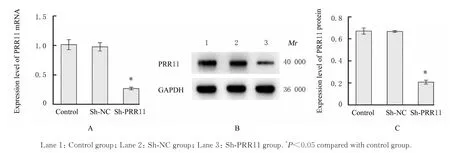
图2 各组细胞中PRR11 mRNA 表达水平(A)、PRR11 蛋白表达电泳图(B)和PRR11 蛋白表达水平(C)Fig. 2 Expression level of PRR11 mRNA (A), electrophoregram of expression of PRR11 protein (B), and expression level of RPP11 protein(C) in cells in various groups
与sh-NC 组 [(6.63±0.40)mg·L-1]比较,sh-PRR11 组 细 胞 DDP 的 IC50[ (4.39±0.21)mg·L-1]降低(P<0.05)。
2.4 下调PRR11 基因表达后各组细胞中PI3K/AKT 信号通路相关蛋白和耐药相关蛋白表达水平与sh-NC 组比较,sh-NC+DDP 组和sh-PRR11组细胞中PI3K p110α、p-AKT、P-gp 和MRP1 蛋白表达水平降低(P<0.05);分别与sh-NC+DDP组和sh-PRR11 组比较,sh-PRR11+DDP 组细胞中PI3K p110α、p-AKT、P-gp 和MRP1 蛋白表达水平降低(P<0.05)。见图3。
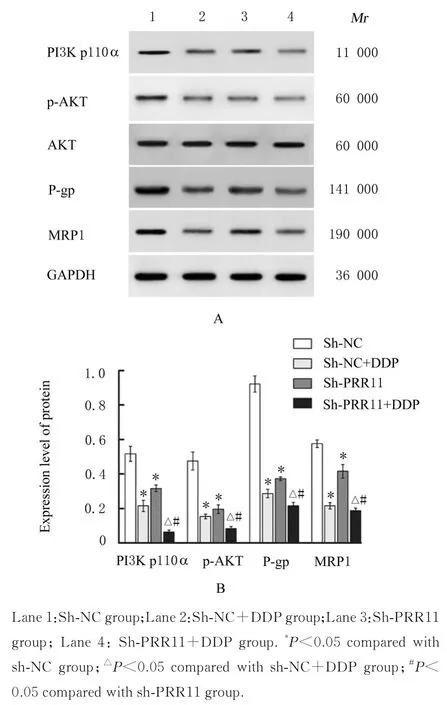
图3 Western blotting 法检测各组细胞中PI3K/AKT 信号通路相关蛋白和耐药相关蛋白表达电泳图(A)和直条图(B)Fig. 3 Electrophoregram(A) and histogram(B) of expressions of PI3K/AKT signaling pathway related proteins and drug resistance related proteins in cells in various groups detected by Western blotting method
2.5 下调PRR11 基因表达后各组细胞凋亡率与sh-NC组(2.54%±0.27%)比较,sh-NC+DDP 组和sh-PRR11 组细胞凋亡率(24.49%±1.15% 和17.05%±0.76%) 升高(P<0.05); 分别与sh-NC+DDP 组和sh-PRR11 组比较,sh-PRR11+DDP 组细胞凋亡率(42.36%±1.19%) 升高(P<0.05)。见图4。

图4 流式细胞术检测各组细胞凋亡率Fig. 4 Apoptotic rates of cells in various groups detected by flow cytometry
3 讨 论
PRR11 是位于17q22 染色体上与肿瘤相关的基因,在正常组织中其表达水平较低,但在某些肿瘤组织中呈现过度表达趋势,在多种恶性肿瘤细胞生物学行为中发挥重要作用[9-10]。研究[11]显示:抑制结直肠癌细胞中PRR11 基因的表达,可抑制癌细胞的增殖、侵袭和迁移。沉默肝癌细胞PRR11表达,可以使AKT/哺乳动物雷帕霉素靶蛋白(mammation target of rapamycin,mTOR) 信号通路失活,抑制细胞增殖和迁移,并促进细胞凋亡[12]。研究[13]显示:PRR11 表达上调可能是食管鳞状细胞癌患者生存的独立预后指标,抑制PRR11 基因表达在体内和体外均可抑制食管鳞状细胞癌细胞的迁移和浸润。上述研究表明PRR11在包括食管癌的多种癌症中发挥促癌作用。本研究从DDP 耐药角度出发,通过DDP 浓度递增间断刺激食管癌EC9706 细胞成功获得DDP 耐药细胞株EC9706/DDP,结果显示:EC9706/DDP 细胞中PRR11 mRNA 和蛋白表达水平明显高于亲本EC9706 细胞,推测PRR11 基因可能参与了食管癌细胞DDP 耐药的过程;通过RNA 干扰技术下调EC9706/DDP 细胞中PRR11 基因表达,结果显示:EC9706/DDP 细胞DDP 的IC50明显降低,证实PRR11 基因参与了食管癌细胞对DDP 的耐药。
DDP 为治疗食管癌的关键性药物之一,但化疗耐药限制了DDP 的治疗效果,提高对DDP 的敏感性是食管癌治疗的重要环节。相关研究[14-15]显示:DDP 在癌症中的作用机制可能与抑制PI3K/AKT 信号通路有关,抑制癌细胞中PI3K/AKT 信号通路的激活,有助于提高DDP 的疗效。敲除AKT3 可抑制食管癌细胞的PI3K/AKT 信号通路,降低DDP 治疗的IC50,下调耐药相关蛋白的表达,诱导细胞凋亡,提示PI3K/AKT 信号通路在食管癌细胞DDP 耐药过程中起着重要作用[16]。激活PI3K/AKT 信号通路,可上调耐药相关蛋白(P-gp和MRP1)的表达,导致DDP 对宫颈癌细胞的IC50升高,形成DDP 抗性[17]。MRP1 和P-gp 均为膜结合药物转运蛋白,下调其表达可逆转癌症的多药耐药[18]。研究[19]显示:敲除PI3K p110α 基因和PI3K p110β 基因,可降低ABC 转运蛋白的表达,从而逆转癌细胞耐药,被认为是一种降低肿瘤细胞多药耐药的有效策略。大量研究[11-12,20]显示:PRR11 表达与PI3K/AKT 信号通路有密切联系。沉默PRR11 后,AKT 磷酸化水平降低,其下游关键调节因子活性也明显降低,上调PRR11 表达后p-AKT 及下游因子表达水平明显升高,提示PRR11 可能通过激活PI3K/AKT 信号通路在肿瘤细胞中发挥作用[21]。在本研究中,DDP 干预或下调PRR11 的表达均可诱导EC9706/DDP 细胞凋亡,降低耐药相关蛋白MRP1 和P-gp 及PI3K p110α 和p-AKT 的表达水平,抑制PI3K/AKT 信号通路的活化,且二者联合作用效果更明显。
综上所述,PRR11 参与了食管癌EC9706 细胞对DDP 的耐药过程,下调PRR11 的表达,可增强耐药细胞对DDP 的敏感性,诱导细胞凋亡,PRR11 具有作为食管癌分子标志物和治疗靶点的潜在价值,其作用机制可能与抑制PI3K/AKT 信号通路的激活有关,后续将通过体内实验进一步验证。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
亢春彦参与实验设计和论文撰写,张秀芝参与统计学分析、实验指导和数据采集,周慧聪参与论文修改和论文审阅,陈洁参与实验设计和指导及提供研究经费。
