GD2抗体达妥昔单抗β治疗儿童神经母细胞瘤临床分析
2024-02-08杨帆唐汝泽赵东亮吴琳琳黄顺根卢俊
[摘"" 要]"" 目的:分析达妥昔单抗β治疗儿童高危及复发/难治性神经母细胞瘤(neuroblastoma, NB)的效果及不良反应,为NB的免疫治疗提供参考。方法:对苏州大学附属儿童医院2022年6月—2024年6月应用达妥昔单抗β治疗的6例NB患者的病例资料进行回顾性分析。结果:应用达妥昔单抗β治疗6例患者,其中男2例,女4例,中位年龄为5.54岁[四分位数(interquartile range, IQR), 3.62, 8.33岁]。高危NB 4例,复发/难治性NB 2例,在接受达妥昔单抗β治疗前,2例达到完全缓解(complete response, CR),4例达到非常好的部分缓解(very good partial response, VGPR)。6例患者治疗27个周期,随访时间185.5 d(152.25,403.75 d),5例持续缓解,1例因治疗2个周期后疾病进展停止治疗。27个周期治疗中,不良反应最早出现于治疗后5 h左右,最常见的不良反应依次为发热14例次(51.9%)、低蛋白血症13例次(48.1%)、肝功能异常12例次(44.4%)、胃肠道反应11例次(40.7%),过敏反应9例次(33.3%),疼痛6例次(22.2%),最常见的3级不良反应为发热、胃肠道反应、电解质紊乱,均经对症支持治疗后好转,无患者因不良反应终止治疗,未发生治疗相关死亡事件。结论:达妥昔单抗β可改善高危及复发/难治性NB患儿预后,但部分患儿预后不佳,仍需进一步临床研究。治疗相关不良反应总体可控,最早出现于用药后5 h左右,需做好严密监测。
[关键词]"" 神经母细胞瘤;达妥昔单抗β;双唾液酸神经节苷脂;有效性;安全性;儿童
[中图分类号]"" R739.4"""""""""""""" [文献标志码]"" A"""""""""""""" [文章编号]"" 1674-7887(2024)06-0556-05
Clinical analysis of the GD2 antibody Dinutuximab beta in pediatric neuroblastoma treatment*
YANG Fan1**, TANG Ruze1, ZHAO Dongliang1, WU Linlin1, HUANG Shungen1 , LU Jun2"""""""" (1Department of General Surgery, 2Department of Hematology and Oncology, Children s Hospital of Soochow University, Jiangsu 215000)
[Abstract]"" Objective: To analyze the clinical characteristics of the efficacy and adverse reactions of Dinutuximab beta, and provide valuable insights for immunotherapy strategies targeting high-risk relapsed and refractory neuroblastoma(NB). Methods: The clinical data of patients who received treatment with Dinutuximab beta at Children s Hospital of Soochow University were retrospectively analyzed from June 2022 to June 2024. Results: A total of 6 patients were treated with Dinutuximab beta, among whom 2 cases were male and 4 cases were female. The median age was 5.54 years[interquartile range(IQR), 3.62, 8.33 years]. 4 cases were high-risk NB, and 2 cases were relapsed/refractory NB. Before receiving Dinutuximab beta, 2 cases achieved complete response(CR), and 4 cases achieved very good partial response(VGPR). Six patients completed a total of 27 treatment cycles, with a median follow-up duration of 185.5 days(152.25, 403.75 days). Five patients achieved sustained remission, while one patient discontinued treatment due to disease progression after two cycles. The earliest adverse events were observed approximately 5 hours after the initiation of treatment during a total of 27 treatment cycles. The most frequently adverse reactions included fever(14 cases, 51.9%), hypoalbuminemia(13 cases, 48.1%), liver function abnormalities(12 cases, 44.4%), gastrointestinal reactions(11 cases, 40.7%), allergic reactions(9 cases, 33.3%), and pain(6 cases, 22.2%). The most frequently observed grade 3 adverse reactions included fever, gastrointestinal reactions, and electrolyte disturbances, all of which demonstrated improvement with symptomatic supportive treatment. No patients discontinued treatment due to adverse reactions, nor treatment-related deaths occurred. Conclusions: The administration of Dinutuximab beta has demonstrated potential in enhancing the prognosis of pediatric patients with relapsed/refractory NB; however, a subset of children still exhibits unfavorable outcomes, necessitating further investigation through clinical studies. The management of treatment-related adverse reactions is generally feasible and these reactions can manifest within 5 hours after medication initiation, necessitating close monitoring.
[Key words]"" neuroblastoma; Dinutuximab beta; disialoganglioside; effectiveness; security; child
神经母细胞瘤(neuroblastoma, NB)是儿童时期最常见的颅外实体肿瘤,占儿童恶性肿瘤的8%~10%[1],占儿童恶性肿瘤死亡的15%[2]。目前,NB的治疗基于美国儿童肿瘤学组的危险度分层评估标准,包括手术、化疗、放疗、自体干细胞移植及后续巩固维持等综合治疗,低危组和中危组NB预后良好,5年无事件生存(event-free survival, EFS)率分别达到91.3%、85.1%,但高危组预后极差,约60%的患者复发,20%的患者进展为难治性疾病,5年EFS率仅37.7%[3-4]。双唾液酸神经节苷脂(disialoganglioside, GD2)是一种表面抗原,在NB细胞中高表达,但在正常组织中呈限制性表达[5],因此成为NB免疫治疗的理想靶点。近年来研究[6-7]显示GD2抗体免疫疗法可明显改善高危和复发/难治性NB患儿的预后。2015年美国食品和药品监督管理局批准GD2抗体达妥昔单抗(ch14.18/SP 2/0)用于gt;1岁高危及复发/难治性NB患者的治疗,2017年欧洲药品管理局批准GD2抗体达妥昔单抗β(ch14.18/CHO)用于儿童高危NB的治疗,2021年8月中国国家药品监督管理局批准达妥昔单抗β在中国上市[8]。但目前国内达妥昔单抗β治疗时间较短,相关报道少,临床经验尚不足,本文回顾性分析苏州大学附属儿童医院应用达妥昔单抗β患儿的病例资料,总结其疗效及不良反应,为高危及复发/难治性NB的免疫治疗提供参考。
1"" 资料与方法
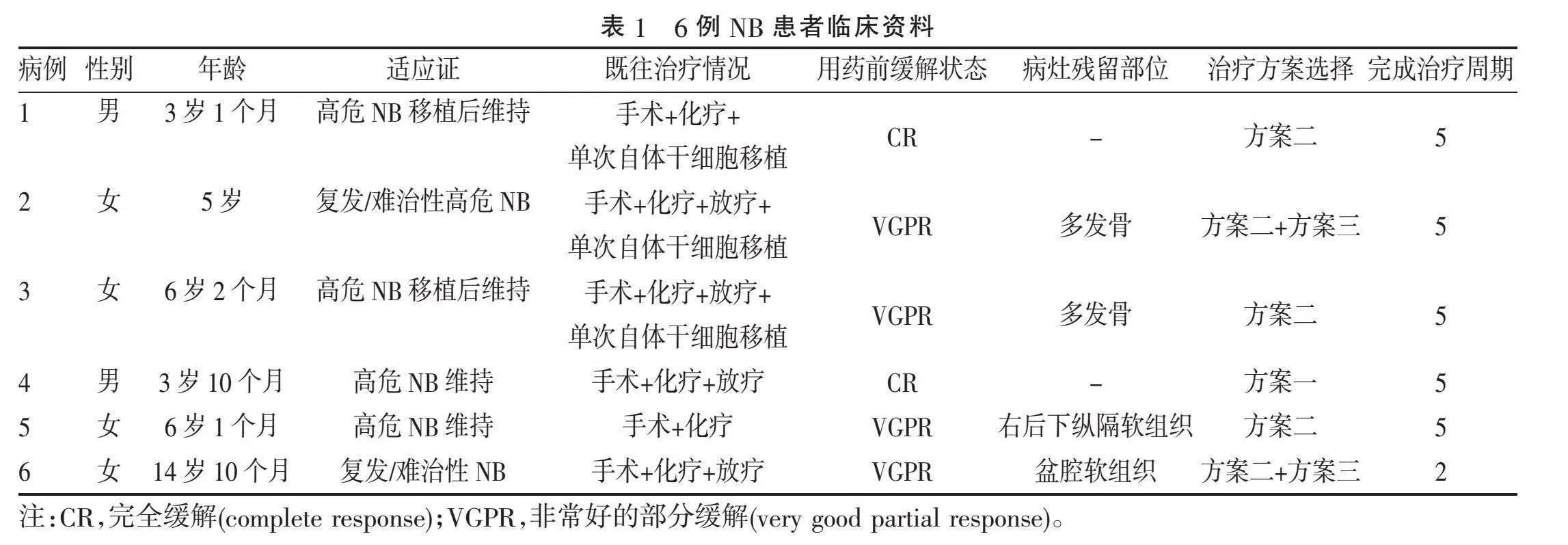
1.1"" 一般资料"" 苏州大学附属儿童医院自2022年6月—2024年6月共6例NB患儿进行达妥昔单抗β治疗,其中5例患儿均按治疗计划完成5个周期治疗,1例患儿因治疗2个周期后病情进展而停止治疗,基本临床资料见表1,具体治疗方案参照《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识(2021年版)》[9]。所有患者都自愿入组,患儿监护人在治疗前均已签署知情同意书。
1.2"nbsp; 统计学方法"" 采用SPSS 25.0软件进行统计学分析,计量资料以中位数[四分位数(interquartile range, IQR)]表示,计数资料以百分数表示。
2"" 结""""" 果
2.1"" 疗效"" 6例患儿治疗前经病情评估,病例1及病例4达到CR,病例2、病例3、病例5、病例6达到VGPR,1例患儿选择了方案一治疗,3例患儿选择了方案二,2例患儿第1周期选择方案二,后续周期选择方案三治疗。6例患儿共完成27个周期治疗,其中病例6因2个周期治疗后疾病进展停止达妥昔单抗β治疗,其余5例2个周期治疗后评估均达到CR,继续按治疗计划完成5个周期治疗,截至2024年6月,中位随访时间185.5 d(152.25, 403.75 d),5例(83.3%)患者达持续CR状态,1例(16.7%)患者疾病进展,目前予挽救化疗及靶向治疗中。
2.2"" 不良反应"" 在第1周期治疗中,6例患者均出现不同程度发热,热峰达40.8 ℃,最早于开始输注后6 h出现,平均热峰达39.7 ℃,予对症退热后好转。1例患者在开始输注后5 h左右心率增快(超过基础心率的30%~50%),伴有血压下降,予以快速扩容补液及静脉推注盐酸肾上腺素后逐渐缓解,该患者在第2疗程开始输注后7 h再次出现心率增快(超过基础心率的20%),伴血压下降,快速扩容补液后好转。有2例患者在第1周期治疗中出现典型毛细血管渗漏综合征,表现为全身水肿、低蛋白血症、多浆膜腔积液、低血压等,经积极利尿、补充白蛋白等对症支持治疗后好转,在后续周期治疗中未再出现。2例在第1周期治疗中出现呼吸系统感染(1例为重症肺炎,病原学未明确,1例为支气管肺炎,病原学明确为支原体感染),1例出现泌尿系统感染(病原学未明确),2例出现超敏C反应蛋白、降钙素原显著升高,伴发热,未明确感染部位,无患者出现感染性休克表现。
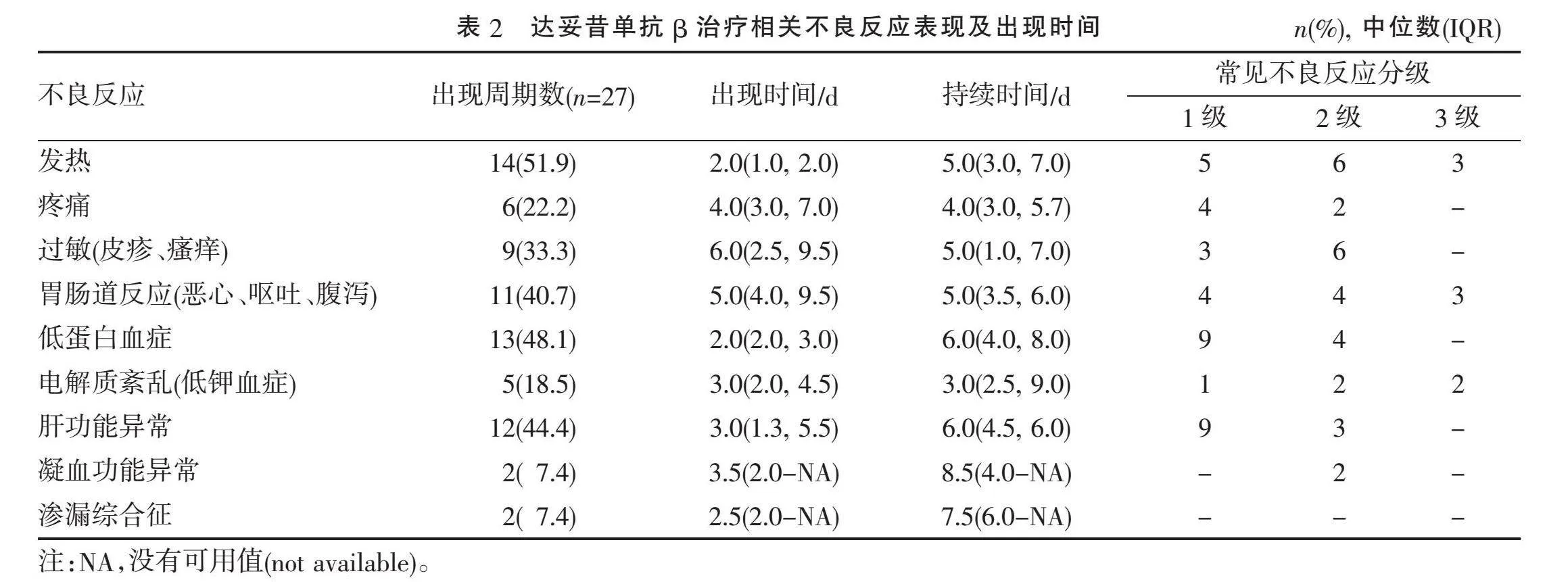
在全部27个周期治疗中,最常见的不良反应依次为发热、低蛋白血症、肝功能异常、胃肠道反应、过敏反应,均经对症支持治疗后好转。具体不良反应及出现时间、持续时间、常见不良反应等级见表2。根据常见不良事件评价标准(CTCAE)5.0版对27个周期中达妥昔单抗β所致常见不良事件进行分级,不良反应多为1~2级,有8个周期中出现了与治疗相关的3级不良反应,无4级或5级不良反应出现,最常见的3级不良反应为发热、胃肠道反应、电解质紊乱。所有不良反应经对症支持,均在治疗结束后好转,无患者因不良反应终止治疗,未发生治疗相关死亡事件。
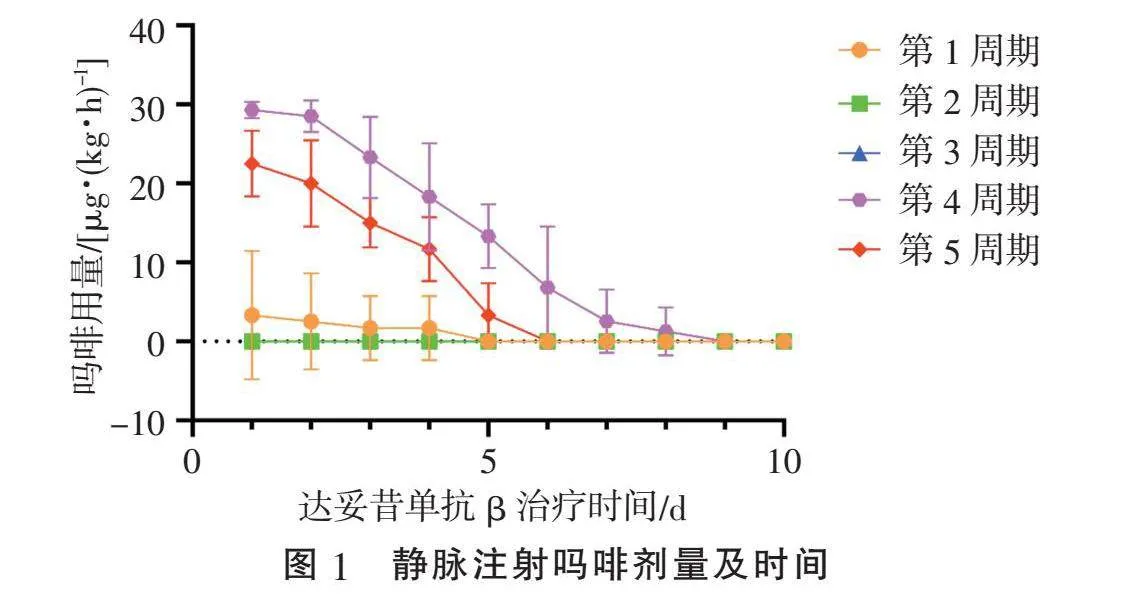
27个周期治疗中有6个周期报告疼痛,均为第1周期及第2周期出现,疼痛部位主要为腹部4例次(66.7%),四肢2例次(33.3%),根据《GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识(2021年版)》[9]静脉应用吗啡及口服加巴喷丁、布洛芬混悬液或对乙酰氨基酚混悬液联合镇痛,吗啡起始剂量最大为30 μg/(kg·h),后根据疼痛评分逐渐减量,见图1。患儿吗啡平均应用时间5.1 d,疼痛出现中位时间为治疗后第4(3, 7)天,一般为吗啡注射液减量及停用过程中出现,按照CRIES量表疼痛评分均≤4分,其中4分2例次(33.3%),3分1例次(16.7%),2分1例次(16.7%),1分2例次(33.3%),口服加巴喷丁胶囊联合布洛芬混悬液或对乙酰氨基酚混悬液均可有效缓解。
3"" 讨""""" 论
NB起源于交感神经的胚胎神经嵴细胞,起病隐匿,恶性程度高,同时具有高度异质性,部分小年龄患儿病灶可自行消退,但gt;50%的患者在初诊时已经存在远处转移[10],即使经过手术、化疗、放疗、造血干细胞移植等综合治疗,5年EFS率仍lt;40%[11],其中复发/难治性患儿4年EFS率仅为6%,总生存(overall survival, OS)率为20%[12],预后极差,对这部分患儿亟需探索新的治疗方案改善预后。
近年来,单克隆抗体、分子靶向药物及细胞免疫治疗在复发、难治的儿童恶性肿瘤中获得巨大成功,已成为现代肿瘤治疗除手术、化疗、放疗、造血干细胞移植以外的新型治疗模式。GD2在儿童NB组织中广泛表达,而在其他组织中限制性表达,因此被认为是NB免疫治疗的理想靶点。达妥昔单抗β为我国首个上市的靶向GD2的单克隆抗体,已有多项临床研究确定其有效性[13-15],在SIOPEN试验(HR-NBL1)中评估了378例使用达妥昔单抗β和466例未使用达妥昔单抗β治疗高危NB患儿的5年EFS率与OS率,结果显示两组间患儿5年EFS率为57% vs 42%(P<0.001),5年OS率为64% vs 50%(P<0.001)[16]。2020年我国在海南和天津医疗先行区开展了达妥昔单抗β临床用药研究[8],共纳入了37例高危复发/难治性NB患儿,6例(16%)患儿预后改善,包括1例由部分缓解(partial response, PR)达CR,2例由PR改善为VGPR,3例VGPR患者获得了CR;27例(73%)患者的疾病状态维持不变,包括23例CR,4例PR;4例(11%)患者治疗失败,其中2例疾病进展,2例复发,客观缓解率达89.2%,CR率达72.9%,明显改善了高危NB患儿预后。本研究6例患者中有5例达到CR,1例疾病进展,该例疾病进展患儿基因检测提示存在细胞周期蛋白依赖性激酶(cyclin-dependent kinase 4, CDK4)及双微体同源基因2(mouse double minute 2, MDM2)扩增,有研究[17-18]表明MDM2基因在恶性肿瘤的发展中起到癌基因的作用,能够促进肿瘤细胞增殖和转移,直接导致疾病进展。此外,MDM2在调节肿瘤微环境和影响免疫细胞方面发挥关键作用,最终介导免疫耐受和逃避,尤其是MDM2基因扩增的患者在恶性肿瘤免疫治疗后出现疾病超进展的风险很高,导致生存率大幅下降,已被确定为接受免疫治疗的恶性肿瘤患者预后不良的生物标志物[19-20]。因此考虑存在MDM2扩增的患儿可能免疫治疗效果不佳,但目前病例数少,仍需进一步临床研究。
达妥昔单抗β可有效提高复发/难治高危NB患儿的预后,但也会诱发一系列不良反应,SIOPEN研究[21]中报道的最常见的3、4级不良事件包括疼痛、发热、超敏反应/过敏、毛细血管渗漏综合征、腹泻和肝酶升高,且大多数不良事件发生在达妥昔单抗β治疗期间,在输注结束时缓解。H.L.LODE等[22]研究纳入了40例高危复发/难治性NB患儿行达妥昔单抗β治疗,结果显示13例(32%)患者出现了与治疗相关的3级毒性反应,最常见的3级毒性反应为神经性疼痛、腹泻和低钾血症,未报告4级或5级不良反应,且不良反应主要出现在第1周期,后续治疗周期不良反应发生率明显降低;王冬等[23]报道达妥昔单抗β所致不良反应发生率最高的为发热与疼痛,常见电解质紊乱和低蛋白血症,且不良反应发生时间不同,主要集中在首次给药后3.5~6.5 d,最早不良反应可发生在给药后的5 h左右。本研究6例患儿共完成27个周期治疗,不良反应多为1~2级,最常见的3级不良反应为发热、胃肠道反应、低钾血症,不良反应最早开始于输注后5~6 h,与上述报道相符。1例患者在第1周期开始治疗后5 h左右出现心动过速伴低血压,予盐酸肾上腺素治疗后缓解,在第2个周期开始治疗后7 h左右再次出现心动过速伴低血压,扩容补液后好转,考虑为达妥昔单抗β治疗相关的过敏性休克,过敏性休克可能在治疗期间的任何时间发生,但在治疗开始后的几分钟至几个小时内发生概率更高,危及生命。肾上腺素是治疗过敏性休克的首选药物,可迅速收缩血管,提升血压并降低毛细血管通透性,但达妥昔单抗β相关的过敏性休克为分布性休克,有效循环血容量减少,单纯使用肾上腺素维持血压不足以保障器官的有效灌注,晶体液快速补液可起到扩容及稳定血压的作用,可在较短时间内稳定循环,缓解循环系统的过敏症状,因此在治疗前应确保床旁急救药品准备,做好重度不良反应的应急预案,同时应保证足够的液体维持。开始输注后短期内应密切监测患儿生命体征,及时干预。
GD2不仅在NB中表达,在中枢和外周神经系统的神经细胞中也有表达,因此全身性使用达妥昔单抗β可能激活GD2表达的外周感觉神经纤维的补体级联反应而引起严重的神经性疼痛[24],疼痛部位最常为四肢、腹部、背部、胸部或关节[8, 13, 25],且疼痛主要出现在第1周期及第2周期。本单位27个周期治疗中有6个周期报告疼痛,均为第1周期及第2周期出现,疼痛部位主要为腹部及四肢,疼痛的比例较相关文献[8, 21]报道低,一方面可能与本研究样本量少有关,另一方面可能得益于治疗过程中有效的疼痛管理。神经病理性疼痛常规镇痛药物治疗效果欠佳,需要非阿片类药物、加巴喷丁及阿片类药物三联镇痛,根据文献[9, 11]报道及治疗经验,应在第1、2周期治疗中积极使用三联镇痛疗法快速控制疼痛,但阿片类药物存在嗜睡、恶心、呕吐、吞咽困难、便秘、尿潴留等不良反应。本研究在治疗过程中2例患儿出现嗜睡,1例患儿出现尿潴留,均考虑阿片类药物吗啡注射液药物不良反应,需注意根据疼痛评分尽早减量应用,在第1、2周期可考虑5 d内停用,第3周期起可停用阿片类药物,仅予加巴喷丁及非阿片类药物控制疼痛,并不断完善疼痛管理方案,在有效控制疼痛的基础上减少药物不良反应。
达妥昔单抗β在我国上市时间短,价格昂贵,缺乏真实世界多中心、大样本研究的相关报告,临床对该药物的不良反应认知尚不充分,本研究拟提供该药物临床应用的相关资料以提供参考,但仍存在若干局限性,包括样本量小、治疗方案一致性不高、为回顾性研究且随访时间较短,研究结果可能存在一定的偏倚,今后将进一步扩大样本量,并研究其远期疗效及长期安全性。
综上所述,达妥昔单抗β可改善高危及复发/难治性NB患儿预后,但部分患儿预后不佳,仍需进一步临床研究。不良反应总体可控,最早出现于用药后几个小时,需做好严密监测。
[参考文献]
[1]"" SWIFT C C, EKLUND M J, KRAVEKA J M, et al. Updates in diagnosis, management, and treatment of neuroblastoma[J]. Radiographics, 2018, 38(2):566-580.
[2] ""STELIAROVA-FOUCHER E, COLOMBET M, RIES L A G, et al. International incidence of childhood cancer, 2001-10: a population-based registry study[J]. Lancet Oncol, 2017, 18(6):719-731.
[3]"" IRWIN M S, NARANJO A, ZHANG F F, et al. Revised neuroblastoma risk classification system: a report from the children s oncology group[J]. J Clin Oncol, 2021, 39(29):3229-3241.
[4]"" SHOHET J, FOSTER J. Neuroblastoma[J]. BMJ, 2017, 357:j1863.
[5]"" CHAN G C, CHAN C M. Anti-GD2 directed immunotherapy for high-risk and metastatic neuroblastoma[J]. Biomolecules, 2022, 12(3):358.
[6]"" YU A L, GILMAN A L, OZKAYNAK M F, et al. Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma[J]. N Engl J Med, 2010, 363(14):1324-1334.
[7]"" LADENSTEIN R, P TSCHGER U, VALTEAU-COUANET D, et al. Interleukin 2 with anti-GD2 antibody ch14.18/CHO(dinutuximab beta) in patients with high-risk neuroblastoma(HR-NBL1/SIOPEN): a multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19(12):1617-1629.
[8]"" 袁晓军, 钱晓文, 李杰, 等. GD2单抗治疗中国高危及复发难治神经母细胞瘤儿童的临床研究初探[J]. 中华转移性肿瘤杂志, 2022, 5(1):14-20.
[9]"" GD单抗治疗神经母细胞瘤临床应用协作组. GD2抗体达妥昔单抗β治疗神经母细胞瘤的临床应用专家共识(2021年版)[J]. 临床儿科杂志, 2022, 40(1):14-20.
[10]nbsp;" ARMIDEO E, CALLAHAN C, MADONIA L. Immunotherapy for high-risk neuroblastoma: management of side effects and complications[J]. J Adv Pract Oncol, 2017, 8(1):44-55.
[11]"" 袁晓军. 双唾液酸神经节苷脂单克隆抗体治疗儿童高危和复发/难治性神经母细胞瘤研究进展[J]. 世界临床药物, 2022, 43(8):967-974.
[12]"" LONDON W B, BAGATELL R, WEIGEL B J, et al. Historical time to disease progression and progression-free survival in patients with recurrent/refractory neuroblastoma treated in the modern era on children s oncology group early-phase trials[J]. Cancer, 2017, 123(24):4914-4923.
[13]"" VALTEAU-COUANET D, MINARD-COLIN V, PASQUALINI C. Neuroblastome de haut risque: place actuelle et perspectives de l utilisation des anticorps monoclonaux anti-GD2[J]. Med Sci, 2019, 35(12):997-1000.
[14]"" MUELLER I, EHLERT K, ENDRES S, et al. Tolerability, response and outcome of high-risk neuroblastoma patients treated with long-term infusion of anti-GD2 antibody ch14.
18/CHO[J]. MAbs, 2018, 10(1):55-61.
[15]"" GILJEVI "J S, RAJA I "N, MIKULI "D, et al. Dinutuximab beta in children with high-risk neuroblastoma: experience from a single center in Croatia[J]. Children(Basel), 2022, 9(7):943.
[16]"" LADENSTEIN R, P TSCHGER U, VALTEAU-COUANET D, et al. Investigation of the role of dinutuximab beta-based immunotherapy in the SIOPEN high-risk neuroblastoma 1 trial(HR-NBL1)[J]. Cancers(Basel), 2020, 12(2):E309.
[17]"" WU J, GOU W, WANG Z, et al. Discovery of the radio-protecting effect of Ecliptae Herba, its constituents and targeting p53-mediated apoptosis in vitro and in vivo[J]. Acta Pharm Sin B, 2023, 13(3):1216-1230.
[18]"" SUN D, FENG F, TENG F, et al. Multiomics analysis revealed the mechanisms related to the enhancement of proliferation, metastasis and EGFR-TKI resistance in EGFR-mutant LUAD with ARID1A deficiency[J]. Cell Commun Signal, 2023, 21(1):48.
[19]"" FANG W F, ZHOU H Q, SHEN J Y, et al. MDM2/4 amplification predicts poor response to immune checkpoint inh-ibitors: a pan-cancer analysis[J]. ESMO Open, 2020, 5(1):e000614.
[20]"" SUN D T, QIAN H L, LI J L, et al. Targeting MDM2 in malignancies is a promising strategy for overcoming resistance to anticancer immunotherapy[J]. J Biomed Sci, 2024, 31(1):17.
[21]"" LADENSTEIN R L, POETSCHGER U, VALTEAU-COU-ANET D, et al. Randomization of dose-reduced subcutaneous interleukin-2(scIL2) in maintenance immunotherapy(IT) with anti-GD2 antibody dinutuximab beta(DB) long-term infusion(LTI) in front-line high-risk neuroblastoma patients: Early results from the HR-NBL1/SIOPEN trial[J]. J Clin Oncol, 2019, 37(15_suppl):10013.
[22]"" LODE H N, EHLERT K, HUBER S, et al. Long-term, continuous infusion of single-agent dinutuximab beta for relapsed/refractory neuroblastoma: an open-label, single-arm, phase 2 study[J]. Br J Cancer, 2023, 129:1780-1786.
[23]"" 王冬, 李莹, 李杰, 等. 8例达妥昔单抗β所致不良反应的回顾性分析[J]. 中国新药杂志, 2022, 31(13):1340-1344.
[24]"" KEYEL M E, REYNOLDS C P. Spotlight on dinutuximab in the treatment of high-risk neuroblastoma: development and place in therapy[J]. Biologics, 2019, 13:1-12.
[25]"" 李翠雅. 8例高危神经母细胞瘤患儿应用GD2单抗联合细胞因子治疗的护理[J]. 天津护理, 2023, 31(3):317-320.
[收稿日期] 2024-08-18
