均苯三甲酸辅助合成CuZnAlZr催化CO2加氢制甲醇
2024-02-02刘晨龙徐成华邓志勇赵治华杨方璐唐静怡
罗 晶,刘晨龙,徐成华,邓志勇,赵治华,杨方璐,唐静怡
(成都信息工程大学 大气环境模拟与污染控制四川省高校重点实验室,四川 成都 610225)
CO2的大量排放可能会导致极端天气、海平面上升和冰川融化等气候问题,最终威胁到人类的生存与发展[1]。为缓解环境压力,满足碳中和时代发展需求,将CO2催化转化为CH4、甲醇、甲酸、低碳烯烃和芳烃等化学增值品越来越受到学者们关注[2-8]。其中,甲醇可作为基础原料合成甲醛、甲缩醛、醋酸和碳酸二甲酯等一系列下游化工产品,也是一种液体燃料添加剂,发展潜力巨大[9-11]。
目前,工业合成气制甲醇的传统催化剂为Cu-ZnO-Al2O3[12-13]。但Cu 基催化剂普遍存在金属分散度较低、高温易烧结和活性较低等问题。研究发现,向Cu-ZnO-Al2O3催化体系中引入助剂ZrO2有助于提高其在CO2加氢制甲醇过程中的催化加氢性能,其原因在于助剂的引入可增加活性组分Cu的分散度,从而生成更多较小的Cu 晶粒,改善催化性能[5,14-17]。另外,也有研究发现,若在催化剂前驱体浆料制备阶段引入硼氢化钠或甲醛等还原性物质进行预处理,将前驱体中的Cu物种转化为低价态的Cu 物种如Cu+、Cu0,在催化剂焙烧阶段,低价态的Cu 物种与载体氧化物如Al2O3、ZnO 或ZrO2之间的相互作用较高态的Cu2+要弱,有利于活性组分Cu的分散,最终可获得Cu 分散度高、晶粒较小的高活性加氢催化剂[18-19]。QⅠ等[20]采用水热合成法,向催化剂合成体系中引入均苯三甲酸(BTC),试图与活性组分Cu和Zn物种先进行络合,以使所得到的Cu-ZnO-Al2O3催化剂具有高度分散的Cu物种。结果表明,所获得的催化剂不但具有Cu物种分散度高的特征,同时还会生成丰富的Cu-ZnOx界面,其在CO2加氢制甲醇反应中具有高催化活性与稳定性。
然而,采用水热合成法制备催化剂存在制备条件严苛、反应产物不易分离纯化且收率较低等缺点。因此,本文采用工艺简单的共沉淀法合成CuZnAlZr催化剂前驱体,并向前驱体浆料中引入BTC辅助,以期获得Cu晶粒小、分散度高的CO2加氢制甲醇催化剂。对比焙烧气氛对CuZnAlZr 催化剂催化性能的影响,并结合X射线衍射(XRD)、N2O-H2滴定、N2吸/脱附、H2程序升温还原(H2-TPR)、X射线光电子能谱(XPS)、扫描电子显微镜(SEM)和透射电子显微镜(TEM)等表征结果,深入研究BTC的引入在改善催化剂理化性质和催化性能方面的作用机制。
1 实验部分
1.1 实验原料与试剂
本文用水为实验室自制蒸馏水;三水合硝酸铜(Cu(NO3)2·3H2O)、硝酸锌(Zn(NO3)2·6H2O)、硝酸铝(Al(NO3)3·6H2O)、甲醛(FA)、硝酸(65%,HNO3)、氢氧化钠(NaOH)、碳酸钠(Na2CO3)和甲醇(CH3OH)均购于成都市科隆化学品有限公司,分析纯;碱式碳酸锆(Zr(OH)2CO3·ZrO2)和均苯三甲酸(C9H6O6)购于上海阿拉丁生化科技股份有限公司,分析纯;H2(99.99%,体积分数)、CO2(99.99%)、N2(99.99%)、5%H2-95%N2、He(99.99%)、Ar(99.99%)和N2O(99.99%)均购于成都和平气体贸易中心。
1.2 催化剂制备
采用共沉淀法制备CuZnAlZr 前驱体,n(Cu2+)/n(Zn2+)/n(Al3+)/n(Zr4+) = 1.5/1.0/0.8/0.2[5,19]。首先将3.0847 g Zr(OH)2CO3·ZrO2溶于7.5 mL HNO3,在搅拌过程中依次加入36.2400 g Cu(NO3)2·3H2O、29.7490 g Zn(NO3)2·6H2O 和30.0104 g Al(NO3)3·6H2O,溶解后得到金属离子溶液(总金属离子浓度为1 mol/L);在搅拌条件下,用蠕动泵分别将金属离子溶液和混碱溶液(0.6 mol/L NaOH-0.4 mol/L Na2CO3)同时滴加到烧杯中,进行共沉淀反应,反应温度70 °C。调节两种溶液的滴速控制浆料pH 为9.0。BTC 引入方式:根据n(BTC)/n(Cu2+)称取BTC,溶于混碱溶液,其中n(BTC)/n(Cu2+)分别为1/9、1/6、1/3和1/1。共沉淀结束后,将甲醛溶液(37%,n(FA)/n(Cu2+) = 4/1)滴加到所得浆液中,继续搅拌2 h,老化12 h 后,蒸馏水洗涤至pH 中性。过滤,所得滤饼在真空烘箱中60 °C下干燥24 h,所得前驱体命名为CZAZ-xBTC(x为n(BTC)/n(Cu2+))。CZAZ-xBTC 于马弗炉(空气焙烧)或在N2保护下的管式炉中650 °C焙烧5 h,升温速率5 °C/min,所得催化剂命名为CZAZ-xBTC-y(y为空气(air)或N2)。
1.3 催化剂表征
XRD测试:在DX-2700BX X射线衍射仪(辽宁丹东浩元仪器有限公司)上测试样品的晶体结构。测试条件:Cu Kα(波长λ= 0.15406 nm)光源,管电流30 mA、管电压40 kV。
N2O-H2滴定:在PCA-1200化学吸附分析仪(北京彼奥德电子技术有限公司)上测定样品表面Cu的分散度和金属表面积。将0.1 g 样品在300 °C 的H2中还原1 h 后用Ar 吹扫冷却,再暴露于30 mL/min的N2O 中确保将Cu0完全氧化为Cu+;在250 °C 下,多次脉冲H2,使Cu+完全还原为Cu0。根据H2消耗量计算样品的Cu分散度、金属表面积和Cu粒径[21]。
N2吸/脱附测试:在SSA-4200 孔径及比表面积分析仪(北京彼奥德电子技术有限公司)上进行。首先样品在150 °C 下真空干燥2 h 脱除水分,称量以获得样品净重,之后在-196 °C下进行N2的吸附与脱附,获得吸/脱附等温曲线。根据相对压力(p/p0)在0.05~0.35 内的吸附等温线,采用Brunauer-Emmett-Teller(BET)方法计算样品的比表面积;根据脱附等温线,采用Barret-Joyner-Halenda(BJH)方法计算样品的总孔孔容。
H2-TPR测试:在PCA-1200化学吸附分析仪(北京彼奥德电子技术有限公司)上进行测试。0.1 g样品在30 mL/min的Ar气流中,经300 °C预处理30 min,冷却到室温后通入30 mL/min 的5%H2-95%N2混合气,吹扫30 min 后,程序升温以10 ℃/min 从室温至600 °C,采用热导检测器(TCD)检测H2的消耗量。
XPS 测试:在Thermo ESCALAB 250Xl X 射线光电子能谱仪(赛默飞世尔科技(中国)有限公司)上分析。激发源为Al-Kα(1486.8 eV),管电压15 kV、管电流10 mA。以C 1s(284.8 eV)校正元素的电子结合能。
SEM 和TEM 测试:分别在Zeiss Gemini 300 扫描电子显微镜(蔡司科技有限公司)和JEM 2800F透射电子显微镜(日本电子株式会社)上进行。样品充分研磨后分散于无水乙醇中超声30 min,取部分液体于铜网上,SEM和TEM的工作电压分别为3 kV和200 kV。
1.4 催化活性评价
在固定床反应装置中评价所得催化剂在CO2加氢制甲醇反应中的催化性能。称取4 g 催化剂(20~40目)置于反应管(ϕ内= 1.2 cm)中部(催化剂床层两端均用石英砂填充),在300 °C下经50 mL/min的H2还原2 h后,按比例通入反应气H2和CO2,升压并开始反应计时。加氢反应条件:250 °C、3 MPa、n(H2)/n(CO2) = 3/1、气体时空流速(GHSV) = 5400 h-1。反应尾气中的H2、CO、CO2和CH4采用气相色谱仪(色谱柱:TDX-01,检测器为TCD)进行在线分析,每隔1 h采样直至尾气中各组分趋于稳定,取5次尾气含量数据的平均值计算反应活性数据;在线反应12 h后,收集液相产物并经在装有DNP-TWEEN-80色谱柱、TCD检测器的气相色谱仪上采用外标法对液相产物中的CH3OH和H2O含量进行离线分析。
反应的CO2转化率、CO 选择性、CH4选择性和CH4OH选择性根据碳平衡计算得到,计算公式分别见式(1)、式(2)、式(3)和式(4)。采用称重法由式(5)计算甲醇时空产率(STY)。
式中,XCO2为CO2的转化率,%;Min和Mout分别表示反应前、后CO2的浓度,mol/L;SCO为CO 选择性,%;SCH4为CH4选择性,%;MCO和MCH4分别表示某时刻CO 和CH4的浓度,mol/L;SMeOH为甲醇选择性,%;STY为甲醇时空产率,g/(kg·h);ml为液相产物质量,g;XMeOH为甲醇的质量分数,%;mcat为催化剂质量,g;t为反应时长,h。
2 结果与讨论
2.1 催化剂表征结果分析
2.1.1 XRD分析
图1 为不同BTC 用量辅助合成的CuZnAlZr 前驱体(CZAZ-xBTC)的XRD 谱图。所有样品在2θ=11.7°、23.6°、34.6°、39.3°、47.6°、53.0°、59.9°和61.4°处出现了类水滑石层板结构[Cu3Zn3Al2(OH)16CO3·4H2O]的特征衍射峰(PDF No. 37—629)。当浆料中BTC引入量为n(BTC)/n(Cu2+) = 1/6时,所得CZAZ-1/6BTC(PDF No. 2—345)前驱体只含类水滑石结构的晶相;而BTC 引入量过低或过高时,前驱体中还出现了CuCO3·Cu(OH)2晶相,这可能是由于浆料中的Cu2+游离出来直接与CO2-3和OH-反应生成的CuCO3和Cu(OH)2物种而引起的,从而使部分Cu2+难以进入水滑石层板结构中。这说明适量BTC引入有助于具有类水滑石结构的CuZnAlZr催化剂前驱体形成[22-23]。
在明星表演、动感音乐的带动下,现场的年轻人激情释放,一直持续到凌晨1时才稍稍平静。街上虽说车水马龙,但是没有推搡,秩序井然。人们有序地离开101大楼周围,随手带走自己制造的垃圾,自动在每个捷运的入口排好队。至此,活动尚未结束,民众会纷纷聚集在阿里山等多个标志性看日出的景点,为清晨的新年第一缕曙光而雀跃,祈盼来年有个“好彩头”。

图1 CZAZ-xBTC前驱体的XRD谱图Fig. 1 XRD patterns of CZAZ-xBTC precursors
在空气中经650 °C 焙烧后的CZAZ-xBTC-air催化剂的XRD 谱图如图2(a)所示。所有样品在2θ= 35.6°、38.8°、48.8°和73.5°出现CuO的特征衍射峰(PDF No. 2—1040),并在2θ= 31.4°、34.4°和36.5°出现ZnO 的特征衍射峰(PDF No. 1—1136)[24]。并且,随着BTC引入量增加,CuO和ZnO的衍射峰强度先增加后下降。当BTC引入量为n(BTC)/n(Cu2+) = 1/6时,所得CZAZ-1/6BTC-air 催化剂的CuO 和ZnO 的衍射峰信号最强。这是因为此条件下得到的前驱体中类水滑石结构的晶型和结晶度最好,且类水滑石层板上的大部分Cu 物种在甲醛作用下都以低价态Cu+的形式存在,在焙烧过程中,前驱体中的类水滑石层板被破坏,但低价态Cu+与所形成Al2O3、ZnO和ZrO2氧化物之间的相互作用力较Cu2+低,从而抑制了CuO-Al2O3等金属氧化物固溶体形成,而生成更多的游离金属氧化物物种[19]。此外,在焙烧时,催化剂中BTC的分解会消耗空气中的O2,且生成的气体,如CO2、还原性气体CO,也有助于抑制Cu+氧化生成Cu2+。这从N2气氛中焙烧所得CZAZ-xBTC-N2催化剂给出的CuO 和ZnO 的衍射峰强度变化趋势(图2(b))可进一步得到证实。比如当BTC引入量为n(BTC)/n(Cu2+) = 1/1时,所得CZAZ-1/1BTC-N2样品显示出很强的金属Cu0衍射信号,这是大量BTC在缺氧条件下分解会生成更多还原性气体CO所致。
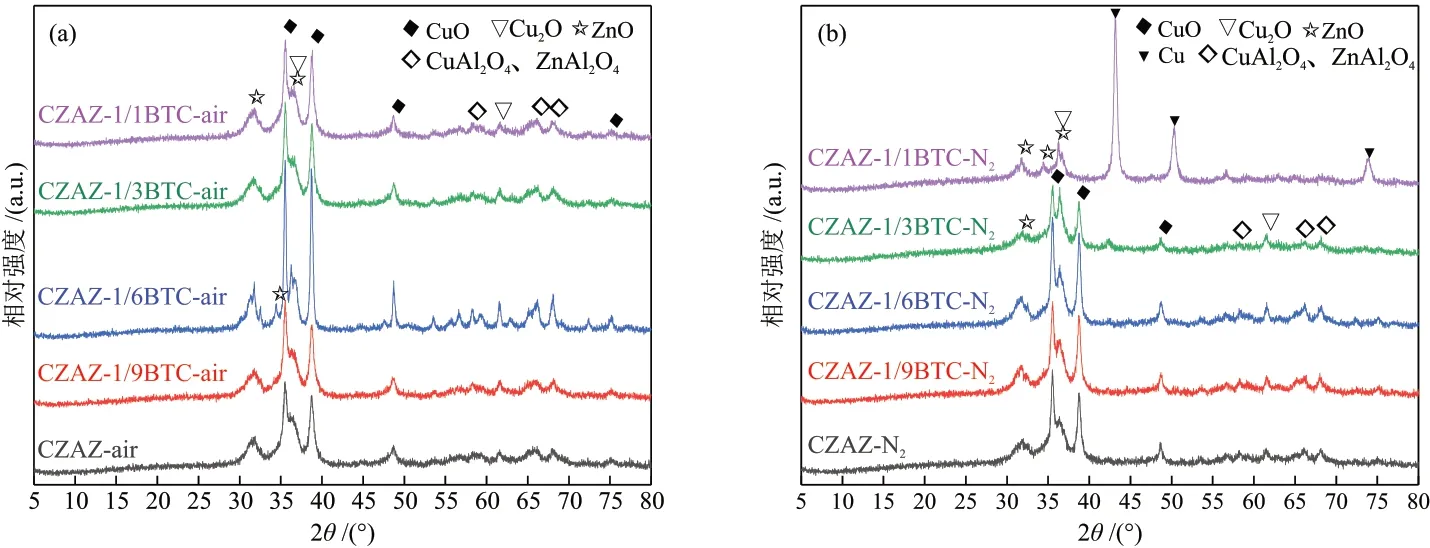
图2 CZAZ-xBTC-air (a)和CZAZ-xBTC-N2 (b) 催化剂的XRD谱图Fig. 2 XRD patterns of CZAZ-xBTC-air (a) and CZAZ-xBTC-N2 (b) catalysts
根据催化剂的XRD分析结果,后文选择BTC引入量为n(BTC)/n(Cu2+) = 1/6时,所得CZAZ-1/6BTC-y催化剂为讨论对象。图3为经焙烧、300 °C下H2还原1 h的CZAZ-y和CZAZ-1/6BTC-y催化剂的XRD谱图。
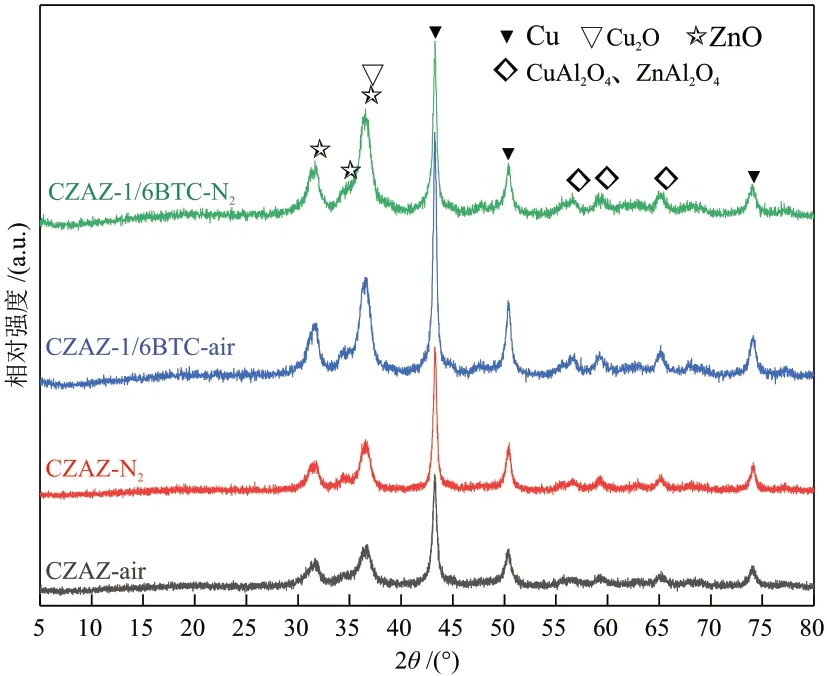
图3 经焙烧、300 °C下H2还原1 h的CZAZ-1/6BTC-y和CZAZ-y催化剂的XRD谱图Fig. 3 XRD patterns of CZAZ-1/6BTC-y and CZAZ-y catalysts after calcination and H2 reduction at 300 °C for 1 h
由图3 可知,催化剂H2经还原后,Cu 物种主要以Cu0的形式存在,而Cu0是公认的CO2加氢制甲醇的活性中心[25]。其中2θ= 43.3°、50.5°和74.2°的特征衍射峰分别归属于Cu0的(111)、(200)和(220)晶面(PDF No. 1—1241),而在2θ= 31.4°、34.4°和36.5°的特征衍射峰分别归属于ZnO的(100)、(002)和(101)晶面[21]。与未引入BTC的CZAZ-air催化剂相比,BTC辅助合成的CZAZ-1/6BTC-air 催化剂中金属Cu 和氧化物ZnO 的衍射峰强度均增强。对比两种焙烧气氛,在空气中焙烧所得催化剂的Cu(111)和Cu(200)晶面的衍射峰强度明显强于N2中焙烧的催化剂,说明经H2还原后CZAZ-1/6BTC-air催化剂表面存在更多具有Cu(111)和Cu(200)晶面的Cu0物种[19]。
2.1.2 织构性质分析
由N2O-H2滴定结果(表1)可知,未引入BTC 的CZAZ-y催化剂的Cu分散度和Cu金属表面积较低,这是由于Cu 物种与载体氧化物之间的强相互作用所致。当BTC引入量为n(BTC)/n(Cu2+) = 1/6时,于空气中焙烧所得CZAZ-1/6BTC-air 催化剂的Cu 金属表面积和Cu 分散度最大,分别为93.80 m2/g 和38.72%,且Cu晶粒尺寸也最小,为2.69 nm。这说明引入BTC 可减弱Cu 与载体之间的强相互作用,有助于Cu 物种的进一步分散,暴露更多的金属表面积,促进活性Cu0与反应物的充分接触。此外,较小的Cu晶粒可增加Cu-ZnO界面含量,进而提高Cu和ZnO之间的协同作用[26-27]。由表1中催化剂的N2吸/脱附结果可知,两种焙烧气氛中,BTC 辅助合成的CZAZ-1/6BTC-y催化剂的比表面积、总孔孔容较未引入BTC的样品都要大,这是因为焙烧时BTC分解会产生更多气体分子,逸出后生成更多孔隙结构和微孔表面。而催化剂的多孔隙和高比表面积对活性金属Cu 的分散是有利的[28]。另外,CZAZ-1/6BTC-air催化剂较N2气氛下焙烧的样品具有更高的比表面积(58.62 m2/g)和更大的孔容(0.62 mL/g),这是因为BTC在惰性气氛N2中存在不完全分解,未转化的C生成无定形炭物种,而这些物种可能占据了孔道。

表1 CZAZ-1/6BTC-y和CZAZ-y催化剂的织构性质Table 1 Textural properties of CZAZ-y and CZAZ-1/6BTC-y catalysts
2.1.3 还原性能分析
图4 为CZAZ-1/6BTC-y和CZAZ-y催化剂的H2-TPR曲线。
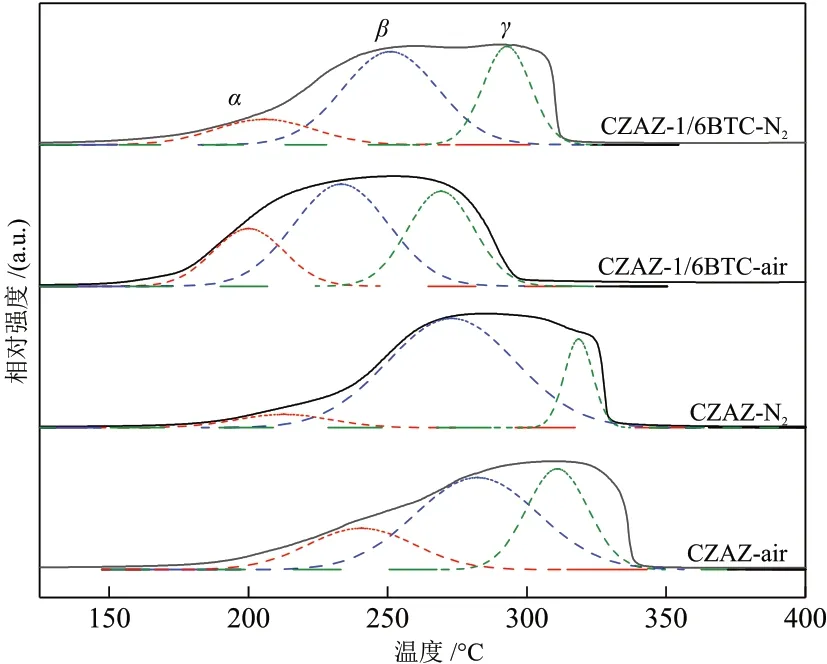
图4 CZAZ-1/6BTC-y和CZAZ-y催化剂的H2-TPR曲线Fig. 4 H2-TPR curves of CZAZ-1/6BTC-y and CZAZ-y catalysts
在图4 中,150~350 °C 内较宽的氢气消耗峰归属于不同Cu 物种的还原[21],对其进行分峰可得到α、β和γ这3 类Cu 还原峰。高温γ峰对应体相CuO的还原,其与ZnO 和Al2O3等载体氧化物之间存在强烈的相互作用,较难被还原[29];中温β峰对应高度分散的CuO 的还原;低温α峰则对应高度分散的Cu2O物种的还原,各还原峰的温度和分布分别总结在表2中。结果表明,未引入BTC的CZAZ-y催化剂还原峰温度较高,引入BTC后的CZAZ-1/6BTC-y催化剂还原峰均向低温方向移动。由于活性评价过程中样品的还原温度为300 °C,因此CZAZ-air、CZAZ-N2和CZAZ-1/6BTC-N2催化剂表面的Cu物种较难被完全还原为Cu0。CZAZ-1/6BTC-air催化剂的各还原峰温度分别为200.05 ℃、233.31 ℃和269.11 ℃,均低于CZAZ-N2和CZAZ-1/6BTC-N2催化剂,说明CZAZ-1/6BTC-air 催化剂表面Cu 物种与载体氧化物的相互作用力较弱并较易被还原且能被充分还原。因此,在前驱体浆料中引入BTC并于空气中焙烧可降低催化剂表面Cu物种的还原温度,促进Cu物种的还原,有利于增加Cu0活性位点数量[5],这与XRD(图3)和N2O-H2滴定(表1)分析结果一致。
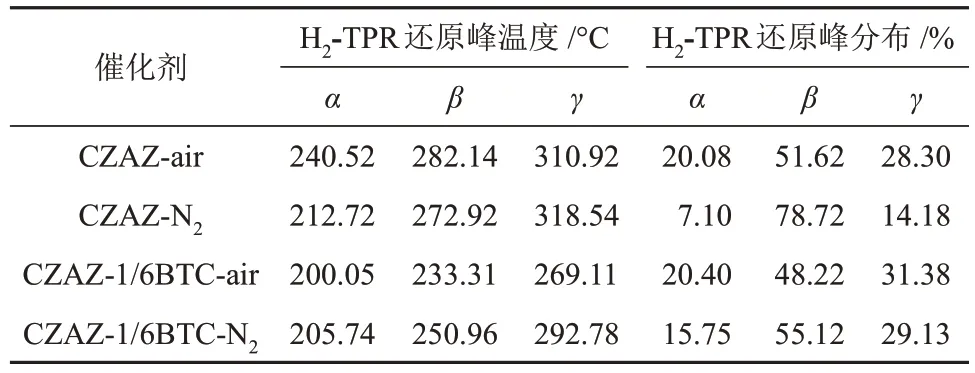
表2 CZAZ-1/6BTC-y 和CZAZ-y 催化剂的H2-TPR 还原峰温度与分布Table 2 Temperature and distribution of H2-TPR reduction peaks of CZAZ-1/6BTC-y and CZAZ-y catalysts
图5 为经焙烧、300 °C下H2还原1 h的CZAZ-1/6BTC-y催化剂的XPS 结果(以下简称为“还原催化剂”)。位于952.7 eV 和932.7 eV 附近的峰分别为Cu+物种的Cu 2p1/2和Cu 2p3/2的特征峰;位于951.9 eV和932.2 eV附近的峰分别为Cu0物种的Cu 2p1/2和Cu 2p3/2的特征峰。由图5(a)可知,CZAZ-1/6BTC-air还原催化剂的Cu0物种的电子结合能较低且相对含量更高,说明其表面Cu物种的电子云密度较大,存在更多活性Cu0物种,与N2O-H2滴定(表1)和XRD(图3)分析结果一致。此外,还分析了CZAZ-1/6BTC-y还原催化剂表面的O 物种,位于531.4 eV、530.3 eV 和529.2 eV的峰分别为表面羟基氧(OOH)、氧空位(OV)和晶格氧(OL)的特征峰[21],表面O物种分布总结于表3中,CZAZ-1/6BTC-air 还原催化剂表面OV和OL的总质量分数更高(0.78)。研究发现,OL与Cu-ZnO界面含量相关,因为OL负责将电子从ZnO的导电带转移到Cu 物种上,进一步促进OV的形成[29]。OV可以吸附活跃的CO2气体,也有助于迁移和稳定反应中间体[6]。此外,Zn 2p1/2和Zn 2p3/2的特征峰分别在1045.2 eV 和1022.1 eV 附近出现,这是催化剂表面存在的Zn2+,ZnO物种能吸附和活化CO2,进而强化Cu-ZnO 界面的氢化作用[27,30]。位于184.6 eV 和182.4 eV附近的峰分别为Zr 3d3/2和Zr 3d5/2的特征峰,归属于Zr4+物种[31]。由于Zn 2p和Zr 3d的电子结合能没有明显变化,说明焙烧氛围对Zn 和Zr 的氧化物的化学状态基本没有影响。
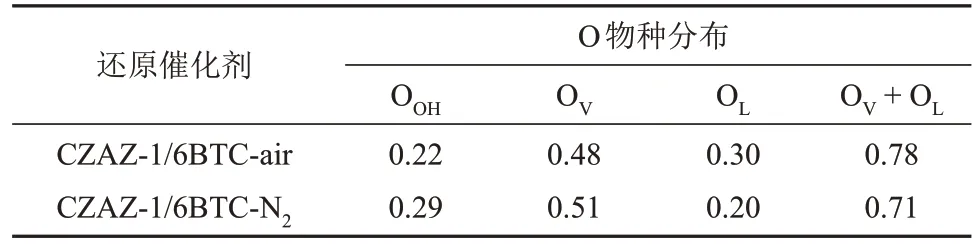
表3 CZAZ-1/6BTC-y还原催化剂的表面O物种分布Table 3 Distribution of O species on surface of CZAZ-1/6BTC-y reduction catalysts
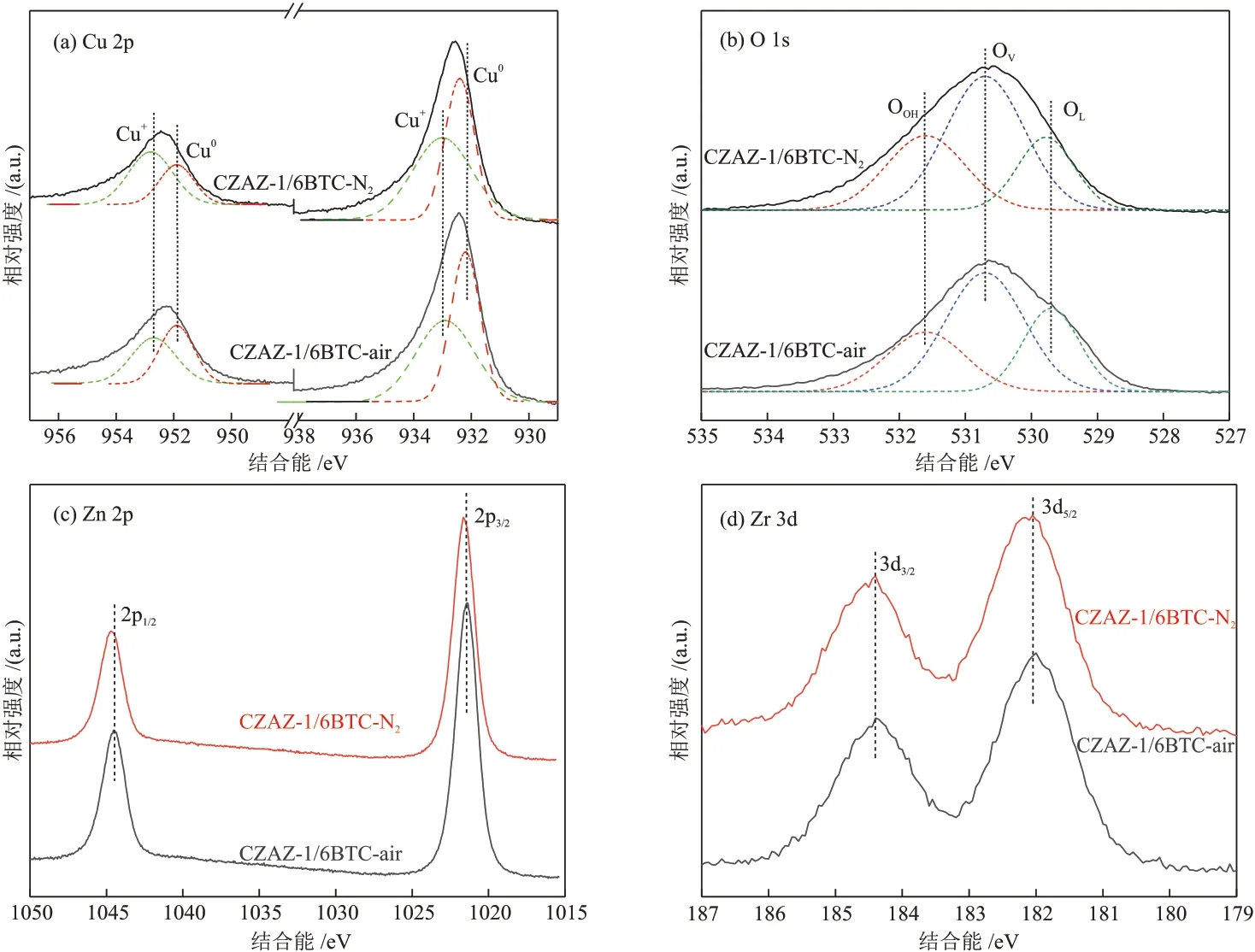
图5 CZAZ-1/6BTC-y还原催化剂的Cu 2p (a)、O 1s (b)、 Zn 2p (c)和Zr 3d (d) XPS谱图Fig. 5 Cu 2p (a), O 1s (b), Zn 2p (c) and Zr 3d (d) XPS spectra of CZAZ-1/6BTC-y reduction catalysts
2.1.5 形貌结构分析
图6 为在前驱体中BTC引入量为n(BTC)/n(Cu2+) = 1/6时,空气和N2中焙烧所得CZAZ-1/6BTC-y还原催化剂的形貌结构与Cu的粒径分布曲线。通过SEM照片(图6(a)、6(c))可见这两种催化剂主要由大量薄片状晶体组成,呈花瓣状且孔隙结构发达。TEM照片(图6(b)、6(d))表明这两种催化剂主要由球状和多面体颗粒堆积形成,且分散均匀。同时,根据阴影部分的投影面积估算了Cu 的平均晶粒尺寸,在空气和N2中焙烧所得催化剂的Cu 的平均粒径分别约为5.88 nm和5.78 nm。
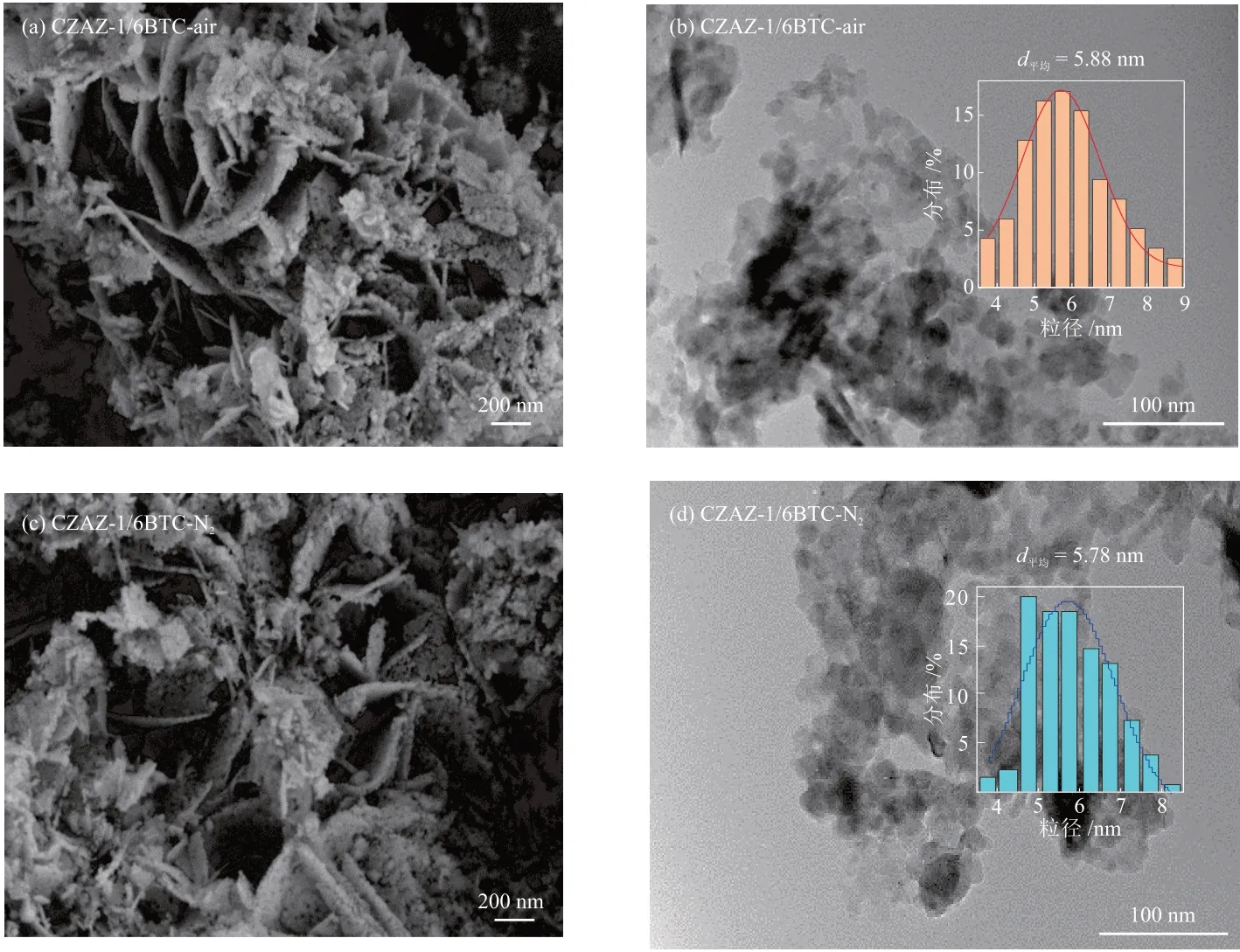
图6 CZAZ-1/6BTC-y还原催化剂的SEM照片((a)、(c))、TEM照片与Cu的粒径分布曲线((b)、(d))Fig. 6 SEM images ((a), (c)), TEM images and particle size distribution curves of Cu ((b), (d)) of CZAZ-1/6BTC-y reduction catalysts
2.2 催化活性评价结果分析
CZAZ-xBTC-y催化剂的CO2催化加氢结果见图7。由图7可知,BTC引入量对催化剂的催化活性有明显影响。在空气中焙烧(图7(a))所得催化剂的CO2转化率和甲醇时空产率(STY)随着BTC引入量的增加先增加后下降。与未引入BTC 的CZAZ-air催化剂相比,当BTC 引入量为n(BTC)/n(Cu2+) = 1/6时所得CZAZ-1/6BTC-air 催化剂的CO2转化率和STY达到最大,CO2转化率从14.43%提高到27.81%,甲醇时空产率从181.7 g/(kg·h)提高至278.6 g/(kg·h),这是因为在前驱体中引入BTC后,催化剂具有更大的比表面积和丰富的孔隙结构,有助于反应体系中分子迁移和扩散;引入BTC 可进一步减弱Cu 与载体氧化物之间的强相互作用,促进Cu 物种的还原,使得更多活性Cu0物种高度分散且Cu 晶粒尺寸减小,这些特征均有助于改善催化加氢性能,这可从前文的XRD(图3)、H2-TPR(图4)、N2O-H2滴定和N2-吸/脱附(表1)结果得到证实。此外,随着BTC引入量的增加,CO的选择性先增加后下降,而甲醇选择性则呈现相反的趋势,并且会抑制副产物CH4的生成而选择性生成更多CO 和CH3OH,推测该催化反应的反应机理主要为逆水煤气变换(RWGS)反应路径,CO2通过RWGS反应首先生成CO,CO再加氢生成甲醇[32]。
在N2气氛焙烧(图7(b))所得催化剂的CO2转化率、甲醇选择性和STY随着BTC引入量的增加先增加后下降,CO选择性则呈现相反趋势,说明适量BTC辅助合成有助于提高催化性能。在CZAZ-1/6BTC-N2催化剂上,CO2转化率、甲醇选择性和STY达到最大(分别为20.99%、78.59%和264.9 g/(kg·h))。此外,由于CZAZ-1/6BTC-air 催化剂的CO2转化率更高,因此表现出更高的甲醇时空产率。这是因为CO2加氢制甲醇是双功能反应机制,与催化剂表面Cu物种和ZnO物种的存在密切相关。氢原子从Cu表面溢出转移到ZnO上,ZnO物种通过吸附和活化CO2,进一步强化Cu-ZnO界面的氢化作用[27,30]。由N2O-H2滴定(表1)和XPS(图5)结果可知,相比于CZAZ-1/6BTC-N2催化剂,CZAZ-1/6BTC-air表面活性Cu0含量更高且Cu 晶粒更小(Cu 粒径为2.69 nm),在XRD(图2)结果中也存在更多ZnO相。研究表明,较小Cu晶粒对H2具有更强的吸附/解离能力,并有助于提高Cu与ZnO之间的协同作用,进而提高催化剂的催化加氢性能[32-33]。由于CZAZ-1/6BTC-air催化剂表面存在更丰富的高度分散的较小Cu 晶粒和ZnO 晶相,两者的协同作用使其在CO2加氢反应过程中表现出高CO2转化率和优异的催化活性。不论何种焙烧气氛,随着BTC引入量进一步增加,CO2转化率和STY均明显降低。这是因为一方面部分Cu2+在前驱体制备阶段生成的CuCO3和Cu(OH)2会发生团聚降低Cu物种的分散度;另一方面,在焙烧时过量BTC分解产生的大量还原性气体如CO会将Cu2+物种直接还原为Cu0,Cu0物种在高温下容易烧结,表现为催化活性较差[5]。
3 结论
通过在前驱体浆料中引入BTC 辅助合成了CZAZ-xBTC-y催化剂用于CO2加氢制甲醇,研究了BTC 引入量和焙烧气氛对催化剂理化性质和催化性能的影响,得到如下主要结论。
(1)在CuZnAlZr 催化剂前驱体中加入的BTC会在焙烧阶段分解为气体产物,有助于提高催化剂比表面积并产生更多孔隙结构。引入BTC 可减弱Cu 与载体氧化物之间的相互作用,使活性Cu0物种的分散度大大增加,形成具有较小Cu 晶粒的催化剂,从而使催化剂在CO2加氢制甲醇反应中的催化性能得以提高。
(2)当BTC 引入量为n(BTC)/n(Cu2+) = 1/6 并于空气中焙烧所得的CuZnAlZr 催化剂表面存在更多高度分散的较小的Cu 晶粒和ZnO 晶相,Cu 与ZnO物种之间的协同作用增强使得催化剂表现出优异的催化活性,CO2转化率和甲醇时空产率分别可达27.81%和278.6 g/(kg·h)。
