德曲妥珠单抗对比恩美曲妥珠单抗二线治疗HER2 阳性转移性乳腺癌的成本-效用分析 Δ
2024-02-02武亚楠侯艳红中国药科大学国际医药商学院南京211198
武亚楠,吴 方,侯艳红 (中国药科大学国际医药商学院,南京 211198)
乳腺癌是女性最常见的恶性肿瘤。根据WHO国际癌症机构(International Agency Research on Cancer,IARC)发布的2020年全球癌症负担数据显示,世界范围内乳腺癌的发病例数高居第一,在因癌症死亡的原因中排名第五[1―2]。2020 年,我国共有41.6 万例新发乳腺癌患者,比2015 年增长了约11.2 万例,死亡人数占全球乳腺癌总死亡人数的17.1%[3]。其中,约有20%~25%的患者存在人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)过度表达的情况[4]。有研究表明,曲妥珠单抗作为一种抗HER2的靶向药物,对HER2阳性转移性乳腺癌患者具有较好的治疗和预后效果[5]。
根据长期随访数据,曲妥珠单抗在治疗过程中仍有15%~24%的患者会发生疾病进展(progressive disease,PD)[6]。德曲妥珠单抗(trastuzumab deruxtecan,T-DXd)与恩美曲妥珠单抗(trastuzumab emtansine,T-DM1)的研发上市为HER2阳性转移性乳腺癌患者带来更多的治疗选择。T-DXd 和T-DM1 均是由人源化抗HER2 单克隆抗体与有效的细胞毒性载荷偶联形成的抗体-药物偶联物(antibody-drug conjugate,ADC),可直接靶向肿瘤细胞,进一步提高单克隆抗体的活性。2020年1月,T-DM1在我国获批上市,适用于既往接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。2023 年2 月,国家药品监督管理局批准T-DXd用于既往接受过1种或以上抗HER2药物治疗的不可切除或HER2阳性转移性乳腺癌。国外一项正在进行的多中心、随机、开放标签Ⅲ期临床试验(DESTINY-Breast03 试验)评估了T-DXd对比T-DM1 二线治疗HER2阳性转移性乳腺癌的疗效和安全性。结果显示,与T-DM1 相比,T-DXd 可显著提高患者的客观缓解率(objective response rate,ORR)(79% vs. 35%),延长中位无进展生存期(progressionfree survival,PFS)(28.8个月vs. 6.8个月)及改善24个月的总生存率(77.4% vs. 69.9%)[7]。这一结果使得欧洲和美国对于HER2阳性转移性乳腺癌二线治疗的指南进行了更新——推荐将T-DXd 替代T-DM1 作为首选二线治疗方案[8―9]。基于此,Yang等[10]和Zhu等[11]分别从中美两国的卫生体系角度出发评价了两药用于HER2阳性转移性乳腺癌二线治疗的经济性,结果均显示,T-DXd 在我国二线治疗HER2阳性转移性乳腺癌具有经济性的概率仅为0.1%,但两项研究中的药品成本均基于该药在美国的上市价格。由于T-DXd 在我国上市后的价格显著低于美国,故本研究拟再次从我国卫生体系角度出发,使用分区生存模型探讨T-DXd 在我国上市后对比T-DM1二线治疗HER2阳性转移性乳腺癌的经济性,以期助力临床合理用药,为国家卫生决策及医保药品目录的动态化调整提供参考。
1 资料与方法
1.1 目标人群及临床数据
本研究基于一项评估T-DXd 与T-DM1 在曲妥珠单抗与紫杉烷类药物治疗期间或治疗后发生PD的不可切除或HER2阳性转移性乳腺癌患者疗效和安全性的多中心、随机、开放性的Ⅲ期临床试验(DESTINY-Breast03)[7]展开。目标人群与该试验患者纳入的标准一致:(1)患者年龄为18 岁及以上;(2)患有病理记录的HER2阳性不可切除或转移性乳腺癌;(3)之前已在晚期或出现转移的情况下接受过曲妥珠单抗和紫杉烷类药物治疗,或在完成含有蒽环类药物的辅助化疗后6个月内复发;(4)东部肿瘤协作组健康状况评分为0或1分,且根据《实体肿瘤疗效评价标准(RECIST 1.1 版)》至少存在1 个可测量病灶。
1.2 模型构建
本研究根据疾病发展过程构建分区生态模型,该模型包括3 种互斥的健康状态:PFS、PD、死亡。根据临床用药方案,本模型循环周期设为3周,模拟至患者终身。另外,本研究假设每位患者进入模型时均处于PFS 状态,在每周期内只能处于1种健康状态并接受相应的治疗。模型产出指标为总成本、质量调整生命年(qualityadjusted life years,QALYs)和增量成本-效果比(incremental cost-effectiveness ratio,ICER)。根据《中国药物经济学评价指南2020》[12],本研究以3 倍我国2022 年人均国内生产总值(gross domestic product,GDP)作为意愿支付(willingness-to-pay,WTP)阈值,即257 094元/QALY,使用每年5%的贴现率对成本和健康产出进行贴现,并在0~8%的范围内进行敏感性分析。
1.3 治疗方案
DESTINY-Breast03 试验将入选患者按照1∶1 随机分为试验组和对照组,试验组患者给予注射用T-DXd(Baxter Oncology GmbH,规格100 mg/瓶)5.4 mg/kg,对照组患者给予注射用T-DM1[罗氏(中国)投资有限公司,规格 160 mg/瓶]3.6 mg/kg,均为每3 周输注1 次,即每3 周为1 个治疗周期。未发生PD 的患者将继续按照原方案给药,截至数据统计日期(2022 年7 月25 日),T-DXd 组有75 例(29%)患者、T-DM1 组有18 例(7%)患者仍在接受治疗。
因DESTINY-Breast03 研究未披露患者发生PD 后的治疗方案,故本研究根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023》[13]对既往接受过≥2 种靶向药物治疗的HER2阳性转移性乳腺癌患者的三线治疗建议及相关文献[14]确定了三线治疗方案:假设两组患者发生PD后均采用奈拉替尼和卡培他滨联合治疗。具体用法用量为:奈拉替尼片240 mg 口服,每日1 次;卡培他滨片1 000 mg/m2口服,每日2次,连用14 d。每21 d为1个治疗周期。因DESTINY-Breast03 试验中两组患者的女性比例均超过99%,故本研究根据我国国家国民体质监测中心发布的《第五次国民体质监测公报》中的数据——我国成年女性的平均身高为158 cm,平均体重为59 kg——计算可得本研究目标人群的平均体表面积为1.62 m2。
1.4 生存分析
依据临床研究中已发布的生存曲线获得3种健康状态下的患者比例:PFS状态的患者比例直接由生存曲线获得,PD 状态的患者比例由总生存率与无进展生存率的差值计算获得,死亡患者的比例为1-总生存率,然后依次计算两组患者治疗方案的成本和健康获益情况。首先,利用GetData Graph Digitizer 软件对DESTINYBreast03试验中的原始生存曲线取点;其次,利用R语言4.3.1 软件对两组患者的个体水平数据进行重构;最后,利用Stata16.0 软件重构生存曲线并对超出随访期外的生存曲线进行外推,分别采用Exponential、Gamma、Gompertz、Weibull、Log-logistic、Log-normal、Gen-gamma分布对重构后的生存曲线参数进行拟合,根据赤池信息准则(Akaike information criterion,AIC)和贝叶斯信息准则(Bayesian information criterion,BIC)结合视觉检验选择最优拟合分布并计算其参数。两组患者的总生存(overall survival,OS)曲线和PFS 曲线最优拟合分布及参数见表1,原始与拟合的生存曲线分别见图1、图2。
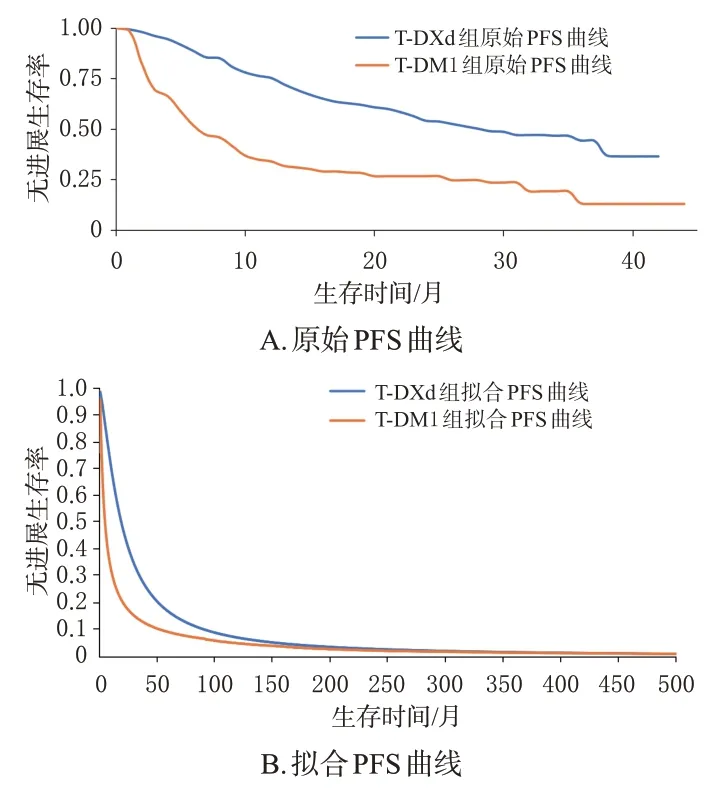
图2 两组患者的原始PFS曲线和拟合PFS曲线图

表1 最优拟合分布及参数
1.5 模型参数
本研究从我国卫生体系角度出发,仅考虑直接医疗成本,主要包括药品成本、药品管理成本、疾病管理成本和不良反应处理成本。药品成本来自药智网(https://www.yaozh.com/),其中卡培他滨的给药剂量参考药品说明书,剂量水平在1 000 mg/m2的情况下,体表面积在1.53~1.66 m2的患者每次给药剂量为1 600 mg。药品管理成本包括静脉输液费、诊断费等。疾病管理成本包括实验室检查成本(血常规、血生化、乳腺癌标志物检测等)、影像学检查成本(乳腺X线摄影、乳腺超声、乳腺磁共振成像等)以及每3个月进行1次的随访成本,成本数据均参考江苏省三级医院医疗服务价格的中位数及相关文献[15]。本研究中仅纳入3 级及以上且发生率≥5%的不良反应,包括贫血、血小板减少症和中性粒细胞计数减少等,不良反应处理成本来源于相关文献[16―17]。根据DESTINY-Breast03试验的相关信息,发生不良反应的患者绝大部分会面临停药、给药剂量减少或药物中断的情况,为简化模型,本研究假设发生不良反应的患者不再参与该组试验,即不良反应处理成本只发生1次。
效用值数据来源于一项探讨不同疾病状态的中国乳腺癌患者健康差异的文献[18],该研究采用欧洲生命质量五维量表(EuroQol Five-Dimension,EQ-5D)得到PFS状态的效用值为0.66,PD状态的效用值为0.47。模型参数及分布见表2。

表2 模型参数及分布
1.6 敏感性分析
采用单因素敏感性分析(deterministic sensitivity analysis,DSA)对模型参数的不确定性进行评估。成本参数采用均值±30%作为其上下限,效用值参数采用均值±20%作为其上下限,以此考察不同参数在一定变化范围内对ICER 值的影响程度,结果用旋风图展示。为考察各参数对模型稳健性的综合影响,假设成本参数均服从Gamma分布,效用值及贴现率均服从Beta分布,利用Excel做1 000次Monte-Carlo模拟抽样进行概率敏感性分析,其结果通过成本-效果可接受曲线和成本-效果散点图呈现。
1.7 情境分析
目前注射用T-DXd 的售价为8 860 元/瓶(规格 100 mg),高昂的药物费用往往使患者对疾病的治疗望而却步,从而错过最佳治疗时期,延误病情。中国初级卫生保健基金会在全国开展的“优赫共享-乳腺癌患者援助项目”旨在减少既往接受过1 种或以上抗HER2 药物治疗的不可切除或HER2阳性转移性乳腺癌患者的经济负担,具体援助方案为:对于低收入患者,连续接受至少3个周期的治疗并经临床评估能从中继续获益,在疾病无进展的前提下可免费获得1 个治疗周期的T-DXd,且项目执行期内可循环申请;对于低保患者,在PFS 的前提下每人每个治疗周期可分次接受援助直至PD或项目结束。由于本援助计划在作者完稿时未公布项目具体的截止日期,且T-DXd Ⅰ期研究中未观察到剂量限制性毒性和最大耐受剂量[19],结合李欣[20]发布的相关乳腺癌药物援助项目情况,本研究假设该援助项目可最长援助患者24个月,并以此进行情境分析以探究该援助计划对本研究结果的影响。
2 结果
2.1 基础分析结果
相比于T-DM1 方案,T-DXd 方案能使HER2阳性转移性乳腺癌患者获得更多的健康产出(多获得0.69 QALYs),但同时也需要花费更多的治疗成本,ICER 为1 850 478.40 元/QALY。故在以3 倍我国人均GDP 为阈值(257 094元/QALY)的情况下,T-DXd方案相比T-DM1方案不具有经济性。结果见表3。
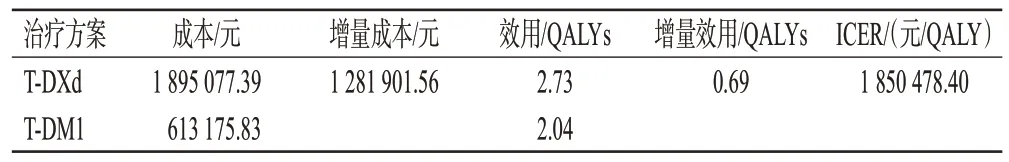
表3 基础分析结果
2.2 敏感性分析结果
2.2.1 单因素敏感性分析
单因素敏感性分析结果见图3。从图3 可看出,对ICER 值影响较大的参数为PFS 状态效用值、T-DXd 成本、成本贴现率等。T-DM1 和奈拉替尼的价格变动对ICER 的影响相较于上述因素的影响并不显著,可见上述两种药物纳入医保后,其药品价格对整体治疗方案的经济性影响不大。另外,疾病管理成本、随访成本及两组患者的不良反应处理成本等对结果数据的影响也较小。当T-DXd 药品价格下降至每100 mg 6 202 元时,ICER 值能下降到约1 100 000 元/QALY,但仍高于3 倍我国人均GDP阈值(257 094元/QALY)。
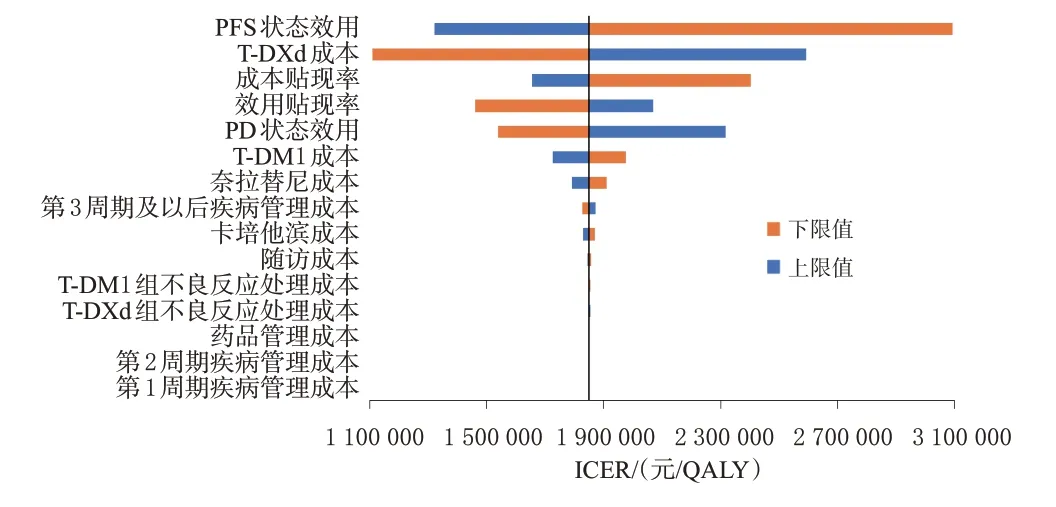
图3 单因素敏感性分析的旋风图
2.2.2 概率敏感性分析
成本-效果散点图(图4)显示,1 000 次Monte-Carlo模拟的ICER 值均落于WTP 阈值线之上,说明以3 倍我国人均GDP 作为WTP 阈值(257 094 元/QALY)时,T-DXd用于治疗HER2阳性转移性乳腺癌的方案具有经济性的概率为0。由成本-效果可接受曲线(图5)可以看出,当WTP 阈值为350 000 元/QALY 时,T-DXd 组具有经济性的概率为0;当WTP 阈值为1 500 400 元/QALY时,两种方案具有经济性优势的概率基本一致;当WTP阈值更大时,T-DXd方案具有经济性的概率大于T-DM1方案。概率敏感性分析结果验证了基础分析结果的稳健性。

图4 成本-效果散点图

图5 成本-效果可接受曲线
2.3 情境分析结果
由于T-DXd 的援助项目针对两种不同的收入群体开展,故本研究对两种人群分别展开情境分析。对于低收入患者,T-DXd 方案相较于T-DM1 方案的ICER 为1 655 025.88 元/QALY;对于低保患者,T-DXd 方案相较于T-DM1 方案的ICER 为1 063 090.49 元/QALY。经测算,对于援助力度更大的低保患者来说,持续援助2年的治疗费用相比没有接受援助的患者降低了670 620元,但在以3倍我国人均GDP作为WTP阈值(257 094元/QALY)的前提下,基础分析结果未发生翻转。
3 讨论
T-DXd是一种由抗HER2人源化单克隆抗体与载药拓扑异构酶1 抑制剂喜树碱类衍生物(exatecan derivative for ADC,DXd)组成的ADC 药物,其药物-抗体比值(drug-to-antibody ratio,DAR)的理论最大值达到8,具有避免耐药、特异性强、对肿瘤细胞杀伤力大和患者安全性良好等特点[21],已在国外获批用于治疗HER2阳性乳腺癌、HER2低表达乳腺癌等多种适应证,并于2023年2月在我国获批上市。T-DM1已进入我国医保目录,目前价格已降至5 130 元/瓶(160 mg),降幅约50%。本研究从我国卫生体系角度出发,在分区生存模型的基础上评估了T-DXd 对比T-DM1 二线治疗HER2阳性转移性乳腺癌的经济性。基础分析结果显示,T-DXd方案相对于T-DM1 方案的ICER 为1 850 478.398 元/QALY,远高于3 倍我国人均GDP 的WTP 阈值(257 094 元/QALY),即T-DXd 方案不具有经济性。单因素敏感性分析结果表明,除PFS 状态的效用外,T-DXd 的价格是影响T-DXd方案经济性的重要因素。Yang 等[10]的敏感性分析结果也表明,ICER值的波动受T-DXd单价的影响最大,当其售价降至原价的50%以下时,其在我国更具经济性的概率将超过50%,即假设T-DXd 与T-DM1 的降幅一致,T-DXd 将有望成为具有经济性优势的治疗方案。概率敏感性分析结果显示,当WTP为3倍我国人均GDP时,T-DXd方案具有经济性优势的概率始终为0;当WTP大于1 500 400元/QALY时,T-DXd方案具有经济性的概率才会超过T-DM1。通过对T-DXd 的援助计划进行情境分析发现,在援助24个月时,无论是低收入患者还是低保患者,T-DXd 方案相对于T-DM1 方案的ICER 值都大于本研究设定的阈值,T-DXd方案仍不具有经济性。产生这种问题的原因可能是由于T-DXd 本身没有明确的最大剂量范围,所以PFS状态的患者需给予长期维持治疗,导致治疗成本高居不下。
本研究尚存在一定的局限性:第一,DESTINYBreast03 试验在北美洲、亚洲、欧洲、澳大利亚和南美洲的169 个研究中心进行,虽然两组患者中亚洲人的比例均超过55%,但其试验目标人群不只是针对中国的乳腺癌患者,不同种族之间效用状态及治疗效果可能存在一定差异。第二,截至本文完稿时,该试验仍在进行中,本研究使用参数法进行生存外推获得的PFS和OS数据可能会增加模型结果的不确定性。第三,根据欧洲医学肿瘤学会的推荐,后线治疗方案应首选图卡替尼联合曲妥珠单抗和卡培他滨治疗,但图卡替尼未在我国上市且价格昂贵,所以本研究假设两组发生PD 的患者均接受奈拉替尼和卡培他滨联合治疗,即本研究选择的后线治疗方案疗效并非最优,可能会造成研究结果与实际结果间存在偏差。第四,本研究仅纳入了治疗相关的3级及以上且发生率≥5%的不良反应,未将所有不良反应考虑在内,其对应的成本升高和效用值下降未纳入计算中,可能使结果与实际情况存在一定偏倚。
综上,本研究从我国卫生体系角度出发评估了T-DXd 对比T-DM1 二线治疗HER2阳性转移性乳腺癌的经济性。结果显示,以3 倍我国人均GDP 作为WTP阈值时,T-DXd 方案相对于T-DM1 方案不具有经济性,且T-DXd 价格对ICER 值的影响较大;即使考虑T-DXd的援助计划项目,该结果仍未发生改变。只有当药物价格降至原价的50%左右时,T-DXd作为首选二线治疗方案才有一定的经济性优势。故该药未来可能需要大幅降低其价格,以提高该药的可及性,在为患者带来更多治疗选择的同时进一步降低其经济负担。
