阿奇霉素对新生大鼠支气管肺发育不良的改善作用及机制 Δ
2024-02-02杜维纳高淑强习玉峰电子科技大学医学院附属妇女儿童医院成都市妇女儿童中心医院新生儿重症医学科成都611731
杜维纳,高淑强 ,巨 容,习玉峰(电子科技大学医学院附属妇女儿童医院/成都市妇女儿童中心医院新生儿重症医学科,成都 611731)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是多发于早产儿的慢性肺损伤性疾病,该病具有较高的病死率,使存活患儿多遗留有明显的肺功能不全并伴随生长发育迟滞,严重威胁患儿的生活质量[1―2]。研究证实,在机械通气及氧疗过程中,吸入氧浓度过高及氧疗时间较长均可导致早产儿体内释放大量的活性氧和自由基,引发白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子释放量明显升高,并进一步诱导炎症反应及氧化应激反应的发生,从而引起肺损伤,甚至进展为BPD[2―3]。但目前关于BPD的病因及发生机制尚未完全揭示,且临床缺乏切实有效的预防及治疗手段。因此探究BPD 有效的预防与治疗方法具有重要意义。
阿奇霉素是一种半合成的15 元环结构的大环内酯类抗生素,其在血液中的半衰期长达35~48 h,药效持续时间较长,具有良好的抗菌药物后效应,在免疫调控及抗炎方面发挥重要的作用[4]。目前已有研究证实了阿奇霉素在预防及治疗BPD方面的作用,然而其具体作用机制尚未确切[5]。故基于上述背景,本研究考察了阿奇霉素对新生大鼠BPD 的改善作用及机制,旨在为BPD的预防和治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BH-5160CRP 型全自动血液分析仪(南京贝登医疗股份有限公司)、PE-300型显微镜(广州科适特科学仪器有限公司)、HD-3001型核酸蛋白浓度检测仪(上海金鹏分析仪器有限公司)、Light Cycler480型实时荧光定量聚合酶链式反应(PCR)仪(瑞士Roche公司)、DW-86L959BPT型80 ℃超低温冰箱(杭州诺丁科学器材有限公司)、GenoSens 220 型凝胶成像系统(上海勤翔科学仪器公司)。
1.2 主要药品与试剂
阿奇霉素注射液(规格2 mL∶0.1 g,国药准字H20051466)购自亚宝药业集团股份有限公司;吸入用布地奈德混悬液(阳性对照药,规格2 mL∶1 mg,国药准字H20203649)购自深圳太太药业有限公司/健康元海滨药业有限公司;苏木精-伊红(HE)染液(批号G1005)购自武汉赛维尔生物科技有限公司;兔源血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体(批号ab32152)、兔源缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)单克隆抗体(批号ab129733)、兔源HIF-2α单克隆抗体(批号2608)均购自武汉益普生物科技有限公司;TNF-α、IL-6、IL-1β酶联免疫吸附测定(ELISA)试剂盒(批号分别为KE1002、KE10007、19811-1-AP)均购自美国Proteintech 公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)ELISA 试剂盒(批号分别为20211016、20211112、20211218)均购自南京建成生物工程研究所;β-肌动蛋白(β-actin)抗体(批号191050722)、羊抗兔二抗(批号139931)均购自北京中杉金桥生物技术有限公司;DAB 显色剂(批号G32415)购自广州展晨生物科技有限公司;RIPA 裂解液(批号20220416)购自武汉伊莱瑞特生物科技有限公司;Trizol 试剂(批号NR0002)购自北京康瑞纳生物科技有限公司。
1.3 实验动物
新生SD大鼠60只,2日龄,雌雄各半,体重5~10 g,购自北京希诺谷生物科技有限公司,实验动物生产许可证号SCXK(京)2021-0001。所有大鼠饲养于SPF 级动物实验房,温度22~25 ℃,相对湿度40%~60%,均自由摄食、饮水,隔日更换垫料。本实验方案经成都市妇女儿童中心医院动物实验伦理委员会批准通过[批件号:科研伦审2023(51)-2号]。
2 方法
2.1 分组、建模与给药
将60 只新生SD 大鼠随机分为阴性对照(NC)组、BPD 组、阿奇霉素组、布地奈德组(阳性对照),每组15只,其中NC组大鼠正常呼吸空气,其余3组大鼠通过在高浓度氧(保持氧含量>90%)中暴露14 d 构建BPD 大鼠模型[6]。待建模成功后,阿奇霉素组大鼠按200 mg/kg腹腔注射阿奇霉素注射液[6],布地奈德组大鼠按1.5 mg/kg雾化吸入布地奈德混悬液20 min[2],同时2组均予以等量生理盐水灌胃,每日1 次,连续14 d;BPD 组和NC 组大鼠不做任何处理。
2.2 肺组织病理学观察
每组各取5 只大鼠,处死,分离肺组织,一部分置于-80 ℃超低温冰箱中保存,另一部分由4%多聚甲醛固定。取出固定的肺组织,通过石蜡包埋切片,然后分别放入二甲苯及梯度乙醇(70%、80%、90%、100%)中脱蜡至水,苏木素染色,磷酸盐缓冲液冲洗,经盐酸、乙醇分化后再次通过梯度乙醇(100%、90%、80%、70%)脱水,二甲苯透明处理后封片。在PE-300型显微镜下观察各组大鼠的肺组织病理学变化,并进一步通过Image J软件检测放射状肺泡计数和肺泡平均截距。
2.3 支气管肺泡灌洗液中白细胞计数检测
麻醉各组剩余10 只大鼠,由大鼠气管插入细静脉管,注入生理盐水,然后收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),离心后留取沉淀并通过全自动血液分析仪检测其中白细胞计数。
2.4 BALF中炎症因子及氧化应激指标检测
收集各组剩余10 只大鼠的BALF,在4 ℃下以3 000 r/min离心10 min,取上清液,按照ELISA试剂盒说明书操作,检测其中TNF-α、IL-6、IL-1β、SOD、CAT、MDA水平。
2.5 肺组织中VEGF、HIF-1α 和HIF-2α mRNA 表达检测
BALF 收集结束后,将剩余的10 只大鼠处死,采用Trizol 法提取总RNA,经HD-3001 型核酸蛋白浓度检测仪检测后将RNA逆转录为cDNA,并进一步扩增。反应体系:SYBR Premix 12.5 μL,上下游引物(10 μmol/L)各1 μL,cDNA 0.5 μL,ddH2O 10 μL。反应条件:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35 个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,按2-ΔΔCt法检测VEGF、HIF-1α、HIF-2α mRNA 的相对表达量。引物序列见表1。

表1 引物序列及产物长度
2.6 肺组织中VEGF、HIF-1α和HIF-2α蛋白表达检测
取出低温保存的肺组织适量,加入RIPA 裂解液提取总蛋白,经蛋白浓度测定后,变性。取变性蛋白样品适量,电泳分离后转至聚偏二氟乙烯膜,封闭2 h后加入兔源VEGF、HIF-1α、HIF-2α一抗(稀释比例均为1∶1 000),于4 ℃下过夜;次日通过TBST 缓冲液漂洗后加入羊抗兔二抗(稀释比例为1∶2 000),于室温下孵育2 h,加入ECL 显色,置于GenoSens 220 型凝胶成像系统成像,通过Quantity One软件分析VEGF、HIF-1α、HIF-2α蛋白与内参蛋白β-actin的灰度值比值,表示目的蛋白表达量。
2.7 统计学方法
采用SPSS 21.0软件对数据进行统计分析。符合正态分布及方差齐性的计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 大鼠肺组织病理学变化
NC 组大鼠肺组织及肺泡结构正常,未发现损伤症状;BPD 组大鼠肺组织出现明显损伤,肺泡融合变大且间隔不均匀,肺泡数量显著减少,有明显的炎症细胞浸润;阿奇霉素组大鼠肺组织上述病理症状有所改善,且与布地奈德组改善程度相似。结果见图1。
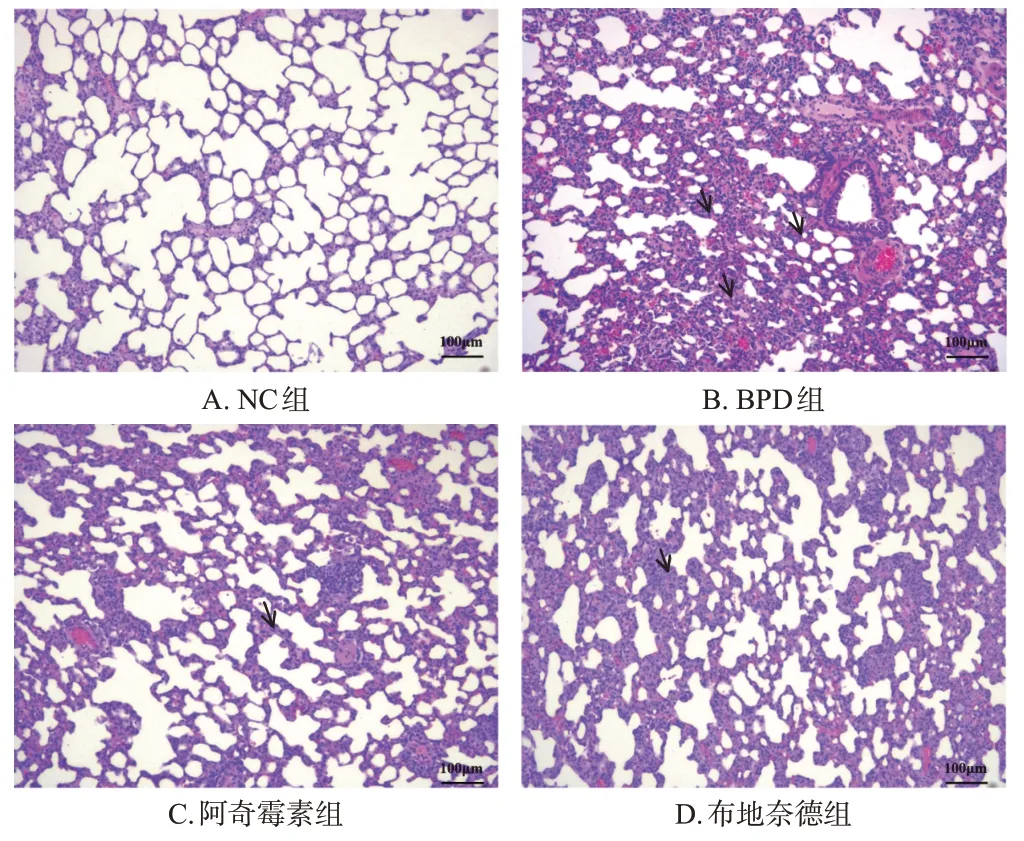
图1 各组大鼠肺组织病理学变化(HE染色)
3.2 大鼠BALF 中白细胞计数和肺组织中放射状肺泡计数及肺泡平均截距变化
与NC组比较,BPD组大鼠BALF中白细胞计数、肺泡平均截距均显著上调,放射状肺泡计数显著下调(P<0.05)。与BPD 组比较,阿奇霉素组和布地奈德组大鼠的白细胞计数、肺泡平均截距均显著下调,放射状肺泡计数显著上调(P<0.05)。阿奇霉素组与布地奈德组比较,差异无统计学意义(P>0.05)。结果见表2。
表2 各组大鼠BALF 中白细胞计数、放射状肺泡计数及肺泡平均截距比较(±s)
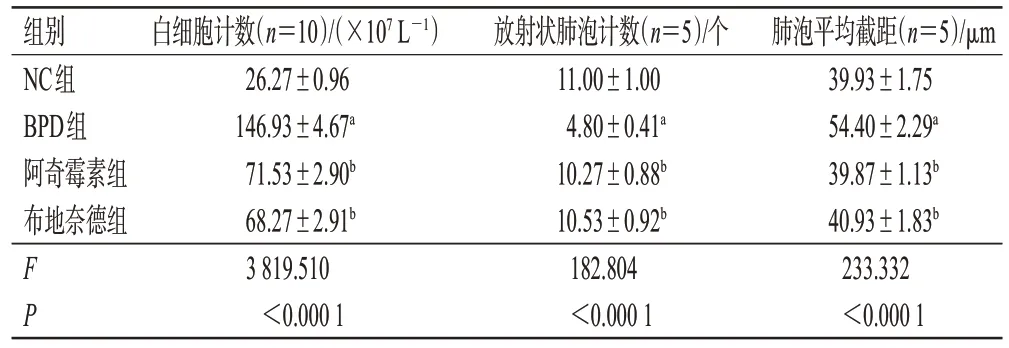
表2 各组大鼠BALF 中白细胞计数、放射状肺泡计数及肺泡平均截距比较(±s)
a:与NC组比较,P<0.05;b:与BPD组比较,P<0.05。
组别NC组BPD组阿奇霉素组布地奈德组FP白细胞计数(n=10)/(×107 L-1)26.27±0.96 146.93±4.67a 71.53±2.90b 68.27±2.91b 3 819.510<0.000 1肺泡平均截距(n=5)/μm 39.93±1.75 54.40±2.29a 39.87±1.13b 40.93±1.83b 233.332<0.000 1放射状肺泡计数(n=5)/个11.00±1.00 4.80±0.41a 10.27±0.88b 10.53±0.92b 182.804<0.000 1
3.3 大鼠BALF中炎症因子水平变化
与NC 组比较,BPD 组大鼠BALF 中TNF-α、IL-6、IL-1β水平均显著上调(P<0.05)。与BPD组比较,阿奇霉素组和布地奈德组大鼠BALF 中TNF-α、IL-6、IL-1β水平均显著下调(P<0.05)。阿奇霉素组与布地奈德组比较,差异无统计学意义(P>0.05)。结果见表3。
表3 各组大鼠BALF 中TNF-α、IL-6 和IL-1β 水平比较(±s,n=10)
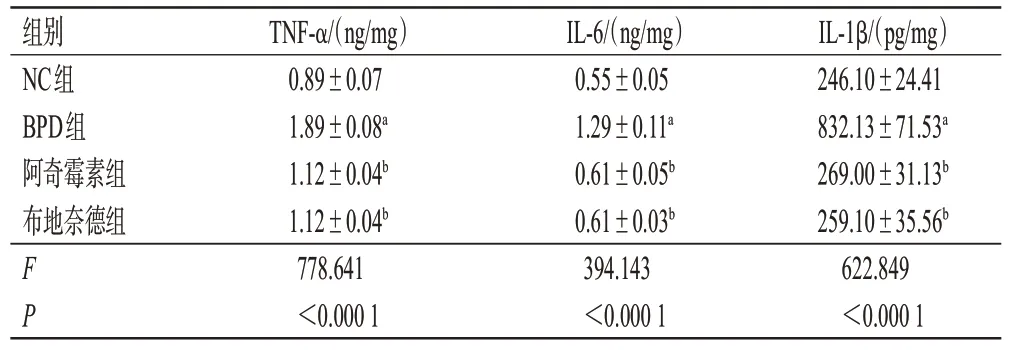
表3 各组大鼠BALF 中TNF-α、IL-6 和IL-1β 水平比较(±s,n=10)
a:与NC组比较,P<0.05;b:与BPD组比较,P<0.05。
组别NC组BPD组阿奇霉素组布地奈德组FP IL-1β/(pg/mg)246.10±24.41 832.13±71.53a 269.00±31.13b 259.10±35.56b 622.849<0.000 1 TNF-α/(ng/mg)0.89±0.07 1.89±0.08a 1.12±0.04b 1.12±0.04b 778.641<0.000 1 IL-6/(ng/mg)0.55±0.05 1.29±0.11a 0.61±0.05b 0.61±0.03b 394.143<0.000 1
3.4 大鼠BALF中氧化应激指标变化
与NC组比较,BPD组大鼠BALF中SOD、CAT水平均显著下调,MDA水平显著上调(P<0.05)。与BPD组比较,阿奇霉素组和布地奈德组大鼠BALF 中SOD、CAT 水平均显著上调,MDA 水平显著下调(P<0.05)。阿奇霉素组与布地奈德组比较,差异无统计学意义(P>0.05)。结果见表4。
表4 各组大鼠BALF 中SOD、MDA 和CAT 水平比较(±s,n=10)
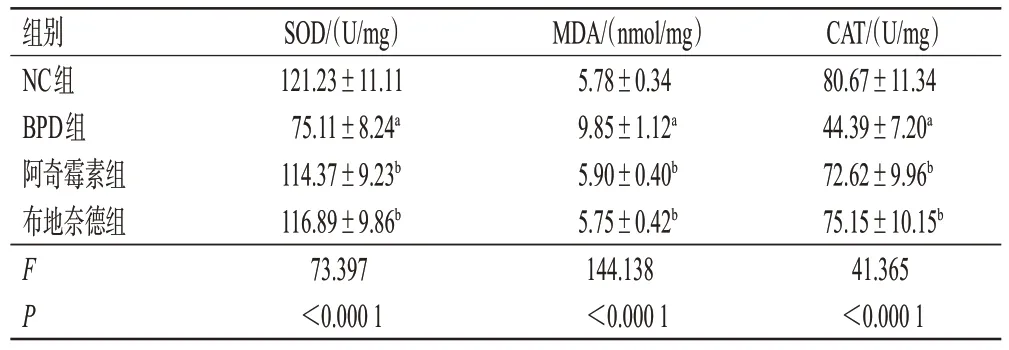
表4 各组大鼠BALF 中SOD、MDA 和CAT 水平比较(±s,n=10)
a:与NC组比较,P<0.05;b:与BPD组比较,P<0.05。
组别NC组BPD组阿奇霉素组布地奈德组FP CAT/(U/mg)80.67±11.34 44.39±7.20a 72.62±9.96b 75.15±10.15b 41.365<0.000 1 SOD/(U/mg)121.23±11.11 75.11±8.24a 114.37±9.23b 116.89±9.86b 73.397<0.000 1 MDA/(nmol/mg)5.78±0.34 9.85±1.12a 5.90±0.40b 5.75±0.42b 144.138<0.000 1
3.5 大鼠肺组织中VEGF、HIF-1α和HIF-2α mRNA表达变化
与NC 组比较,BPD 组大鼠肺组织中VEGF、HIF-1α、HIF-2α mRNA 相对表达量均显著下调(P<0.05)。与BPD组比较,阿奇霉素组和布地奈德组大鼠肺组织中VEGF、HIF-1α、HIF-2α mRNA 相对表达量均显著上调(P<0.05)。阿奇霉素组与布地奈德组比较,差异无统计学意义(P>0.05)。结果见图2。
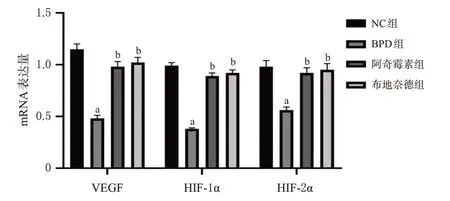
图2 各组大鼠肺组织中VEGF、HIF-1α 和HIF-2α mRNA表达比较(n=10)
3.6 大鼠肺组织中VEGF、HIF-1α和HIF-2α蛋白表达变化
与NC 组比较,BPD 组大鼠肺组织中VEGF、HIF-1α、HIF-2α 蛋白表达量均显著下调(P<0.05)。与BPD组比较,阿奇霉素组和布地奈德组大鼠肺组织中VEGF、HIF-1α、HIF-2α 蛋白表达量均显著上调(P<0.05)。阿奇霉素组与布地奈德组比较,差异无统计学意义(P>0.05)。结果见图3。
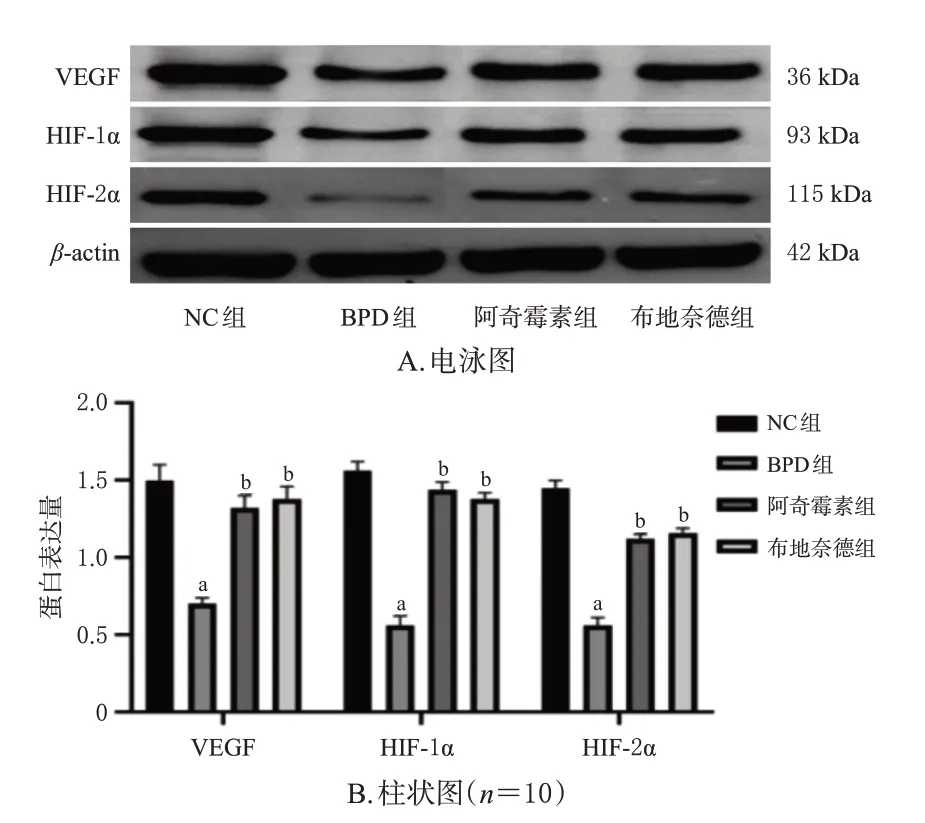
图3 各组大鼠肺组织中VEGF、HIF-1α 和HIF-2α 蛋白表达比较
4 讨论
BPD发生机制较复杂,早产儿出生后就存在肺发育不全的情况,加之吸入高浓度氧气,这就显著提高了早产儿BPD 的发生风险[7]。早产儿发生BPD 后可对其儿童及青春期的肺功能产生不同程度的影响,胎龄越小的早产儿,这两个时期的肺功能损伤率就越高[6]。目前人们公认吸入高浓度氧气可导致活性氧、自由基及促炎因子表达显著上调,对发育过程中的肺组织造成破坏并影响其修复,最终引发BPD[8―9]。中性粒细胞浸润及TNF-α、IL-6、IL-1β 等促炎因子的大量释放在BPD 发生发展过程中发挥着至关重要的作用[10]。本研究通过将大鼠置于高浓度氧气中暴露14 d的方式构建BPD模型,取其肺组织,经HE 染色后发现,BPD 大鼠肺组织发生明显损伤,肺泡融合变大且间隔不均匀,肺泡数量显著降低,有明显的炎症细胞浸润;除此之外,BPD 大鼠BALF 中白细胞计数、肺泡平均截距和TNF-α、IL-6、IL-1β、MDA水平均显著上调,放射状肺泡计数和SOD、CAT 水平均显著下调,这提示BPD大鼠建模成功。
阿奇霉素具有较强的抗炎及免疫调节作用,在降低肺功能损伤及感染方面效果显著;与其他大环内酯类抗生素不同的是,阿奇霉素可参与抑制内部形式半酮羧酸醛反应[11]。研究显示,阿奇霉素在促进嗜酸性粒细胞及白细胞凋亡等过程中作用显著,同时亦可对白细胞趋化活性产生影响,并阻止外周血中性粒细胞分泌活性氧簇,降低组胺水平,最终发挥抗炎作用[6,11]。既往报道显示,预防性使用阿奇霉素可有效降低机械通气早产儿BPD 的发生及死亡风险[12]。布地奈德作为一种糖皮质激素药物,已广泛应用于多种肺部疾病的治疗,具有高效的局部抗炎作用,在改善支气管炎、哮喘及防治BPD中发挥重要作用,因此本研究将布地奈德作为阳性对照药。本研究结果显示,与BPD 组比较,阿奇霉素组和布地奈德组大鼠肺组织中出现的BPD 病理症状均有所改善,BALF中白细胞计数、肺泡平均截距和TNF-α、IL-6、IL-1β、MDA水平均显著下调,放射状肺泡计数和SOD、CAT水平均显著上调,这说明阿奇霉素可改善因高浓度氧所致的BPD大鼠模型肺组织损伤,抑制炎症及氧化应激反应。
HIF-1α 及HIF-2α 均属于转录调控因子,可参与缺氧过程并发挥重要作用。研究发现,大鼠吸入高浓度氧后可抑制其末梢气道上皮细胞中HIF-2α/VEGF/VEGF受体信号通路激活,并下调VEGF 表达,抑制肺泡化进程,最终参与BPD发生[13]。本研究结果显示,与NC组比较,BPD组大鼠肺组织中VEGF、HIF-1α、HIF-2α mRNA相对表达量及蛋白表达量均显著下调,说明在BPD发生发展过程中HIF-1α/HIF-2α/VEGF信号通路的激活被抑制;而经阿奇霉素干预后,BPD 大鼠肺组织中上述指标均被逆转,这提示阿奇霉素可能通过激活HIF-1α/HIF-2α/VEGF 信号通路来改善BPD 大鼠模型肺组织损伤,抑制炎症及氧化应激反应,进而发挥肺保护作用。
综上所述,阿奇霉素可明显改善新生大鼠BPD的不良症状,抑制炎症及氧化应激反应,其作用机制可能是通过激活HIF-1α/HIF-2α/VEGF信号通路来实现肺保护作用。
