基于GABA能神经系统探究淫羊藿次苷Ⅱ的抗抑郁作用及机制 Δ
2024-02-02熊庭旺孙成新尹彩霞陈发菊遵义医药高等专科学校科研处贵州遵义56006遵义医药高等专科学校药学系贵州遵义56006遵义医科大学药学院贵州遵义56006贵州省中国科学院天然产物化学重点实验室贵阳5500
熊庭旺 ,张 珏 ,孙成新 ,尹彩霞 ,陈 犀 ,陈发菊 (.遵义医药高等专科学校科研处,贵州 遵义 56006;.遵义医药高等专科学校药学系,贵州 遵义 56006;.遵义医科大学药学院,贵州 遵义 56006;.贵州省中国科学院天然产物化学重点实验室,贵阳 5500)
抑郁症是以心境障碍、快感缺失为主要症状的一种精神、心理障碍性疾病,严重损害个人身心健康。目前全球抑郁症患者已超过2.6 亿,且发病率呈逐年上升趋势,给家庭和社会带来沉重负担[1]。现有抗抑郁药物大多存在治愈率不高、副反应较多、患者停药后易复发等不足。中医药文化历史悠久,中药资源丰富;同时,中药具有多成分、多靶点、综合治疗的特点,且多数中药安全范围较广,因此以中药为基础挖掘防治抑郁症的新药是近年来抗抑郁研究的一大热点[2]。
淫羊藿为小檗科植物淫羊藿EpimediumbrevicornuMaxim.、箭叶淫羊藿Epimediumsagittatum(Sieb. et Zucc.)Maxim.、柔毛淫羊藿EpimediumpubescensMaxim.或朝鲜淫羊藿EpimediumkoreanumNakai 的干燥叶,为临床常用中药,具有补肾阳、强筋骨、祛风湿等功效。现代药理研究表明,淫羊藿对心血管系统、免疫系统、神经系统等均有调节作用[3]。淫羊藿次苷Ⅱ(icariside Ⅱ,ICSⅡ)是淫羊藿的主要活性成分之一,对缺血性脑卒中和阿尔茨海默病模型动物具有较好的神经保护作用[3―4]。
γ 氨基丁酸(γ-aminobutyric acid,GABA)是机体重要的抑制性氨基酸神经递质之一,参与了神经元分化、迁移等过程;GABA能神经系统是目前抗抑郁研究的重要新靶点之一,降低谷氨酸(glutamic acid,Glu)含量、增加GABA含量对抑郁症具有积极的改善作用[5]。本研究综合考虑ICSⅡ及其他有效成分的抗抑郁、抗精神分裂作用[6],拟采用慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)法复制小鼠抑郁模型[7],基于GABA能神经系统初步探究ICSⅡ的抗抑郁活性及潜在机制,以期为该成分的进一步开发利用,以及以中医药为基础抗抑郁新药的研发提供参考。
1 材料
1.1 主要仪器
本研究使用的主要仪器有ZH-OFT型旷场行为学系统、ZH-QPT型强迫游泳实验系统、ZH-XWT型悬尾实验系统(安徽正华生物仪器设备有限公司),TP1020型自动组织脱水机、EG1150 型组织包埋机、CM2245 型轮转式石蜡切片机、DM6M 型光学显微镜(德国Leica 公司),iMark 型酶标仪、1658001 型电泳仪、GelDoc XR 型凝胶成像系统(美国Bio-Rad公司)等。
1.2 主要药品与试剂
ICSⅡ对照品(批号113558-15-9,经高效液相色谱法检测纯度不低于98%)购自成都德思特生物技术有限公司;草酸艾司西酞普兰片[简称“ECS”,阳性对照药,批号2202210,规格5 mg(以C20H21FN2O计)]由山东京卫制药有限公司生产;甲苯胺蓝染料(批号220220618)、BCA蛋白浓度测定试剂盒(批号PC0020)均购自北京索莱宝科技有限公司;GABA 酶联免疫吸附测定(ELISA)试剂盒(批号JL13490)、Glu ELISA试剂盒(批号JL13490)均购自南京建成生物工程研究所;兔β-肌动蛋白(β-actin)多克隆抗体(批号31662984)购自武汉三鹰生物技术有限公司;小鼠GABA A 受体α1[GABA A receptor alpha 1,GABA(A)Rα1]单克隆抗体(批号ab94585)、兔GABA囊泡转运体(vesicular GABA transporter,VGAT)多克隆抗体(批号ab42939)、小鼠谷氨酸脱羧酶67(glutamate decarboxylase 67,GAD67)单克隆抗体(批号ab26116)均购自英国Abcam 公司;兔GABA(B)R1 多克隆抗体(批号#3835)、兔GABA膜转运体3(GABA membranal transporter-3,GAT-3)多克隆抗体(批号#25438)均购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号21002)、辣根过氧化物酶标记的山羊抗小鼠IgG二抗(批号21005)均购自艾比玛特医药科技(上海)有限公司;ECL显影剂(批号16929851)购自美国GE Healthcare公司。
1.3 实验动物
SPF级昆明小鼠60只,雄性,体重18~22 g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号为SCXK(京)2019-0010。所有小鼠均饲养于每12 h 光照/黑暗循环、室温22~25 ℃、相对湿度50%~60%的环境下,自由进食、饮水。实验操作严格遵循实验动物伦理标准,实验方案经遵义医药高等专科学校科技伦理委员会审批(编号ZMPC-2308-001)。
2 方法
2.1 分组、造模与给药
将小鼠分为对照组(C 组,10 只)和造模组(50 只),造模组小鼠采用CUMS 法(含禁食、禁水、昼夜颠倒、光电刺激等刺激因素)造模,具体参照文献方法[8]实施。刺激21 d后,将造模组小鼠随机分为抑郁模型组(NS 组)、阳性对照药组(ECS 组)和ICSⅡ低、中、高剂量组(ICSⅡ-L、ICSⅡ-M、ICSⅡ-H 组),每组10 只。ICSⅡ-L、ICSⅡ-M、ICSⅡ-H 组小鼠分别灌胃10、20、30 mg/(kg·d)的ICSⅡ,ECS 组小鼠灌胃15 mg/(kg·d)的ECS,C 组和NS组小鼠灌胃等体积生理盐水,每天1次,连续14 d。各药物组剂量参照Yan 等[7]研究设置,以生理盐水为溶剂。
2.2 小鼠行为学检测
2.2.1 糖水偏爱率
于给药第10天开始糖水训练,即将各组小鼠单笼饲养,给予1%蔗糖溶液进行适应性训练48 h,期间定时交换蔗糖溶液和水的位置以防止位置偏爱。训练结束后禁水24 h,再于笼中放入1%蔗糖溶液和水各1 瓶,中途交换蔗糖溶液和水的位置1次。记录24 h内蔗糖溶液和水的消耗量,并按下式计算各组小鼠的糖水偏爱率:糖水偏爱率=蔗糖溶液消耗量/(蔗糖溶液消耗量+水消耗量)×100%[8]。
2.2.2 运动总距离
末次给药1 h后进行旷场实验。将小鼠于旷场箱固定角落以头朝上沿箱壁放入,观察其5 min 内的活动情况并记录运动总距离。每只小鼠测试结束后清理旷场箱并以乙醇擦拭,待挥干后,再进行下次测试。
2.2.3 静止不动时间
(1)悬尾实验:末次给药4 h后进行悬尾实验。将医用胶带粘于小鼠尾根2~3 cm 处,将小鼠固定并倒挂在悬尾实验架上,观察其5 min 内的活动情况并记录静止不动时间(以小鼠放弃挣扎视为静止不动)。每只小鼠测试结束后清理地面粪便并以乙醇擦拭,待挥干后,再进行下次测试。
(2)强迫游泳实验:末次给药10 h 后进行强迫游泳实验。将小鼠以头朝上沿强迫游泳实验桶桶壁放入水(水温约25 ℃)中,观察其5 min内在水中的活动情况并记录静止不动时间(以小鼠放弃挣扎视为静止不动)。每3只小鼠实验后换水1次。
2.3 小鼠海马组织病理形态学观察
行为学实验结束后,将小鼠麻醉并脱颈椎处死,采用尼氏染色法观察小鼠海马神经元形态及尼氏体情况。随机选取每组4只小鼠的全脑组织,置于多聚甲醛溶液中固定;取出,经脱水、石蜡包埋、切片、捞片、烤片、脱蜡、冲洗后,滴加甲苯胺蓝染色液于60 ℃下染色15 min;冲洗、脱水、透明后封片,使用光学显微镜观察各组小鼠海马CA3区神经元及尼氏体的形态,并对结构完整的神经元进行数量统计。
2.4 小鼠海马组织中GABA、Glu含量测定
取各组剩余6 只小鼠的部分海马组织,加入生理盐水适量,冰上匀浆、离心后取上清液,采用ELISA法以酶标仪检测其GABA、Glu 含量,并计算GABA/Glu 的比值。上述检测严格按照相应试剂盒说明书操作。
2.5 小鼠海马组织中GABA能神经系统相关蛋白表达水平检测
采用Western blot法进行检测。取“2.4”项下各组小鼠的剩余海马组织,于冰上匀浆并提取蛋白,以BCA法定量后进行变性处理。取变性蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜、封闭;洗膜后,加入β-actin、GABA(A)Rα1、GABA(B)R1、GAD67、GAT-3、VGAT一抗(稀释比例均为1∶1 000),孵育过夜;再次洗膜后,加入相应二抗(稀释比例均为1∶2 000),孵育2 h;洗膜后,加入ECL 显影剂显影,并置于凝胶成像系统下成像。使用Quantity One软件计算目的蛋白与内参蛋白(β-actin)的灰度值比值,以表示目的蛋白的表达水平(结果以C组为参照进行归一化处理)。
2.6 统计学方法
采用SPSS 18.0软件对数据进行统计分析。所有数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验(方差齐)或Dunnett’sT3检验(方差不齐)。检验水准α=0.05。
3 结果
3.1 ICSⅡ对小鼠行为学的影响
3.1.1 糖水偏爱率
与C 组比较,NS 组小鼠的糖水偏爱率显著降低(P<0.05);与NS 组比较,各药物组小鼠的糖水偏爱率均显著升高(P<0.05)。结果见图1A。

图1 ICSⅡ对小鼠行为学的影响(±s,n=10)
3.1.2 运动总距离
与C 组比较,NS 组小鼠的运动总距离显著缩短(P<0.05);与NS组比较,ECS组和ICSⅡ-H组小鼠的运动总距离均显著延长(P<0.05)。结果见图1B。
3.1.3 静止不动时间
与C 组比较,NS 组小鼠悬尾实验和强迫游泳实验的静止不动时间均显著延长(P<0.05);与NS 组比较,各药物组小鼠上述实验的静止不动时间均显著缩短(P<0.05)。结果见图1C、1D。
3.2 ICSⅡ对小鼠海马组织病理形态的影响
与C 组比较,NS 组小鼠海马CA3 区的神经元形态不规则,细胞核深染、固缩明显,尼氏体(呈蓝色,下同)减少,结构完整的神经元数量显著减少(P<0.05);与NS组比较,各药物组小鼠海马CA3 区的神经元均排列整齐、结构完整清晰,尼氏体增多,结构完整的神经元数量均显著增加(P<0.05)。结果见图2、图3A。

图2 ICSⅡ对小鼠海马组织病理形态的影响(标尺=50 μm)

图3 ICSⅡ对小鼠海马CA3区神经元数量和海马组织中GABA、Glu含量及比值的影响
3.3 ICSⅡ对小鼠海马组织中GABA、Glu含量的影响
与C 组比较,NS 组小鼠海马组织中GABA 含量和GABA/Glu 比值均显著降低(P<0.05),Glu 含量显著升高(P<0.05);与NS 组比较,各药物组小鼠海马组织中GABA 含量和GABA/Glu 比值均显著升高(P<0.05),Glu含量均显著降低(P<0.05)。结果见图3B~3D。
3.4 ICSⅡ对小鼠海马组织中GABA 能神经系统相关蛋白表达的影响
与C组比较,NS组小鼠海马组织中GABA(A)Rα1、GABA(B)R1、GAD67、GAT-3、VGAT 蛋白的表达水平均显著降低(P<0.05);与NS 组比较,各药物组小鼠海马组织中GABA(A)Rα1(ICSⅡ-L组除外)、GABA(B)R1(ICSⅡ-H 组除外)、GAD67、GAT-3(ICSⅡ-L、ICSⅡ-M组除外)、VGAT蛋白的表达水平均显著升高(P<0.05)。结果见图4。
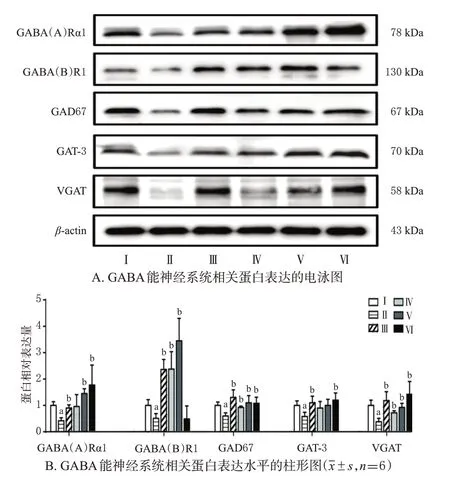
图4 ICSⅡ对小鼠海马组织中GABA能神经系统相关蛋白表达的影响
4 讨论
CUMS 由光电刺激、噪声刺激、夹尾、禁食、禁水等多种刺激因素组成,是模拟人类长期遭遇压力、挫折致抑郁的常用动物模型,其操作简便且造模成功率高[8―9]。经CUMS 刺激后,动物表现出快感缺失、行为绝望及自发活动减少等特征[8]。本研究结果显示,经CUMS 诱导后,NS组小鼠的糖水偏爱率显著降低,旷场实验的运动总距离显著缩短,悬尾实验和强迫游泳实验的静止不动时间均显著延长,表明其出现了明显的快感缺失、行为绝望特征,提示造模成功。经ICSⅡ干预后,小鼠上述行为得到了不同程度的改善,提示ICSⅡ具有一定的抗抑郁活性。
尼氏体是神经元的特征性结构之一,能被甲苯胺蓝等碱性染料染成蓝色或蓝紫色。当神经元受到刺激时,尼氏体会减少,其尼氏染色切片颜色较浅[10]。研究指出,长期应激刺激最先受损的大脑核团是海马组织[10]。因此,本研究采用尼氏染色法观察了小鼠海马CA3区的受损情况,结果显示,NS 组小鼠神经元明显丢失,细胞核深染、固缩增多,变性坏死增加,尼氏体减少,完整的神经元数量显著减少,与既往文献报道基本一致[1,10]。经ICSⅡ干预后,各药物组小鼠神经元的损伤情况明显减轻,完整的神经元数量均显著增多,提示ICSⅡ对CUMS 所致的小鼠海马神经元损伤具有明显的改善作用。
GABA和Glu分别是中枢神经系统中重要的抑制性和兴奋性神经递质。GABA以Glu为底物,在GAD的作用下合成,后经中间神经元释放,进而参与神经元的迁移、分化及神经环路形成[7]。研究表明,抑郁患者脑内GABA能中间神经元丢失,GABA含量降低,Glu含量增加,GABA、Glu含量严重失衡,GABA的转运速率降低,重摄取的GABA 增加,突触间隙的GABA 减少;同时,GABA受体表达下调,呈现出GABA能神经系统功能低下的状态[7,11]。抗抑郁药物可通过增加GABA 含量,调节GABA 的合成、释放、转运及受体相关蛋白的表达等方式来发挥对实验动物抑郁症状的改善作用[7,12]。本研究结果显示,NS 组小鼠海马组织中Glu 含量显著升高,GABA 含量和GABA/Glu 比值均显著降低,GABA 能神经系统相关蛋白GAD67、GAT-3、VGAT蛋白的表达均显著下调;经ICSⅡ干预后,小鼠上述大部分指标均得以逆转,提示ICSⅡ对GABA能神经系统有一定的调节作用。
GABA(B)R在突触前、后膜均有分布,GABA(B)R、GABA(A)R 是多种抗精神疾病药物的重要靶点,阻断或敲除GABA(B)R 编码基因能促进神经元增殖,同时上调GABA(B)R、GABA(A)R 蛋白及基因的表达与药物抗抑郁作用的积极发挥密切相关[7,13]。本研究结果显示,经CUMS 诱导后,小鼠海马组织中GABA(A)Rα1、GABA(B)R1 蛋白的表达均显著下调;经药物干预后,ECS 组和ICSⅡ-M、ICSⅡ-H 组小鼠海马组织中GABA(A)Rα1 蛋白,以及ECS 组和ICSⅡ-L、ICSⅡ-M组小鼠海马组织中GABA(B)R1 蛋白的表达均显著上调。但需注意的是,ICSⅡ-H 组小鼠海马组织中GABA(B)R1 蛋白的表达水平与NS 组接近,这可能与不同(剂量)药物对GABA(B)R的影响有所差异相关[13]:阳性对照药和低、中剂量的ICSⅡ可能通过上调突触后膜GABA(B)R 的表达来发挥受体后效应,从而激活GABA 能神经系统,最终发挥积极的抗抑郁作用;而高剂量的ICSⅡ则可能通过下调突触前膜GABA(B)R的表达,从而使GABA 的重摄取减少、突触间隙GABA含量增加,最终发挥改善小鼠抑郁样行为的积极作用,但具体机制有待后续研究进一步验证。
综上所述,ICSⅡ能够改善抑郁模型小鼠的抑郁样行为,其机制可能与调节GABA、Glu 平衡,增加GABA的合成、转运、释放及调节相关受体的表达进而改善GABA 能神经系统功能有关。本课题组下一步将采用不同的抑郁模型围绕抑郁症的其他发病机制,并结合体内、体外实验方法充分论证ICSⅡ的抗抑郁作用。
