光皮木瓜特征图谱及3种黄酮类成分含量测定研究 Δ
2024-02-02朱田密陈树和严劲松王新桂段雨晴杨孝义湖北省中医院湖北中医药大学附属医院湖北省中医药研究院药事部武汉43006湖北中医药大学药学院武汉430065
朱田密 ,陈树和 ,严劲松 ,王新桂 ,段雨晴 ,杨孝义 (.湖北省中医院/湖北中医药大学附属医院/湖北省中医药研究院药事部,武汉 43006;.湖北中医药大学药学院,武汉 430065)
光皮木瓜是蔷薇科木瓜属植物木瓜Chaenomeles sinensis(Thouin) Koehne 的成熟或近成熟果实,又名榠楂、木李[1―2],因果皮干燥后仍光滑,不皱,故称“光皮木瓜”[1]。其果实清香,味酸、涩,性平,具有和胃舒筋、祛风除湿、消痰止咳之功效[2],可药食两用,易与皱皮木瓜[蔷薇科木瓜属植物贴梗海棠C.speciosa(Sweet) Nakai 的果实]混淆[3]。光皮木瓜含有丰富的黄酮类、有机酸类、挥发油、萜类、生物酶以及维生素C、粗纤维等成分,具有抗氧化、抗菌消炎、抗过敏以及保护神经等多种活性[4―6]。光皮木瓜在我国有着悠久的药用史和栽培史,其药品标准已被湖南、湖北、陕西等地的中药材质量标准或炮制规范收载。关于光皮木瓜的质量控制,目前仅少数省份的质量标准规定了总黄酮、总有机酸的含量。近年来,虽也有光皮木瓜中齐墩果酸、熊果酸含量测定的文献报道和指纹图谱研究,但未指认化学成分,或仅指认图谱中的1~2种成分[7―9]。笔者前期经薄层色谱已鉴别出光皮木瓜中含有绿原酸、芦丁、金丝桃苷、槲皮苷,并且发现光皮木瓜中含有的黄酮类成分比皱皮木瓜多[10]。为此,本文采用高效液相色谱(HPLC)法建立光皮木瓜的特征图谱及3种黄酮类成分(芦丁、金丝桃苷、槲皮苷)的含量测定方法,以期更全面地控制光皮木瓜质量。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Waters e2695型HPLC仪(美国Waters 公司)、ES 225SM-DR 型电子天平(瑞士Precisa 公司)、KQ-500VDE 型双频数控超声波清洗器(昆山市超声波仪器有限公司)、FW177型高速万能粉碎机(北京市永光明医疗仪器有限公司)、UPT-Ⅱ-10T型超纯水器(成都超纯科技有限公司)。
1.2 主要药品与试剂
绿原酸对照品(批号110753-202018,纯度96.1%)、芦丁对照品(批号100080-202012,纯度91.6%)、金丝桃苷对照品(批号111521-201809,纯度94.9%)、槲皮苷对照品(纯度111538-202007,纯度93.5%)均购自中国食品药品检定研究院;乙腈为色谱纯,其他试剂均为分析纯,水为超纯水。
光皮木瓜药材、皱皮木瓜药材均由湖北中医药大学药学院陈科力教授鉴定,分别为蔷薇科木瓜属植物木瓜C.sinensis(Thouin) Koehne的干燥果实,蔷薇科木瓜属植物贴梗海棠C.speciosa(Sweet) Nakai 的干燥果实。样品与植物标本保存于湖北省中医药研究院,具体来源信息见表1。
表1 光皮木瓜和皱皮木瓜样品的来源信息
2 方法与结果
2.1 HPLC特征图谱的建立
2.1.1 色谱条件
以Agilent 5 TC-C18(4.6 mm×250 mm,5 μm)为色谱柱;以乙腈(A)-0.2%磷酸溶液(B)为流动相进行梯度洗脱(0~5 min,10%A→20%A;5~28 min,20%A→30%A;28~32 min,30%A→90%A;32~36 min,90%A;36~44 min,90%A→10%A);检测波长为330 nm,辅以全波长扫描210~400 nm;流速为1.0 mL/min;柱温为30 ℃;进样量为10 μL。
2.1.2 供试品溶液的制备
取样品药材粉末(过3 号筛)约1.0 g,精密称定,置于具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声(功率400 W,频率45 kHz)处理30 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,用0.45 μm 微孔滤膜滤过,即得。
2.1.3 对照品溶液的制备
称取绿原酸、芦丁、金丝桃苷、槲皮苷对照品8.02、9.28、8.70、9.26 mg,精密称定,分别置于25 mL 容量瓶中,用甲醇溶解至刻度,配成质量浓度分别为308.29、340.02、330.25、346.32 μg/mL的单一对照品溶液。分别精密吸取以上4种单一对照品溶液1.0、2.0、0.2、1.3 mL,置于同一25 mL容量瓶中,加甲醇至刻度,再精密吸取2 mL,置于5 mL容量瓶中,加甲醇至刻度,配成绿原酸、芦丁、金丝桃苷、槲皮苷质量浓度分别为4.93、10.88、1.06、7.20 μg/mL的混合对照品溶液。
2.1.4 精密度试验
取编号为S2 的光皮木瓜药材粉末,按照“2.1.2”项下方法制备供试品溶液,再按照“2.1.1”项下色谱条件连续进样测定6次。以芦丁为参照峰,计算得到各共有峰相对保留时间的RSD均小于0.33%(n=6),相对峰面积的RSD均小于2.91%(n=6),表明方法精密度良好。
2.1.5 稳定性试验
取编号为S2 的光皮木瓜药材粉末,按照“2.1.2”项下方法制备供试品溶液,分别于制备后0、2、6、12、18 h时按照“2.1.1”项下色谱条件进样测定。以芦丁为参照峰,计算得到各共有峰相对保留时间的RSD 均小于0.52%(n=5),相对峰面积的RSD均小于3.52%(n=5),表明供试品溶液在室温下放置18 h内稳定性良好。
2.1.6 重复性试验
取编号为S2 的光皮木瓜药材粉末,按照“2.1.2”项下方法平行制备供试品溶液6 份,再按照“2.1.1”项下色谱条件进样测定。以芦丁为参照峰,计算得到各共有峰相对保留时间的RSD均小于0.21%(n=6),相对峰面积的RSD均小于3.73%(n=6),表明方法重复性良好。
2.1.7 光皮木瓜特征图谱的建立与相似度评价
分别精密称取15 批光皮木瓜药材(编号S1~S15)粉末1.0 g,按照“2.1.2”项下方法制备供试品溶液,再按照“2.1.1”项下色谱条件进样测定,记录色谱图。将15批样品的色谱图以AIA文件格式导入《中药色谱指纹图谱相似度评价系统(2012版)》,以图谱轮廓较为典型的S1为参照图谱,采用多点校正法进行匹配,以平均数法生成对照指纹图谱(R)。样品叠加图谱和对照指纹图谱见图1。将15批样品与对照指纹图谱进行相似度评价,结果显示,15 批样品共确定了11 个特征峰,相似度为0.783~0.969,表明15批样品的相似度良好,化学成分具有一致性。
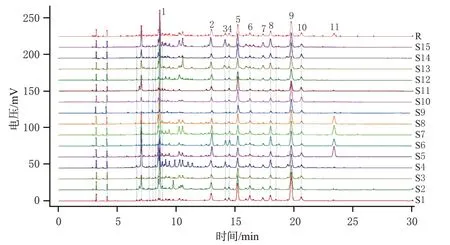
图1 15批光皮木瓜药材的HPLC图谱和对照指纹图谱(R)
2.1.8 色谱峰的指认及相对保留时间和相对峰面积的计算
在15批光皮木瓜药材的共有峰中选择11个峰作为特征峰,通过与混合对照品溶液图谱(图2)中各峰的保留时间及紫外吸收光谱进行比对,共指认出4种成分,分别是1 号峰绿原酸、2 号峰芦丁、3 号峰金丝桃苷、8 号峰槲皮苷。其中2号峰的峰面积与保留时间适中,故以其为参照峰计算其他特征峰的相对保留时间和相对峰面积,结果见表2。
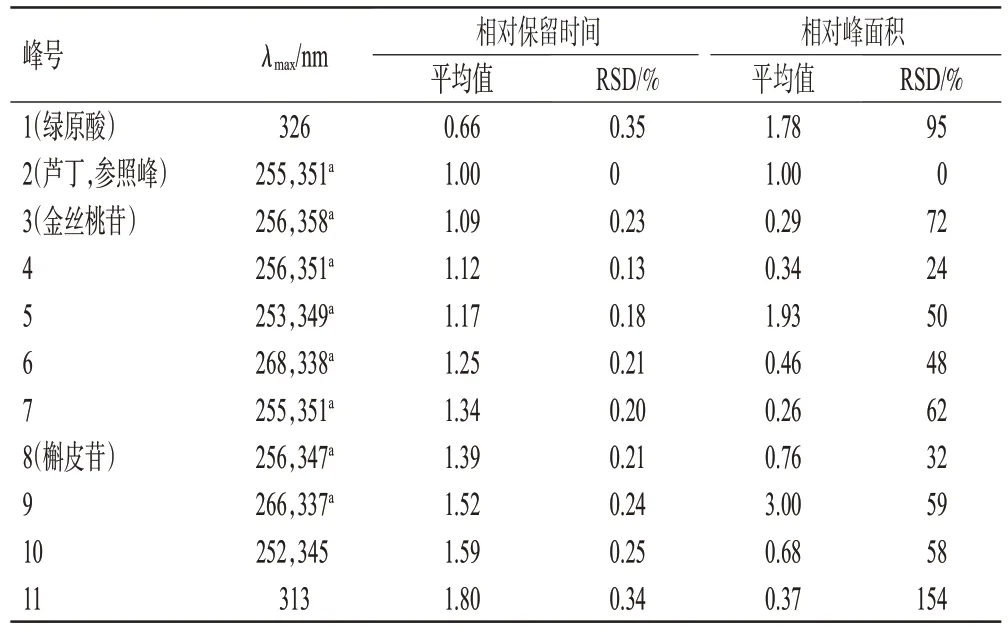
表2 15批光皮木瓜特征峰相对保留时间和相对峰面积的统计结果
2.1.9 不同地区光皮木瓜药材的差异分析
使用SPSS 23.0软件对15批光皮木瓜药材HPLC特征图谱的10个特征峰[2号峰~11号峰,由于1号峰绿原酸在同一产地的不同样品中亦可发生较大变化(如样品S1 和S2 中,S3 和S4 中),故不纳入产地差异分析]的峰面积进行聚类分析,采用组间连接法,以余弦距离为度量标准进行聚类,当余弦距离大于15时,15批样品聚为2类:S5~S8为一类,其他为一类(图3)。S5~S8来自湖北省建始县和房县,其特征是11号峰显著,而其他批次样品中该色谱峰较微弱,其中S3、S12~S15样品中均未检出该峰,故特征图谱在一定程度上反映了产地差异。
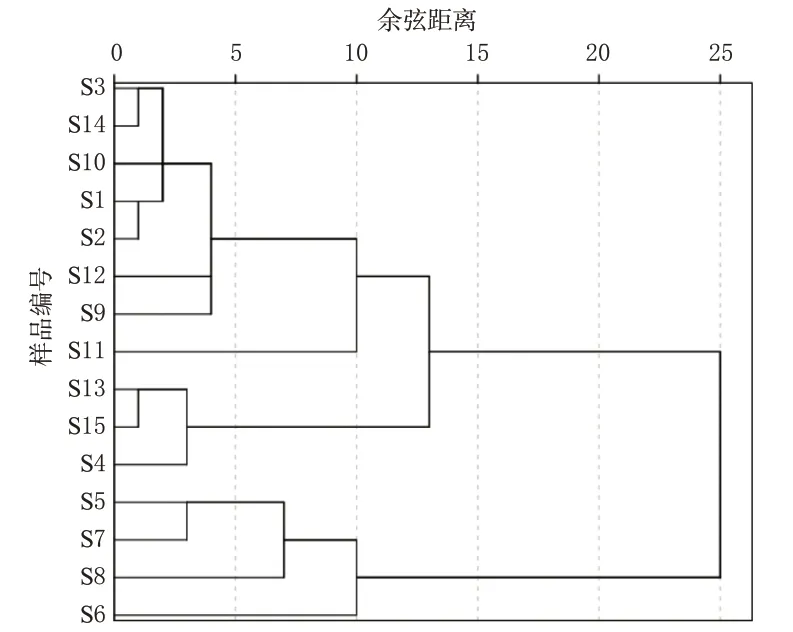
图3 15批光皮木瓜药材的聚类分析树状图
2.1.10 光皮木瓜与皱皮木瓜的特征图谱比较
皱皮木瓜是光皮木瓜最常见的混淆品,二者为同科同属近缘种,故以皱皮木瓜药材(编号S16~S22)与光皮木瓜药材进行对比。按照“2.1.2”项下方法制备7批皱皮木瓜的供试品溶液,再按照“2.1.1”项下色谱条件进样测定,记录色谱图(图4)。对比光皮木瓜对照指纹图谱(R)与皱皮木瓜的特征图谱发现,两种药材存在明显差异:7批皱皮木瓜的HPLC 图谱中也含有绿原酸色谱峰(1 号峰),且极为显著,远高于光皮木瓜,同时还含有较弱的2号峰(芦丁)以及4 号峰;除了S20 样品检出微弱的3 号峰(金丝桃苷),其他6批皱皮木瓜中均未检出3号峰;此外,7批皱皮木瓜均未检出5~11号峰。

图4 光皮木瓜对照指纹图谱(R)和皱皮木瓜药材的HPLC色谱图谱
2.2 3种黄酮类成分的含量测定
2.2.1 色谱条件
除检测波长为350 nm,其余色谱条件同“2.1.1”项。
2.2.2 供试品溶液的制备
供试品溶液的制备方法同“2.1.2”项。
2.2.3 对照品溶液的制备芦丁、金丝桃苷、槲皮苷混合对照品溶液的制备方法,除不加绿原酸对照品,其余同“2.1.3”项。
2.2.4 系统适用性试验
精密吸取“2.2.3”项下混合对照品溶液和“2.2.2”项下供试品溶液各10 μL,按照“2.2.1”项下色谱条件进样测定。结果显示,芦丁、金丝桃苷、槲皮苷的色谱峰与相邻色谱峰的分离度均大于1.5,理论板数以芦丁计不低于10 000。结果见图5。
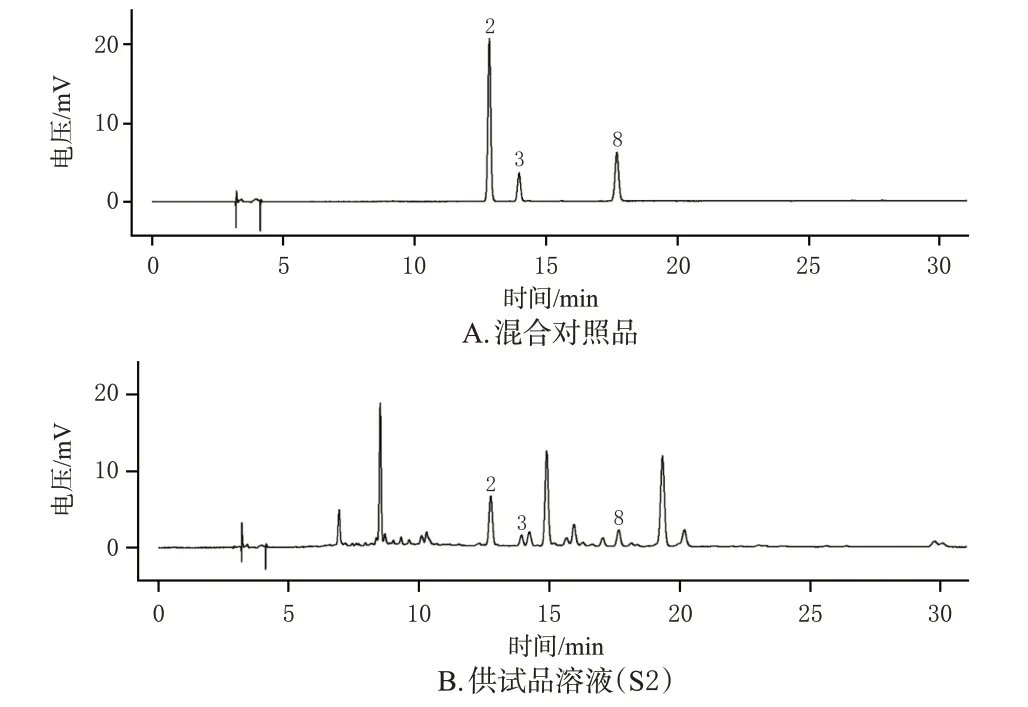
图5 混合对照品溶液和供试品溶液的HPLC图
2.2.5 线性关系考察
分别精密称取芦丁、金丝桃苷、槲皮苷对照品适量,用甲醇配成芦丁质量浓度分别为54.40、21.76、5.44、2.18、0.87、0.44 μg/mL,金丝桃苷质量浓度分别为10.57、4.23、1.06、0.42、0.17、0.08 μg/mL,槲皮苷质量浓度分别为27.71、11.08、2.77、1.11、0.44、0.22 μg/mL 的系列混合对照品溶液。按照“2.2.1”项下色谱条件进样测定,记录色谱,以各对照品的质量浓度(X)为横坐标、峰面积(Y)为纵坐标绘制标准曲线。结果见表3。

表3 3种待测成分的回归方程与线性范围
2.2.6 定量限与检测限考察
精密量取“2.2.3”项下混合对照品溶液,用甲醇倍比稀释后,按照“2.2.1”项下色谱条件进样测定,以信噪比10∶1、3∶1分别计算定量限、检测限。结果显示,芦丁、金丝桃苷、槲皮苷的定量限分别为0.13、0.08、0.07 μg/mL;检测限分别为0.04、0.02、0.02 μg/mL。
2.2.7 精密度试验
取“2.2.2”项下供试品溶液(编号S2),按照“2.2.1”项下色谱条件连续进样测定6次。结果显示,芦丁、金丝桃苷、槲皮苷峰面积的RSD 分别为1.53%、4.21%、2.90%(n=6),表明方法精密度良好。
2.2.8 稳定性试验
取编号为S2 的光皮木瓜药材粉末,按照“2.2.2”项下方法制备供试品溶液,分别于制备后0、2、6、12、18 h时按照“2.2.1”项下色谱条件进样测定。结果显示,芦丁、金丝桃苷、槲皮苷峰面积的RSD 分别为2.50%、4.05%、3.67%(n=5),表明供试品溶液于室温放置18 h内稳定性良好。
2.2.9 重复性试验
取编号为S2 的光皮木瓜药材粉末,按照“2.2.2”项下方法平行制备供试品溶液6 份,再按照“2.2.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算含量。结果显示,芦丁、金丝桃苷、槲皮苷含量的RSD 分别为2.66%、4.46%、4.11%(n=6),表明该方法重复性良好。
2.2.10 加样回收率试验
取编号为S2的已知含量的光皮木瓜药材粉末6份,每份0.5 g,精密称定,分别按已知含量的1∶1加入芦丁、金丝桃苷、槲皮苷对照品,按照“2.2.2”项下方法制备供试品溶液,再按照“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果显示,芦丁、金丝桃苷、槲皮苷的加样回收率分别为89.85%~94.83%、94.63%~103.94%、94.76%~101.96%,RSD 分别为2.17%、3.46%、2.92%(n=6)。
2.2.11 样品含量测定
取15 批光皮木瓜药材和7 批皱皮木瓜药材,按照“2.2.2”项下方法制备供试品溶液,再按照“2.2.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算含量,每批样品测2次。结果显示,光皮木瓜药材中芦丁含量高于皱皮木瓜药材,且皱皮木瓜药材中均未检出金丝桃苷(S20样品除外)和槲皮苷。结果见表4。

表4 15 批光皮木瓜药材和7 批皱皮木瓜药材中3 种黄酮类成分的含量测定结果(μg/g,n=2)
3 讨论
3.1 检测波长的选择
绿原酸与黄酮类均是光皮木瓜药材的特征性成分,特征图谱的检测波长选择330 nm,能够兼顾显示这两类成分。经全波长扫描发现,光皮木瓜药材中大多数黄酮类成分的最大吸收波长位于350 nm附近,故含量测定选取检测波长为350 nm,且所受其他色谱峰的干扰最小,能满足含量测定的要求。
3.2 光皮木瓜特征图谱差异的影响因素
各特征峰在不同样品中的相对保留时间一致,但相对峰面积差异较大(表2),可能是由样品中次生代谢产物表达量的高低不同所致,该现象在中药材特征图谱中较为常见。光皮木瓜药材的特征图谱除了与产地有一定关系(见“2.1.9”项),还受果实个体差异和批次的影响,例如S1与S2来自同一产地,二者的特征图谱中前段色谱峰强弱不同,但中段(黄酮类)色谱峰强弱很相似;此外还可能受加工方式的影响,例如笔者对湖北省郧阳区产的S1、S2鲜果采取了不同的加工方式(S1为鲜果剖开后直接晒干,S2为鲜果剖开后用沸水烫后晒干),结果发现,二者的特征图谱前段显示色谱峰强弱有差别。
3.3 光皮木瓜和皱皮木瓜药材中黄酮类成分含量比较
本文比较了15 批光皮木瓜药材与7 批皱皮木瓜药材中黄酮类成分的含量,结果显示,光皮木瓜药材中黄酮类成分的种类和含量均较皱皮木瓜药材多,与季荣进等[11]进行的黄酮理化鉴别结果“皱皮木瓜显天蓝色荧光,光皮木瓜显鲜黄色荧光”一致,且与笔者前期报道结果一致[10]。
综上所述,本研究所建立的光皮木瓜的特征图谱和3种黄酮类成分的含量测定方法可用于光皮木瓜的质量控制及其与皱皮木瓜的鉴别。
