银杏叶提取物对糖尿病肾病模型小鼠肾脏炎症的抑制作用及机制 Δ
2024-02-02杨小艺许惠琴吕志阳南京中医药大学翰林学院药学院江苏泰州5300南京中医药大学药学院南京003
陈 璟 ,杨小艺 陈 静 单 鑫 汪 洁 许惠琴 ,吕志阳 (.南京中医药大学翰林学院药学院,江苏泰州 5300;.南京中医药大学药学院,南京 003)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)患者常见且难治的慢性微血管并发症,是终末期肾病(end-stage renal disease,ESRD)的主要病因[1]。研究显示,DN与炎症反应和巨噬细胞极化密切相关,其中糖代谢异常是其炎症发病机制之一;持续高血糖可导致晚期糖基化终末产物(advanced glycation end products,AGEs)形成,而AGEs是DN发生、发展的关键物质[2]。巨噬细胞与DM 模型动物高血糖水平、肾小球免疫复合物沉积及进行性纤维化、趋化因子增加密切相关:一方面,M1型巨噬细胞可通过分泌促炎因子[白细胞介素1β(interleukin-1β,IL-1β)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等]而促进炎症反应,引起肾固有细胞损伤[3];另一方面,M2型巨噬细胞则可通过分泌大量抗炎因子[IL-10、精氨酸酶1(arginase-1,Arg-1)等]来抑制炎症反应,从而发挥促进损伤组织修复重建的作用[4]。
银杏叶提取物(Ginkgobilobaextract,GBE)是从银杏叶中提取的活性物质,以银杏黄酮类、银杏内酯类为主要活性成分,具有抗氧化、抗血小板聚集、抗血栓、改善血液循环等活性。研究指出,GBE能降低DM模型大鼠的血糖,减少炎症因子的分泌和细胞外基质的堆积,改善肾损伤[5];可通过蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路来预防肾纤维化,从而延缓DN 的发生发展[6];能减少DN模型小鼠的蛋白尿,减轻肾小管损伤,抑制内质网应激,从而改善其肾功能[7]。可见,GBE有一定的肾脏保护活性。
据国内外研究报道,AGEs-晚期糖基化终末产物受体(the receptor of advanced glycation end products,RAGE)轴参与了巨噬细胞极化的调控过程,可上调M1巨噬细胞标志分子IL-6、IL-1β、肿瘤细胞坏死因子α、iNOS、CD11c、CD86的表达,下调M2型巨噬细胞标志分子IL-10、Arg-1、CD206 的表达,从而介导DM 血管病变[8]。此外,Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)/Rho 相关螺旋卷曲蛋白激酶(Rho-associated coiled-coil forming protein kinase,ROCK)信号通路是促进巨噬细胞从M2型向M1型转化的核心环节[9]。本课题组前期研究发现,通过干预巨噬细胞极化而抑制炎症可能是延缓DN 进展的有效途径[10―11]。考虑到AGEs-RAGE/RhoA/ROCK 信号通路与DN的发生发展密切相关[12],故本研究拟通过建立DN小鼠模型,观察GBE 对其巨噬细胞极化和肾脏炎症的影响,并分析其机制是否与抑制AGEs-RAGE/RhoA/ROCK信号通路有关,以期为DN的防治提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Synergy HT型酶标仪(美国Bio-Tek公司)、Contour TS型血糖仪(德国Bayer Vital GmbH)、Ti 型倒置荧光显微镜(日本Nikon 公司)、CKX31型光学显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
GBE 片[批号4380420,规格为每片含GBE 40 mg(总黄酮醇苷9.6 mg、萜类内酯2.4 mg)]购自德国Dr. Willimar Schwabe GmbH & Co. KG;盐酸二甲双胍片(批号ABV0983,规格0.5 g)购自中美上海施贵宝制药有限公司;血糖试纸(批号201807)购自拜耳医药(上海)有限公司;血肌酐(serum creatinine,Scr)检测试剂盒(批号20191008)购自南京建成生物工程研究所;小鼠单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)、IL-10、IL-12、血尿素氮(blood urea nitrogen,BUN)酶联免疫吸附测定(ELISA)试剂盒(批号分别为202002、202009、202005、202010)均购自上海酶联生物科技有限公司;AGEs ELISA 试剂盒(批号202008)购自南京翼飞雪生物科技有限公司;兔β-肌动蛋白(β-actin)单克隆抗体(批号AP0060)购自美国Bioworld 公司;兔iNOS 多克隆抗体、山羊Arg-1 多克隆抗体、兔RAGE 多克隆抗体、兔RhoA单克隆抗体、兔重组ROCK1+ROCK2单克隆抗体(批号分别为ab15323、ab60176、ab3611、ab187027、ab45171)均购自英国Abcam 公司;辣根过氧化物酶(HRP)标记的兔抗山羊免疫球蛋白G(IgG)二抗(批号SE238)购自北京索莱宝科技有限公司;HRP标记的山羊抗兔IgG二抗(批号7074P2)购自美国CST公司。
1.3 实验动物及饲料
10~12 周龄的SPF 级雄性KK/Ay 小鼠(24 只)和10~12 周龄的SPF 级雄性C57BL/6J 小鼠(6 只)均购自北京华阜康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2020-0004。高脂高糖饲料(含脂肪17.9%、蛋白17.5%、碳水化合物48.5%)购自北京华阜康生物科技股份有限公司,普通饲料购自南京青龙山动物繁殖场。所有动物均饲养于南京中医药大学SPF 动物中心(温度20~25 ℃,相对湿度55%),自由摄食、饮水。本研究方案遵循南京中医药大学实验动物伦理委员会的相关规定(动物伦理申请号201903A019)。
2 方法
2.1 模型建立
检测KK/Ay 小鼠的血糖,将血糖水平≥10 mmol/L者作为DM小鼠;高脂高糖饲料喂养2周后,将24 h尿蛋白升高10倍以上的DM小鼠作为DN模型小鼠[13]。
2.2 分组与给药
将DN模型小鼠随机分为模型组、阳性对照组[二甲双胍,200 mg/(kg·d)]以及GBE 低、高剂量组[100、200 mg/(kg·d)],每组6只;另取以普通饲料喂养的C57BL/6J小鼠6只,作为对照组。各药物组剂量根据本课题组前期研究结果及相关文献[6,14]设定,并按10 mL/kg 灌胃相应药液(以水为溶剂),对照组和模型组小鼠灌胃等体积生理盐水,每天1次,连续8周。
2.3 取样及处理
分别于灌胃0、4、8周时,称定各组小鼠体重,检测并记录其空腹血糖和24 h 摄食量、尿量。末次给药后,于各组小鼠眼眶取血,至少静置0.5 h 后,以3 000 r/min 离心15 min,吸取上层血清于0.5 mL EP管中,备用;同时,处死各组小鼠,分离其两侧肾脏并称重,计算其双侧肾脏质量与体重的比值。
2.4 小鼠血清生化指标检测
取“2.3”项下各组小鼠的血清样品,参照相关试剂盒说明书方法操作,以酶标仪检测其血清中趋化因子(MCP-1)、炎症因子(IL-12、IL-10)、肾功能相关指标(BUN、Scr)、AGEs水平。
2.5 小鼠肾脏病理损伤和纤维化改变观察
采用HE、Masson染色法分别进行观察。取“2.3”项下各组小鼠左侧肾脏适量,分离皮质层,横切后置于10%甲醛固定液中固定,经脱水、石蜡包埋后切片,分别进行HE、Masson染色,使用显微镜观察其肾脏病理损伤和纤维化改变。按病变严重程度进行肾损伤评分:无病变记0分,轻微病变记0.5分,轻度病变记1分,中度病变记2分,重度病变记3分;同时,使用Image J软件对肾间质纤维化(蓝色为纤维化区域)比例进行半定量分析[15]。
2.6 小鼠肾皮质中巨噬细胞标志蛋白及AGEs-RAGE/RhoA/ROCK信号通路相关蛋白表达检测
采用Western blot法检测。取“2.3”项下各组小鼠左侧肾脏适量,分离皮质层,经裂解后,取裂解液分装于1.5 mL EP管中,于4 ℃下以12 000 r/min离心10 min;收集上清液,以BCA 法测定蛋白浓度后,于95 ℃下作变性处理。取变性蛋白适量,经电泳分离后湿法转膜,用5% 牛血清白蛋白封闭;加入Arg-1、iNOS、RAGE、RhoA、ROCK1、β-actin一抗(稀释比例分别为1∶15 000、1∶1 000、1∶1 000、1∶5 000、1∶5 000、1∶5 000),于4 ℃下孵育过夜;以PBST 缓冲液洗膜15 min×4 次后,加入兔抗山羊IgG 二抗、山羊抗兔IgG 二抗(稀释比例分别为1∶10 000、1∶5 000),于室温下孵育2 h;以PBST 缓冲液洗膜15 min×4次,以化学发光液避光显影,并置于凝胶成像系统下成像。利用Image J软件分析各蛋白条带的灰度值,以目的蛋白与内参蛋白(β-actin)的灰度值比值作为目的蛋白的表达水平。
2.7 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,Graphpad Prism 9软件作图。符合正态分布的计量资料以±s表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 GBE 对DN 模型小鼠体重、空腹血糖、摄食量及尿量的影响
灌胃0、4、8 周时,模型组小鼠的体重均显著高于对照组(P<0.01);灌胃8 周时,各药物组小鼠的体重均显著高于模型组(P<0.01)。灌胃0、4、8周时,模型组小鼠的空腹血糖和24 h摄食量、尿量均显著高于对照组(P<0.01);灌胃4、8 周时,各药物组小鼠上述指标均显著低于模型组(P<0.01)。结果见图1。

图1 GBE对DN模型小鼠体重、空腹血糖、摄食量及尿量的影响(±s,n=6)
3.2 GBE 对DN 模型小鼠血清趋化因子和炎症因子水平的影响
与对照组比较,模型组小鼠血清MCP-1、IL-12水平显著升高,IL-10 水平显著降低(P<0.01);与模型组比较,各药物组小鼠血清MCP-1、IL-12 水平均显著降低,IL-10水平均显著升高(P<0.01)。结果见表1。
表1 GBE对DN模型小鼠MCP-1、IL-12、IL-10水平的影响(±s,n=6,pg/mL)

表1 GBE对DN模型小鼠MCP-1、IL-12、IL-10水平的影响(±s,n=6,pg/mL)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别对照组模型组阳性对照组GBE低剂量组GBE高剂量组IL-10 297.01±25.28 194.38±20.39a 274.49±23.17b 274.63±21.61b 296.25±22.57b MCP-1 14.39±1.63 21.02±2.82a 15.48±2.37b 15.01±2.84b 13.98±2.39b IL-12 41.85±3.19 66.69±6.90a 45.88±5.43b 52.72±2.93b 45.19±5.33b
3.3 GBE对DN模型小鼠肾功能相关指标的影响
与对照组比较,模型组小鼠血清BUN、Scr水平和双侧肾脏质量与体重的比值均显著升高(P<0.01)。与模型组比较,各药物组小鼠上述指标均显著降低(P<0.01)。结果见表2。
表2 GBE对DN模型小鼠肾功能相关指标的影响(±s,n=6)

表2 GBE对DN模型小鼠肾功能相关指标的影响(±s,n=6)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别对照组模型组阳性对照组GBE低剂量组GBE高剂量组双侧肾脏质量与体重的比值/%5.32±0.04 8.99±0.07a 5.83±0.11b 5.45±0.09b 4.19±0.06b BUN/(mmol/L)17.63±2.73 34.29±4.35a 22.46±3.34b 23.53±4.29b 21.69±3.06b Scr/(μmol/L)15.35±6.32 57.15±9.82a 35.98±12.29b 35.10±6.26b 28.43±7.38b
3.4 GBE 对DN 模型小鼠肾脏病理损伤和纤维化改变的影响
对照组小鼠肾皮质未见明显病变,肾小球结构完整无缺损;模型组小鼠肾皮质细胞出现增生、肥大,并可见空泡,部分间质区可见炎症细胞浸润,其肾损伤评分和肾间质纤维化比例均较对照组显著升高(P<0.01)。与模型组比较,各药物组小鼠肾脏损伤和纤维化均有所减轻,其肾损伤评分和肾间质纤维化比例均较模型组显著降低(P<0.01)。结果见图2、图3。
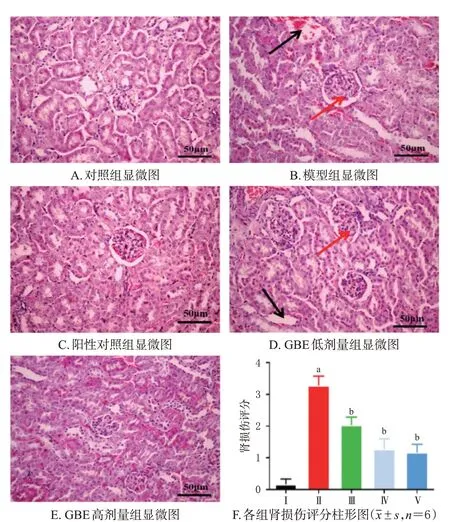
图2 各组小鼠肾脏病理损伤显微图及肾损伤评分柱形图(HE染色)
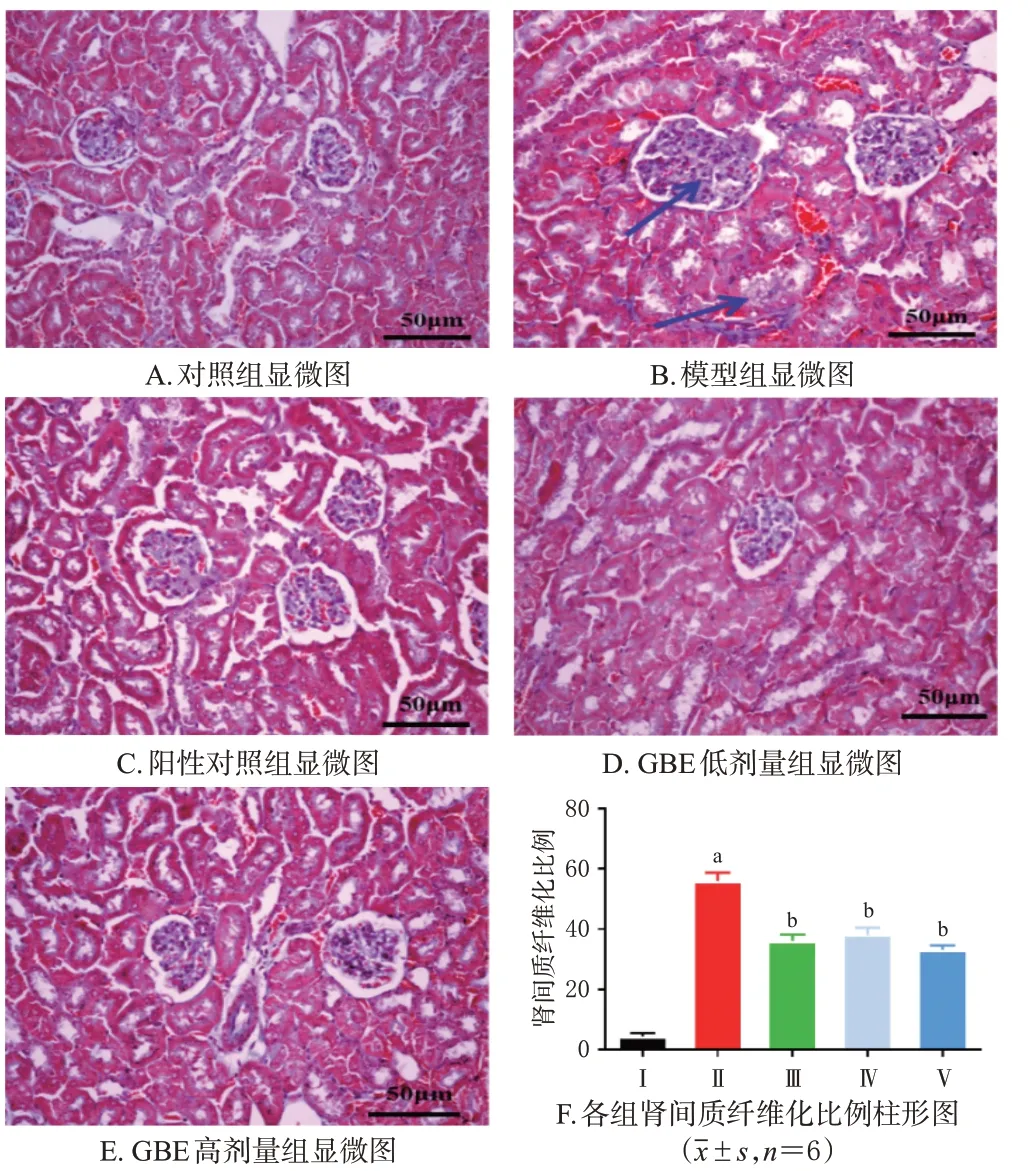
图3 各组小鼠肾间质纤维化改变显微图及纤维化比例柱形图(Masson染色)
3.5 GBE 对DN 模型小鼠肾皮质中巨噬细胞标志蛋白表达的影响
与对照组比较,模型组小鼠肾皮质中iNOS 蛋白的表达显著上调,而Arg-1 蛋白的表达显著下调(P<0.01);与模型组比较,各药物组小鼠肾皮质中iNOS蛋白的表达均显著下调,而Arg-1 蛋白的表达均显著上调(P<0.01)。结果见图4A、图5。

图4 各组小鼠肾皮质中巨噬细胞标志蛋白和AGEs-RAGE/RhoA/ROCK信号通路相关蛋白表达的电泳图
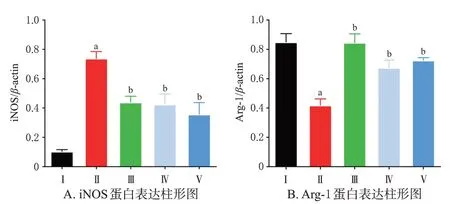
图5 GBE 对DN 模型小鼠肾皮质中iNOS、Arg-1 蛋白表达的影响(±s,n=6)
3.6 GBE 对DN 模型小鼠AGEs-RAGE/RhoA/ROCK信号通路相关蛋白表达的影响
与对照组比较,模型组小鼠血清中AGEs 水平和肾皮质中RAGE、RhoA、ROCK1蛋白的表达水平均显著升高(P<0.01);与模型组比较,各药物组小鼠血清中AGEs水平和肾皮质中RAGE、RhoA、ROCK1(GBE低剂量组除外)蛋白的表达水平均显著降低(P<0.01)。结果见图4B、图6。

图6 GBE 对DN 模型小鼠血清中AGEs 水平和肾皮质中RAGE、RhoA、ROCK1蛋白表达的影响(±s,n=6)
4 讨论
巨噬细胞主要通过极化来参与炎症反应,包括2 种作用相反的表型,分别为M1和M2型:M1型巨噬细胞主要在抗原呈递和免疫炎症方面发挥作用,而M2 型巨噬细胞则是通过分泌抗炎因子而发挥促进损伤修复和抗炎的作用[4]。有学者在DN动物模型中发现,2种表型巨噬细胞的失衡会加重炎症反应及纤维化改变[6]。基于此,本研究通过干预巨噬细胞极化来抑制炎症反应,从而延缓DN的发生发展。
AGEs 可作用于肾脏的RAGE,激活细胞内信号转导途径,介导肾脏系膜细胞激活以及巨噬细胞等炎症细胞向肾组织浸润。AGEs 和RAGE 相互作用,可通过释放MCP、细胞黏附分子、生长因子等多种细胞因子,进一步促进巨噬细胞极化和炎症因子分泌,在肾脏固有细胞、炎症细胞及各种细胞因子间形成复杂的相互作用网络,最终引发“瀑布效应”,加快DN 的进程[16]。RhoA/ROCK信号通路可调节细胞形态、运动、分泌、增殖和基因表达等生物学过程,在DN 的发生发展中具有重要作用。Rao 等[17]报道,该通路可介导巨噬细胞向肾组织迁移,而阻断肾小球内皮细胞的RhoA/ROCK 信号通路可显著抑制AGEs 诱导的内皮细胞MCP-1、细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)的分泌,进而减少db/db 自发性DM 小鼠肾小球中MCP-1、ICAM-1的表达和巨噬细胞的浸润。
基于现有研究和本课题组前期成果,本研究以KK/Ay 小鼠为对象,建立了DN 模型;以正常C57BL/6J 小鼠为对照,以二甲双胍为阳性对照药物,考察了低、高剂量GBE 对DN 模型小鼠的干预效果。结果显示,经低、高剂量GBE干预后,DN模型小鼠的空腹血糖和24 h摄食量、尿量均有不同程度改善,体重有所增加;同时,GBE能降低小鼠血清BUN、Scr 水平和双侧肾脏质量与体重的比值,还能降低小鼠血清AGEs水平和促炎因子IL-12水平,升高血清抗炎因子IL-10水平并降低MCP-1水平,提示GBE可改善DN模型小鼠的肾功能,并可有效减轻其炎症反应。HE、Masson 染色结果显示,DN 模型小鼠的肾小球结构不完整,并可见空泡增多、系膜基质增生、炎症细胞浸润等现象,存在明显的肾损伤和肾间质纤维化;而GBE 可明显改善DN 小鼠的上述病理改变,显著降低其肾损伤评分和肾间质纤维化比例。Western blot实验结果显示,GBE 可显著下调模型小鼠肾皮质中M1型巨噬细胞标志蛋白iNOS的表达,上调M2型巨噬细胞标志蛋白Arg-1 的表达,并显著降低通路相关蛋白RAGE、RhoA、ROCK1的表达水平。
综上所述,GBE 可改善DN 模型小鼠的肾损伤,并减轻其炎症反应,其机制可能与抑制AGEs-RAGE/RhoA/ROCK信号通路、调节巨噬细胞极化有关。
