五味子四种组分蛋白结构、理化性质和功能特性比较
2024-02-02王海东张红印曹珺李光哲严铭铭赵大庆
王海东,张红印,曹珺,李光哲,2,严铭铭,2*,赵大庆*
1(长春中医药大学,吉林省人参科学研究院,吉林 长春,130117) 2(吉林省中药保健食品科技创新中心,吉林 长春,130117)
北五味子作为中华传统中药,主要分布于东北三省,是木兰科植物五味子[Schisandrachinensis(Turcz.)Baill.]的成熟果实。北五味子始载于《神农本草经》,属上品,用药历史悠久,具有敛肺滋肾、生津收汗等功效[1]。五味子含有多种活性成分,主要为木脂素、三萜、多糖、蛋白质、脂肪油和有机酸等[2-3]。现代研究表明五味子及其活性成分具有多种药理作用[4-5],广泛应用于药品和保健食品中,具有重要的研究意义和开发利用价值。
蛋白质是生命活动的基础,提供了理想的营养和功能属性,在生物体的新陈代谢中起着重要调节作用[6],目前,一些新的植物来源的蛋白质具有很高的营养价值,这些植物蛋白不但极大地丰富了蛋白质资源的利用,同时其优良的理化性质和功能特性也引起了广大研究者的关注,越来越多的应运而生的功能性蛋白新产品层出不穷。因此,研究植物蛋白的结构、理化性质及其功能特性也成为挖掘蛋白类产品加工特性的重要手段[7]。
北五味子中含有约39%的蛋白质,高于花生[8]、葵花子[9]、腰果[10]等坚果种子类蛋白,研究发现北五味子蛋白含有7种人体必需氨基酸,是一种较为优质的蛋白质[11]。项目组前期研究表明,五味子组分蛋白中谷蛋白具有优良的抗氧化活性[12]。为提高北五味子资源的综合利用,增加北五味子蛋白类产品的附加值,本研究针对采用0 sborne四步法从北五味子脱脂粉中提取得到的清蛋白、球蛋白、醇溶蛋白和谷蛋白,采用电泳、UV、傅里叶变换红外光谱(Fourier transform infrared absorption,FTIR)及扫描电镜(scanning electron microscope,SEM)、差示量热扫描(differential scanning calorimetry,DSC)等方法结合经典化学检测手段对各组分蛋白的结构、理化性质和功能特性进行比较,为提高五味子组分蛋白在健康食品和保健食品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
北五味子药材由长春中医药大学附属医院提供,经姜大成教授鉴定为木兰科五味子属植物五味子Schisandrachinensis(Turcz.)Baill.的果实。
考马斯亮蓝R-250、甘氨酸(Gly)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺(N,N,N′,N′-tetramethylethylenediamine,TEMED)(分析纯),美国sigma公司;30%丙烯酰胺、β-巯基乙醇、蛋白Marker、过硫酸铵(AP)、三羟甲基胺基甲烷(Tris) (分析纯),北京索莱宝生物科技有限公司;Bradford蛋白浓度测定试剂盒,北京天根生化科技有限公司。
1.2 仪器与设备
ALB-224万分之一天平、AB265-S十万分之一天平、S220-K-CN标准型pH计、DSC-3差示扫描量热仪,梅特勒-托利多仪器有限公司;SCIENTZ-50F真空冷冻干燥机,宁波新芝冻干设备股份有限公司;Mini-PROTEAN Tetra Cell型Bio-rad蛋白电泳仪,美国Bio-rad公司;UV-2550紫外可见分光光度计、IRAffinity-1s傅里叶变换红外光谱仪,日本岛津仪器有限公司;LYNX6000 Sorvall LYNX型高速离心机、Multiskan MK3全自动酶标仪、Invitrogen iBright FL 1000凝胶成像仪,美国Thermo Fisher公司;MiniSpin Plus 5920R高速离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 五味子组分蛋白提取
组分蛋白提取参考0 sborne四步法[13-14],略加修改,具体工艺如图1所示。所得上清液A、B、C和D于蒸馏水中4 ℃透析48 h,间隔1 h换水1次,低温旋转蒸发浓缩后于真空冷冻干燥机中冻干即得清蛋白、球蛋白、醇溶蛋白和谷蛋白。

图1 五味子4种组分蛋白提取工艺流程Fig.1 Extraction process of four fractional proteins of Schisandra chinensis
1.3.2 组分蛋白提取率及营养成分测定
蛋白含量测定:参照GB 5009.5—2016《食品中蛋白质的测定》(凯氏定氮法),蛋白质换算系数F为6.25,考马斯亮蓝比色法;水分含量测定:参照GB 5009.3—2016《食品中水分的测定》(直接干燥法);灰分的测定:参照GB 5009.4—2016《食品中灰分的测定》(质量法);脂肪的测定:参照GB/T 5009.6—2016《食品中脂肪的测定》(索式抽提法)。按公式(1)计算各组分蛋白质提取率:
(1)
式中:m2为冻干后组分蛋白质量,g;m1为脱脂粉质量,g。
1.3.3 结构和理化性质
1.3.3.1 SDS-PAGE
SDS-PAGE参考BORCHANI等[14]和VINAYASHREE等[15]的方法稍加修改。制备质量浓度为5 mg/mL组分蛋白样品,8 000 r/min离心10 min,将上清液分别与还原型和非还原型蛋白上样缓冲液按1∶1体积比混匀,沸水浴5 min后冷却,分别使用浓度为5%和12%聚丙烯酰胺浓缩胶和分离胶进行SDS-PAGE电泳,每个泳道上样量为10 μL,浓缩胶和分离胶的电压和时间分别设置为70 V,30 min和140 V,50 min。考马斯亮蓝R-250室温摇床染色1 h,脱色液脱色数次至背景透明、条带清晰后使用凝胶成像仪扫描成像。根据标准蛋白的迁移率,计算出各组分蛋白的分子质量。
1.3.3.2 Tris-Tricine-SDS-PAGE
超低分子质量电泳根据Tris-Tricine-SDS-PAGE凝胶制备试剂盒配制分离胶、夹层胶和浓缩胶,电泳槽置于冰水浴中,外槽加入阳极缓冲液,内槽加入阴极缓冲液,30 V预电泳10 min,上样量10 μL,30 V电泳1 h,100 V电泳6~8 h至溴酚蓝到达分离胶底部,考马斯亮蓝R-250室温摇床染色1 h,脱色数次至条带清晰后使用凝胶成像仪扫描成像。
1.3.3.3 巯基和二硫键含量测定
参考文献[16-17]的方法,将20 mg组分蛋白溶于10 mL 8 mol/L 脲0.1 mol/L Tris-Gly缓冲液中,8 000 r/min离心20 min,上清液备用。游离巯基的测定:5 mL上清液添加50 μL 4 mg/mL Ellman试剂(DNTB溶于0.1 mol/L Tris-Gly缓冲液中),涡旋均匀,上清液在412 nm波长下测定吸光值。总巯基的测定:5 mL上清液添加50 μL β-巯基乙醇,25 ℃反应1 h,加入10 mL 12%(质量分数)三氯乙酸25 ℃继续反应1 h,8 000 r/min离心20 min,沉淀用10 mL 12%三氯乙酸清洗3次,收集沉淀,溶于10 mL 8 mol/L脲0.1 mol/L Tris-Gly缓冲液中,移取5 mL,加入50 μL Ellman试剂,于412 nm波长下测定吸光值。巯基和二硫键含量的计算分别如公式(2)、公式(3)所示:

(2)

(3)
式中:A412为样品吸光值;D为上清液稀释倍数;C为组分蛋白质量浓度,mg/mL。
1.3.3.4 紫外吸收光谱
10 mL蒸馏水溶解5 mg五味子组分蛋白样品,0.45 μm微孔滤膜过滤,蒸馏水作空白对照,紫外可见分光光度计200~800 nm内全波长扫描,观察280 nm处组分蛋白吸收峰强弱。
1.3.3.5 红外吸收光谱
玛瑙研钵中放置五味子组分蛋白固体样品2.0 mg、光谱醇KBr约200.0 mg,研磨成细腻粉末,取适量混匀后的样品置于压片模具中,置于压片机上,压制成薄片,扫描波数400~4 000 cm-1,分辨率4 cm-1,扫描20次。
1.3.3.6 DSC图谱分析
参考文献[18]方法,略作修改。精密称量5 mg五味子组分蛋白样品,置于铝坩埚中,压实,密封。以不装蛋白样品的空白铝坩埚作为空白对照,氮气流速50 mL/min,用差示扫描量热仪在20~140 ℃下以10 ℃/min的加热速率扫描密封的铝坩埚。
1.3.3.7 微观结构观察
使用导电双面胶将少量冻干后的五味子组分蛋白样品均匀平铺在金属样品台上,放入真空镀金器中真空镀金后,在20 kV电压、15 Pa低真空模式下,放入扫描电镜后调节不同放大倍数进行拍照观察各组分蛋白表面形态特征。
1.3.4 功能特性
1.3.4.1 溶解性(protein solubility,Ps)
分别制备1%清蛋白、球蛋白、醇溶蛋白、谷蛋白溶液,并用1.0 mol/L HCl或1.0 mol/L NaOH将pH调节至2.0~10.0,涡旋振荡20 min,5 000 r/min离心10 min,考马斯亮蓝比色法测定上清液中可溶性蛋白含量。
1.3.4.2 持水性(water holding capacity,WHC)
参考文献[19]的方法,准确称取五味子组分蛋白样品0.5 g,蛋白样品放入离心管中,加pH值为2~10去离子水溶液5.0 mL,涡旋混匀,静置30 min后离心(8 000 r/min,10 min),弃上清液,称重。根据公式(4)计算蛋白的持水性:

(4)
式中:m为组分蛋白样品质量,g;m1为空离心管质量,g;m2为离心后离心管和样品总质量,g。
1.3.4.3 持油性(oil absorbing capacity,OAC)
参考文献[20]的方法,准确称取0.5 g五味子组分蛋白样品置于离心管中,加入5.0 mL大豆油,涡旋混匀,分别于5、25、45、65、85 ℃静置30 min后离心(8 000 r/min,10 min),弃大豆油,称重。按公式(5)计算蛋白的持油性:

(5)
式中:m为组分蛋白样品质量,g;m1为空离心管质量,g;m2为离心后离心管和样品总质量,g。
1.3.4.4 乳化性(emulsifying activity,EAI)和乳化稳定性(emulsion stability,ESI)
参考LI等[21]方法,去离子水配制0.01 g/mL组分蛋白溶液,调节pH值为2~10,将大豆油和上述组分蛋白溶液按1∶3体积比混合均匀,均质机均质(10 000 r/min,2 min),吸取均质后的乳液80 μL,用0.001 g/mL SDS稀释100倍后于500 nm处测定吸光度。按公式(6)、公式(7)分别计算EAI和ESI:

(6)

(7)
式中:D为乳液稀释倍数,本实验中D=100;C为蛋白质量浓度,mg/mL;Ø为光程,Ø=0.01 m;V为油相体积分数,V=0.25;A0、A10分别为均质后0 min和10 min 时的吸光度。
1.3.4.5 起泡性(foaming characteristics,FC)和泡沫稳定性(froth stability,FS)
参考YOU等[22]方法,去离子水配制0.01 g/mL组分蛋白溶液,将pH值调节为2~10,移取15 mL蛋白溶液,均质机均质(10 000 r/min,2 min),测量溶液体积,静置10 min,再次测量溶液体积,起泡性和泡沫稳定性分别利用公式(8)、公式(9)进行计算:

(8)

(9)
式中:V0为搅拌均质前溶液体积;V1为搅拌匀质2 min时测得的体积;V2为搅拌均质后静置10 min测得的体积。
1.3.4.6 最小凝胶浓度(least gelation concentration,LGC)
参考文献[23]的方法,去离子水配制0.15 g/mL五味子组分蛋白分散液,涡旋混匀,100 ℃水浴60 min,冷却至室温,4 ℃保存2 h,倒置离心管,蛋白质样品没有从离心管中脱落或滑落时的浓度,即为五味子组分蛋白最小凝胶浓度。
1.4 数据处理
以上所有试验均重复3次,数据采用Excel 2019和Origin 2019b软件进行计算绘图,结果用平均值±标准差(x±s)来表示。
2 结果与分析
2.1 组分蛋白提取率及营养成分
五味子组分蛋白的提取率及基本成分分析结果见表1。结果发现,所含有的营养成分差异显著,其中谷蛋白的蛋白质含量最高而脂肪含量最低。五味子脱脂粉中蛋白含量丰富,清蛋白、球蛋白、醇溶蛋白和谷蛋白的提取率分别为7.47%、9.95%、6.35%、12.2%,五味子组分蛋白中主要蛋白为谷蛋白,且蛋白含量最高,这与黄志连等[25]研究结果略有不同,可能是原料差异所致。

表1 五味子组分蛋白提取率及基本成分 单位:%
2.2 结构和理化性质
2.2.1 SDS-PAGE
五味子脱脂粉中各组分蛋白在还原性和非还原性条件下测定的SDS-PAGE结果如图2-A和图2-B所示,用以观察五味子4种组分蛋白分子内和分子间的交联。结果表明,与总蛋白相比,五味子各组分蛋白的组成差异较大。在还原性电泳图2-A图谱中,清蛋白和球蛋白具有相似分子质量的条带分布,电泳图谱中均包含3条主要的清晰可见条带,相对分子质量大致为19、36 kDa和43~47 kDa,但清蛋白和球蛋白3条主要条带含量不同,可能由于提取方法不同导致。醇溶蛋白在此分子质量范围内未检测出条带,谷蛋白2条主要的清晰可见条带相对分子质量集中在18 kDa和36 kDa。
非还原性电泳图2-B图谱中,与还原性电泳图谱相比,清蛋白和球蛋白条带明显降低,且清蛋白条带分布和含量差异显著,特别是56 kDa处条带基本均被β-巯基乙醇还原,二硫键断裂,迁移率增大,使清蛋白在还原性电泳图谱中分子质量为17 kDa的条带明显增多,表明清蛋白及其聚集体和小分子亚基等的相互交联可能以—S—S—为主[24,26]。清蛋白和球蛋白相对分子质量为10~25 kDa的条带强度变浅,推测其含有二硫键。组分蛋白分子质量小于<25 kDa的亚基一方面可能来自于由五味子脱脂粉提取组分蛋白时产生,或在提取和加入β-巯基乙醇过程中由各种组分蛋白质破坏、分解产生的其他亚结构。谷蛋白条带没有明显差异,说明二硫键含量较低,可能由于谷蛋白是由强碱性溶剂提取导致其亚基组成比较稳定,不易被β-巯基乙醇还原。
2.2.2 Tris-Tricine-SDS-PAGE
为了更加直观地观察五味子4种组分蛋白分子内和分子间在超低分子质量范围内的交联情况,如图3-A和图3-B分别为五味子4种组分蛋白在还原性和非还原性条件下测定的Tris-Tricine-SDS-PAGE电泳图谱。与非还原条件电泳图相比,清蛋白和球蛋白在4~17 kDa条带数目和强度明显增多,和SDS-PAGE结果相似,说明在此分子质量范围内二硫键数目较多,加入β-巯基乙醇后,二硫键发生断裂,使处于高分子质量范围内的亚基迁移率增大,导致在4~17 kDa条带数目和强度明显增多。醇溶蛋白在5 kDa处出现一条浅色亚基条带,可能采用醇溶液提取导致相对分子质量和含量较低。谷蛋白在低分子质量范围内变化依旧不明显,在5~8 kDa范围内出现新条带,可能由于少量的二硫键发生断裂形成的。

M-标准蛋白Marker(10~180 kDa);1~5-五味子总蛋白、清蛋白、球蛋白、醇溶蛋白和谷蛋白 A-还原型 SDS-PAGE;B-非还原型SDS-PAGE图2 五味子4种组分蛋白SDS-PAGE图Fig.2 SDS-PAGE in four protein fractions of Schisandra chinensis

M-标准蛋白Marker(3.3~31.0 kDa);1~5-五味子总蛋白、清蛋白、球蛋白、醇溶蛋白和谷蛋白 A-还原型 Tris-Tricine-SDS-PAGE;B-非还原型Tris-Tricine-SDS-PAGE图3 五味子4种组分蛋白Tris-Tricine-SDS-PAGE图Fig.3 Tris-Tricine-SDS-PAGE in four protein fractions of Schisandra chinensis
2.2.3 巯基和二硫键含量测定
巯基和二硫键是维持蛋白质空间结构和赋予其一定功能特性的重要化学键,测定两者含量,可以评价蛋白质的三级结构。如图4所示,清蛋白和球蛋白二硫键含量较高,这也是导致这2种还原性电泳和非还原性电泳条带变化较大的重要原因。此外,二硫键含量高会使蛋白质空间构象发生折叠,降低熵值,是提升热稳定性的因素之一。与清蛋白和球蛋白相比,谷蛋白巯基暴露在蛋白质表面的最少,为4.72 μmol/g。醇溶蛋白因蛋白含量低而呈现出巯基和二硫键含量较少。有研究表明[27],随着共价二硫键的形成,游离巯基含量较高的蛋白质更有可能相互结合或聚集,这也可能是导致扫描电镜中谷蛋白结构疏松的原因,还可以表明谷蛋白中游离巯基和二硫键含量较低是其溶解性和持水性优于清蛋白和球蛋白的原因之一。

图4 五味子4种组分蛋白巯基和二硫键含量Fig.4 Contents of sulfhydryl group and disulfide bond of four protein fractions of Schisandra chinensis
2.2.4 紫外吸收光谱
蛋白质紫外吸收光谱中的变化与其微环境的改变密切相关,所以常用紫外吸收光谱260~300 nm内变化来表征蛋白质的构象变化。引起组分蛋白紫外吸收强度不同的原因可能是提取溶剂不同,导致蛋白的含量和螺旋结构在提取过程中发生变化。由图5五味子4种组分蛋白的紫外吸收光谱可得,谷蛋白在280 nm附近的紫外吸收强度最大,属于蛋白质表面酪氨酸(Try)、苯丙氨酸(Phe)、色氨酸(Trp)等芳香族氨基酸的吸收特征(200~400 nm)[28],球蛋白吸收强度最弱,可能由于碱性环境下色氨酸、酪氨酸等发色基团从内部疏水区域转移至极性的溶剂环境中,进而增大谷蛋白的紫外吸收强度。
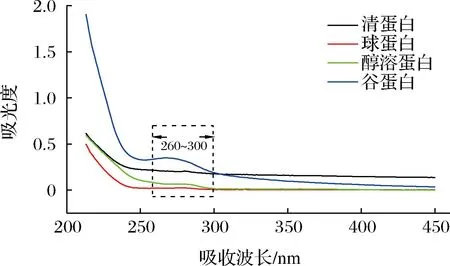
图5 五味子4种组分蛋白紫外吸收光谱Fig.5 Ultraviolet absorption spectra of four protein fractions of Schisandra chinensis
2.2.5 红外吸收光谱



A-五味子各组分蛋白的FTIR图;B-五味子各组分 蛋白酰胺带区域FTIR的细节放大图图6 五味子4种组分蛋白红外吸收光谱Fig.6 Infrared absorption spectra of four protein fractions of Schisandra chinensis
五味子4种组分蛋白的二级结构定量分析结果如图7所示,数据显示,各组分蛋白的二级结构中均以β-折叠为主,这与李杨等[33]研究不同热处理条件下大豆分离蛋白的二级结构结果相似。与其他3种组分蛋白相比,谷蛋白的二级结构含量变化显著,β-折叠在二级结构中占51.92%,可能是提取过程中部分α-螺旋、β-转角和无规则卷曲转变为β-折叠而导致其含量明显高于其他3种组分蛋白,这也是造成其溶解性和热稳定性较高的原因之一。
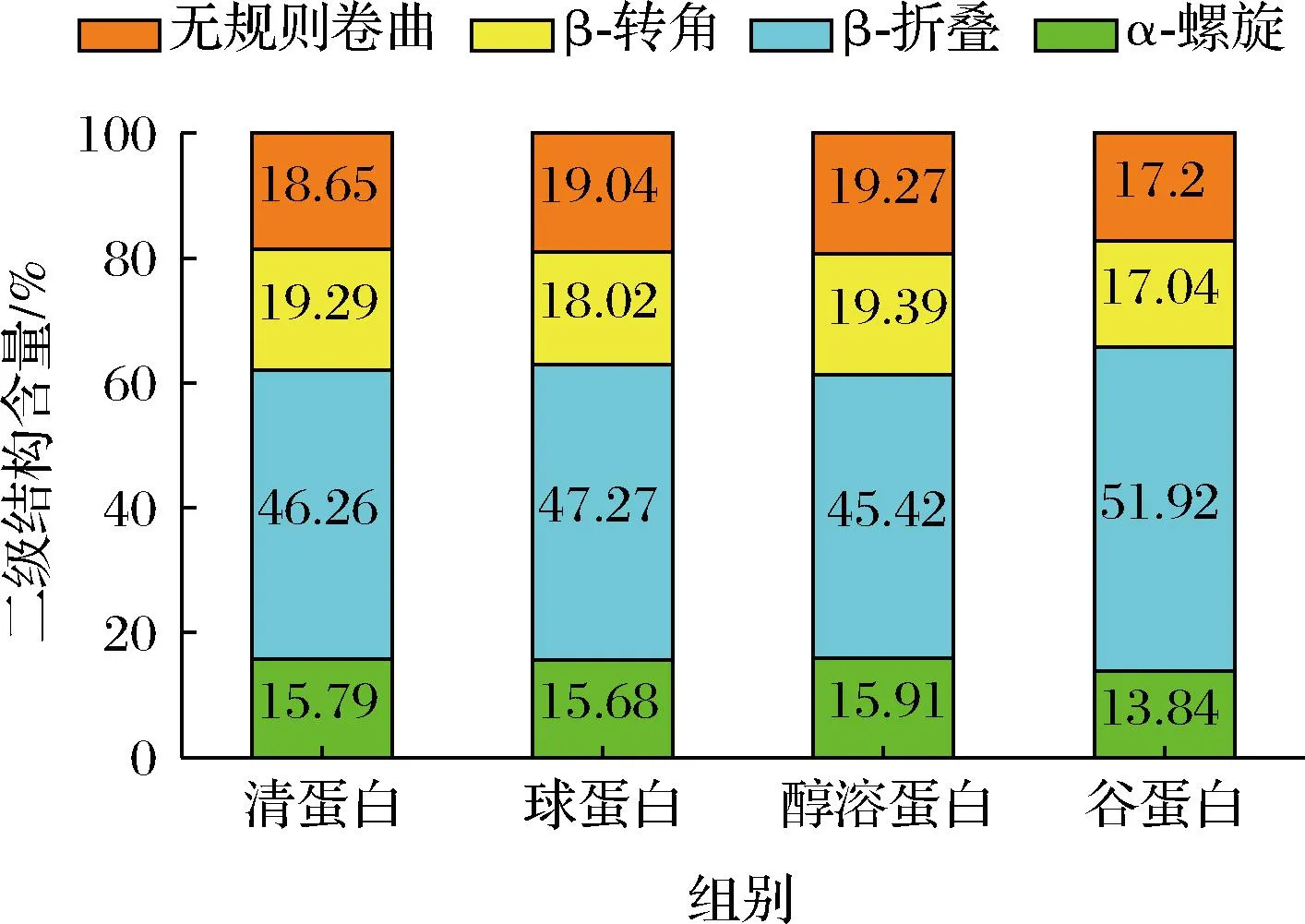
图7 五味子4种组分蛋白二级结构含量Fig.7 Protein secondary structure content of four protein fractions of Schisandra chinensis
2.2.6 热稳定性测定
五味子4种组分蛋白的DSC图谱如图8所示,清蛋白、球蛋白和谷蛋白都有一个平滑的吸热峰,无杂质峰,而醇溶蛋白吸收峰不明显,可能由于蛋白含量低导致。谷蛋白比其他组分蛋白热变性温度高,为91 ℃,说明谷蛋白相对更稳定,对热不够敏感,虽然其二硫键含量低于清蛋白和球蛋白,但是在红外吸收光谱中,β-折叠结构明显强于清蛋白和球蛋白,有研究表明[29,34],二级结构中β-折叠含量高可以增加蛋白质热稳定性。因此,谷蛋白热稳定性优于其他组分蛋白可能是其主要受到β-折叠结构的影响,而二硫键含量对其影响较小。
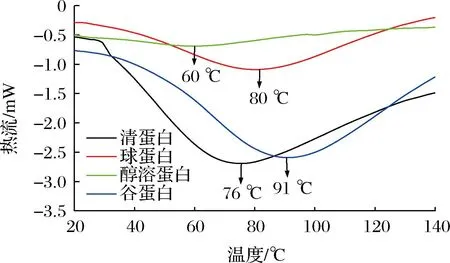
图8 五味子4种组分蛋白DSC谱图Fig.8 DSC spectra of four protein fractions of Schisandra chinensis
2.2.7 组分蛋白微观结构观察
五味子4种组分蛋白中的清蛋白、球蛋白、醇溶蛋白和谷蛋白的颗粒表面形态存在较大差异。由图9可知,清蛋白呈无规则树枝状,局部有棱状突起和孔,突起表面以外较为光滑,孔径较大,可能会影响其吸附性,进而可能影响其持水性和持油性;球蛋白表面凸起,由结构紧密的多层不规则片状构成,结构相对致密但存在较多孔隙,蛋白质的表面形态结构产生的物理截留作用对于其持油性影响较大;醇溶蛋白分子连接紧密,表面不够平整,呈球状或聚集体形式连接成较大的分子基团,基团之间孔径较大,这与张明珠等[35]报道的玉米醇溶蛋白表面结构结果相似,可能是由于醇提导致其分子粒径较小,相互聚集成大分子基团,进而导致各基团间孔径较大;谷蛋白和球蛋白相比表现出疏松的多层片状和树枝状结构,可能是碱提取导致其电荷之间相互排斥,部分结构发生折叠,进而引起结构的改变。综上可得,五味子4种组分蛋白的表面形态均不同,故其表现的性质也不同,如溶解性差异,由于蛋白的溶解性与其他多种蛋白功能特性,如持水性、乳化性、起泡性和凝胶性等存在密切关联,因此,五味子4种组分蛋白微观结构的不同是影响其理化性质和功能特性的重要因素。

A-清蛋白;B-球蛋白;C-醇溶蛋白;D-谷蛋白图9 五味子4种组分蛋白微观结构图Fig.9 Microstructures of four protein fractions of Schisandra chinensis
2.3 功能特性结果
2.3.1 溶解性
溶解度是测定蛋白聚集程度和变性水平最实用的方法,是衡量蛋白质乳化性和起泡性的重要指标[26]。由图10可知,pH=4时,靠近清蛋白、球蛋白和谷蛋白等电点,分子间电荷排斥力最小,蛋白溶解性最低,当蛋白处于偏离等电点的酸性或碱性环境时,其溶解度都呈增加趋势,并且在碱性环境下的溶解度高于酸性环境下的溶解度。球蛋白溶解度随pH值变化明显,当pH值为6~10,分子间电荷排斥能力增强,溶解度持续升高。由于醇溶蛋白扫描电镜中呈现出分子连接紧密,以聚集体形式连接成较大的分子基团,降低了蛋白质与水之间的作用,因此溶解度最低且随pH值变化不明显。谷蛋白溶解性最高,在pH=8时溶解度达到最大值,为26.5%,谷蛋白在此条件下获得更多净负电荷和正电荷,有利于分子间的排斥,分散能力增强,从而增加蛋白质的溶解度。

图10 五味子4种组分蛋白溶解性Fig.10 Solubility of four protein fractions of Schisandra chinensis
2.3.2 持水性
持水性是蛋白质在食品工业应用中重要特性。蛋白质空间结构、提取方法和环境参数(pH、离子强度、温度)被认为是影响蛋白质持水性的因素。如图11所示,在pH值为2~10时,4种组分蛋白中谷蛋白的持水性最高,与在扫描电镜下谷蛋白微观结构中疏松的多层片状和树枝状结构和相对较低的堆积密度有关,当pH=8时持水性最大为3.72 g/g,说明在此条件下,谷蛋白中氢键作用和亲水基团暴露最多;球蛋白在pH=6时持水性最低,这是由于球蛋白为盐溶液提取,在此条件下整个蛋白质分子呈现电中性,使蛋白质分子间相互作用达到最高,而缔合和收缩的蛋白质呈现最低水化和膨胀,表现出最弱的吸水能力;醇溶蛋白的吸水性最低,与空间结构和提取方法有关。相关研究表明[36],黏性蛋白持水性为1.49~4.72 g/g,因此谷蛋白可能适合作为黏性蛋白类食品应用于食品加工中。

图11 五味子4种组分蛋白持水性Fig.11 Water holding capacity of four protein fractions of Schisandra chinensis
2.3.3 持油性
蛋白质的持油性不仅影响着蛋白质产品的感官品质,还会影响其在食品加工和贮藏过程中的物理特性对蛋白具有实际应用价值。五味子4种组分蛋白在不同温度下的持油性结果如图12所示,谷蛋白在室温(25 ℃)持持油性最好,为14.9 g/g,明显高于南瓜籽分离蛋白[15],其次是清蛋白和球蛋白,醇溶蛋白持油性最差,且受温度的影响较小。在低温(5 ℃)下,清蛋白和谷蛋白持油性随着温度的升高呈现先增强后减弱的趋势,在较高温度下开始变性,空间结构也随之改变,亲水基团增多、疏水基团减少,进而导致持油性降低,这与崔岩岩等[37]报道结果相似。高持油性的蛋白质可用于食品工业中的肉类配方、肉类替代品和填充剂,因此谷蛋白在食品加工中具有巨大开发价值。
2.3.4 乳化性和乳化稳定性
乳化性指蛋白质在油-水界面上吸附形成乳状液的能力,而乳化稳定性是衡量乳液在一定时间内保持其结构和状态的能力。五味子不同组分蛋白乳化性和乳化稳定性与pH值关系如图13-A、图13-B所示,随着pH值偏离等电点附近,乳化性和乳化稳定增加,pH=10时,4种组分蛋白乳化性达到最大,分别为101.2、99.5、88.6、113.6 m2/g,谷蛋白在整体上乳化性最高,醇溶蛋白乳化性最低,这与邓欣伦等[38]报道的核桃组分蛋白结果不同,可能与原料差异和蛋白含量有关。谷蛋白和球蛋白乳化稳定性呈现先降低后升高趋势,而清蛋白和醇溶蛋白相反,谷蛋白结构疏松,溶解性和持水性强于其他组分蛋白,当pH值偏离等电点时,蛋白质溶解性增大,分散性好,蛋白质与极性水分子的作用加强,在油—水界面的表面张力增大,油—水界面在一定时间内得到稳定,使乳化性和乳化稳定性持续升高。谷蛋白作为一种乳化性和乳化稳定好的蛋白质可以在改善食品加工特性中存在潜在应用价值。

图12 五味子4种组分蛋白持油性Fig.12 Oil holding capacity of four protein fractions of Schisandra chinensis
2.3.5 起泡性和泡沫稳定性
蛋白质的起泡性质与蛋白类型、pH值、浓度和水合能力等相关,蛋白质起泡特性可赋予食品良好的口感和松软的结构[16]。由图14可知,其他因素固定的前提下,谷蛋白起泡性最好,且在碱性环境中最优,和南瓜籽分离蛋白[15]随pH值变化趋势相似。谷蛋白在pH=4时,起泡性最低为40.1%,等电点附近,蛋白质净电荷较少,降低了分子间作用力和表面张力,蛋白质易发生聚集,在水-空气界面界面相互作用形成一个弹性网状结构,降低起泡能力;在pH=10时起泡性最强为80.3%,随着pH值升高,谷蛋白溶解性增大,增加水-空气界面相互作用,起泡性升高。谷蛋白泡沫稳定性在pH=6或8时为佳,过酸性或过碱性溶剂可能引起谷蛋白的变性导致蛋白质发生沉淀,因此不利于泡沫稳定。蛋白质展现出不同的起泡性和泡沫稳定性,在蛋糕、面包等不同食品的发泡成分产生不同的应用价值。
2.3.6 最小凝胶浓度
蛋白质形成凝胶,可以作为结构基质来保存水、糖、香料和食品添加剂,在食品工业中非常重要。最小凝胶浓度低表明蛋白质具有良好的胶凝能力,因为形成同样的凝胶水平所需蛋白量较少。如图15所示,谷蛋白最小凝胶浓度最低,为4.3%,与其他3种组分蛋白相比具有优良的凝胶形成能力。蛋白质的凝胶水平可能与分子间二硫键和氢键水平有关。谷蛋白在较低的蛋白质浓度下可能成为食品成分中一种经济、牢固的结构基质。

图15 五味子4种组分最小凝胶浓度Fig.15 Minimum gel concentration of four protein fractions of Schisandra chinensis
3 结论
本研究通过对五味子4种组分蛋白结构、理化性质和功能特性进行比较,研究发现空间结构的变化会对理化性质和功能特性产生影响,还原性电泳和非还原性电泳证实二硫键的存在,使组分蛋白在还原前和还原后亚基条带分布不同;扫描电镜呈现出不同组分蛋白的松散程度和形状;Tris-Tricine-SDS-PAGE呈现了组分蛋白在超低分子质量范围内条带分布,并且醇溶蛋白在5 kDa处出现一条微弱亚基条带;FTIR谱图表征不同组分蛋白二级结构的差异。谷蛋白提取率最高,蛋白质含量最高而脂肪含量最低,具有优良的热稳定性、溶解性、持水性、持油性、乳化性及乳化稳定性和发泡性及泡沫稳定性,在食品工业和食品加工中作为持水剂、持油剂、乳化剂和发泡剂使用,可成为新的具有潜在价值的植物蛋白资源。综上所述,五味子组分蛋白结构、理化和功能特性的系统分析研究可为提高五味子的综合利用率,增加五味子蛋白产品附加值提供新思路,同时指出五味子谷蛋白,在功能性健康食品和保健食品领域具有较大的开发利用价值。
