恶臭假单胞菌F1表达P450酶催化柠檬烯生物合成紫苏醇
2024-02-02底心怡刘春立刘秀霞杨艳坤白仲虎
底心怡,刘春立*,刘秀霞,杨艳坤,白仲虎*
1(江南大学,粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122) 2(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214122)
紫苏醇,也被称为二氢枯草醇,是一种天然存在的单环萜类化合物,来自植物的甲羟戊酸途径。紫苏醇性能稳定,耐热、耐酸,可溶于甲醇、乙醇、乙腈等有机溶剂,具有类似于芳樟醇、松油醇的特殊气味,在医药、日化、食品等行业具有广阔的应用前景[1]。例如,在动物实验中,紫苏醇能抑制法尼基转移酶和香叶酰转移酶,从而抑制翻译后肿瘤蛋白的法尼基化、异戊二烯化,从而抑制肿瘤细胞激活,使其细胞周期停止在G2/M期[2]。作为一种植物代谢物,紫苏醇也存在于多种植物精油成分中,如薰衣草、薄荷和柠檬草等。目前获取紫苏醇的主要方法分为化学合成和生物合成。对于化学合成,可使用有机溶剂或超临界二氧化碳萃取等方法从天然植物精油中获得紫苏醇,但产品含量低,且分离不易,成本较高[1,3]。以天然存在的单萜类化合物为原料,通过异构化、皂化等过程也可生成,但选择性不高,且所使用的氧化剂对于环境污染较大[4-5]。对于生物合成,常使用柠檬烯作为底物,通过生物酶系统如嗜热脂肪芽孢杆菌(Bacillusstearothermophilus) BR388中的微生物酶系统进行转化[6]。然而,氧化酶体系大多较为复杂,不具有足够的区域特异性,会产生大量沸点和疏水性相似的副产物,如香芹酮、松油醇等,后续需要昂贵的纯化过程才能获得较高纯度的紫苏醇[7]。因此,紫苏醇生物合成的宿主菌株及生物酶尚有开发和改造空间。
细胞色素P450 (CYP450),又称P450酶,是一类单加氧酶超家族,以血红素作为辅因子,能够对底物进行区域选择性氧化,且往往是立体选择性氧化[8]。P450酶广泛存在于动物、植物、真菌、原生动物、细菌和古菌中。在哺乳动物中,P450酶附着于内质网,用于氧化类固醇、脂肪酸等物质,并在激素合成和分解过程中发挥着重要作用。在植物中,P450酶用于合成激素、脂肪酸等对植物本身具有保护作用的化合物。在微生物中,P450酶参与各种生化反应,包括初级、次级代谢物合成及反硝化作用[9]。目前已有较为成熟的应用P450酶的研究成果。SCHNEIDER等[10]利用来自石油假单孢菌(Pseudomonasoleovorans)的辅酶A非依赖型脂肪酸吸收系统,以表达P450 BM3的重组大肠杆菌(Escherichiacoli)为宿主催化制备12-,13-,14-羟基化十五酸,能够有效替代传统生物转化长链脂肪酸为亚末端羟基化脂肪酸的方法。BEZALEL等[11]利用P450酶的单加氧特性,使用糙皮侧耳菌(Pleurotusostreatus)降解菲类化合物。GIANG等[12]通过序列同源性比对发现球状红球菌(Rhodococcusgloberulus)来源的P450酶(CYP108 N12)具有能够氧化柠檬烯、伞花烃等物质的功能。分岐杆菌(Mycobacteriumsp.)HXN-1500来源的P450酶,即CYP153A6,可氧化C6-C11正烷烃,也可以结构较为复杂的烃类作底物,能得到高度区域选择性烃化的产物[8,13]。当底物为柠檬烯时,CYP153A6可将其特异性氧化为紫苏醇,目前已在多种宿主中得到应用(图1)。GUDIMINCHI等[14]使用pCom8-PFR1500载体在大肠杆菌中表达CYP153A6、铁氧还蛋白和铁氧还蛋白还原酶,在自诱导培养基生长的大肠杆菌所得紫苏醇产量最高达到1.85 mol/L。VAN等[15]在恶臭假单胞菌GPo12中表达CYP153A6生物转化柠檬烯生成紫苏醇,但恶臭假单胞菌GPo12的柠檬烯耐受度较低,紫苏醇产量也因此受到限制。

图1 P450酶生物转化柠檬烯生成紫苏醇示意图Fig.1 Biosynthesis of perillyl alcohol catalyzed by cytochrome P450
恶臭假单胞菌(Pseudomonasputida)是一种腐生营养土壤杆菌,其营养背景丰富,广泛存在于土壤、水体、动植物体表和各种富含蛋白质的物质中[16]。恶臭假单胞菌酶背景复杂,代谢途径繁多,能利用多种碳源,且对pH、溶剂等极端环境条件表现出高度稳健性和耐受性,因此多用于环境污染治理及有机废物再循环利用,并因在土壤中的定植能力和降解各种化学物质的能力而闻名[17-19]。作为革兰氏阴性菌,恶臭假单胞菌同样具有培养成本低、生长周期短、安全无害等特点。其中,恶臭假单胞菌F1与模式菌株的KT2440不同,并不常作为外源基因表达或目的产物合成的宿主菌株[20-21]。恶臭假单胞菌F1含有丰富的氧化酶系,如tod、cym、cmt酶系等,使其具有对环境中芳香族、萜类物质较高耐受性,且cym酶系中的CymAa、CymAb具有选择性羟化活性,作为生产此类物质的宿主菌株具有较大潜力[22]。
本研究将构建穿梭质粒表达载体,并以大肠杆菌BL21 (DE3)、恶臭假单胞菌F1作为宿主菌株,表达选择性羟化酶CymAa、CymAb和P450酶、铁氧还蛋白、铁氧还蛋白还原酶,以柠檬烯为底物生物合成紫苏醇,展现恶臭假单胞菌F1作为萜类物质合成载体菌株的优势。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
2×TaqPCR Mastermix、2×PrimeStar,Takara公司;2×Multif Seamless Assembly Mix,Abclonal公司;引物,苏州金唯智生物科技有限公司。
1.1.2 菌株与质粒
本研究中使用的菌株与质粒如表1所示,所使用引物如表2所示。

表1 本研究中使用的菌株与质粒Table 1 Strains and plasmids used in this study

表2 本研究中使用的引物Table 2 Primers used in this study
1.1.3 培养基
LB培养基(g/L):酵母提取物5,蛋白胨5,NaCl 10,主要用于质粒构建菌株及发酵种子液培养。LB固体培养基为上述液体培养基中添加1%(质量分数)的琼脂粉。
M9培养基(1 L):0.1 mL 1%维生素B12,0.01 mL 10% 维生素B1,0.1 mL trace矿物盐溶液(108 g/L FeCl3·6H2O, 2 g/L H3BO3, 4 g/L ZnCl2·7H2O, 5 g/L MnSO4·H2O, 7 g/L CoCl2·6H2O, 7 g/L Na2MoO4·H2O, 8 g/L CuSO4·6H2O),0.1 mL 1 mol/L CaCl2, 2 mL 1 mol/L MgSO4, 50 mL 20%D-葡萄糖,50 mL 10% 酪蛋白水解物, 100 mL 10×M9盐溶液 (60 g/L Na2HPO4·7H2O, 30 g/L KH2PO4, 5 g/L NaCl),主要用于产物发酵菌株培养。
抗生素:卡那霉素终质量浓度为50 mg/L。
1.1.4 仪器与设备
ETC821 PCR基因扩增仪,东胜公司;411BR8608 MicroPulser电转仪,BIO-RAD;759S21023 UV-Vis Spectrophotometer紫外可见分光光度计,上海棱光公司;GCMS-QP2020 SYSTEM气相色谱质谱联用仪,岛津公司。
1.1.5 标准品
柠檬烯标准品:(-)-柠檬烯,(-)-Limonene,别名(S)-(-)-二戊烯,CAS编号5989-54-8,分子式C10H16,分子量136.24,规格及纯度为>95.0%(GC),沸点为64 ℃/15 mmHg(lit.),密度0.845,购于Aladdin公司。
紫苏醇标准品:紫苏醇,Perillyl alcohol,CAS编号536-59-4,分子式C10H16O,分子量152.23,规格及纯度为90%,室温贮存,购于Aladdin公司。
乙酸乙酯:Ethyl acetate,CAS编号141-78-6,分子式C4H8O2,分子量88.11,规格及纯度为≥99.5%,沸点为77 ℃,相对密度0.902,购于国药沪试公司。
1.2 实验方法
1.2.1 基因克隆和质粒构建
使用引物pBBR1-vector-F/pBBR1-vector-R,以广宿主载体pBBR1MCS2为模板,扩增含有卡那霉素抗性基因、pBBR1复制子的DNA片段;使用引物promoter-F/promoter-R,以质粒载体pTrc99a为模板,扩增含有lacI基因、trc启动子、lacO序列以及rrnB T1终止子的DNA片段。使用Gibson组装法连接上述两片段,构成质粒pBBR1-Ptrc。
从恶臭假单胞菌数据库(https://www.pseudomonas.com/)获得cymAa(Pput_2903)、cymAb(Pput_2902)基因的核苷酸序列信息。从NCBI(https://www.ncbi.nlm.nih.gov/)获得P450酶、铁氧还蛋白、铁氧还蛋白还原酶基因(GenBank:AJ783967.1)的核苷酸序列信息,并对其编码序列进行密码子优化(参考大肠杆菌BL21),由苏州金唯智生物科技有限公司合成质粒pET-Cyp450-Fdr-Fdx。使用引物pBBR1cymAabv-F/pBBR1cymAabv-R和pBBR1P450v-F/pBBR1P450v-R,以pBBR1-Ptrc为模板扩增线性化载体片段;使用引物cymAab-F/cymAab-R,以恶臭假单胞菌F1基因组为模板扩增含有cymAa和cymAb基因的DNA片段;使用引物P450-F/P450-R,以实验室保存质粒pET-Cyp450-Fdr-Fdx为模板扩增含有P450酶、铁氧还蛋白、铁氧还蛋白还原酶基因的DNA片段。分别使用Gibson组装法连接载体和片段,构成质粒pBBR1-cymAab和pBBR1-P450-Fdr-Fdx。
1.2.2 恶臭假单胞菌F1电转化感受态制备
将保存于-80 ℃的恶臭假单胞菌F1接种于装有5 mL LB培养基的50 mL离心管,于30 ℃过夜培养,转接至100 mL LB培养基培养至OD600=0.8。将培养液分装至2个50 mL离心管于5 000×g,4 ℃离心10 min。将获取的细胞分别用30 mL预冷的无菌水、3 mmol/L 4-羟乙基哌嗪乙磺酸溶液{2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES}重悬并再次离心,最后加入2 mL预冷的10%甘油重悬并每80 μL分装于500 μL离心管备用。
1.2.3 菌株培养
将质粒转化至大肠杆菌BL21 (DE3)与恶臭假单胞菌F1中。PCR验证为阳性后于平板上随机挑取3个菌落,接种至装有5 mL LB培养基的50 mL离心管中,于220 r/min恒温培养箱培养,其中大肠杆菌BL21 (DE3)生长温度为37 ℃,恶臭假单胞菌F1生长温度为30 ℃。16 h后转接至装有5 mL M9培养基的20 mL摇瓶中,当OD600值至0.6~0.8时添加相应浓度的柠檬烯作为底物、以及1 mmol/L 异丙基β-D-1-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导表达,于30 ℃培养24 h和48 h 取样进行检测。
1.2.4 紫苏醇检测
取1 mL发酵液、0.5 mL乙酸乙酯与过量无水Na2SO4加入2 mL离心管,涡旋振荡5 min后于13 000 r/min离心10 min,用针管取最上层有机相过滤膜后注入气相小瓶待检。GC-MS仪器设置:电子碰撞(electron impact, EI)检测器和DB-5MS色谱柱(30 m×0.32 mm×0.25 μm)。方法条件:入口温度为260 ℃,氮气载气恒定流量为44 cm/s,离子源温度为250 ℃,扫描30~500m/z。执行以下程序:初始温度为80 ℃保持1 min,然后以10 ℃/min的速率升至260 ℃,最后保持10 min。分流比5.0。通过与已知浓度的紫苏醇标品绘制的标准曲线比较,将峰面积转换为紫苏醇浓度进行定量。
2 结果与分析
2.1 广宿主载体pBBR1-Ptrc质粒构建
恶臭假单胞菌F1具有酶背景丰富、环境耐受度高、培养成本低、生长周期短等优点,但并不常作为外源基因表达的宿主菌株,因而缺少可用的基因表达载体。为使承载目的基因的表达载体可以正常在大肠杆菌BL21 (DE3)和恶臭假单胞菌F1中扩增表达,本研究利用广宿主载体pBBR1MCS2作为模板扩增其复制子pBBR1,通过Gibson组装连接来自质粒pTrc99a的trc启动子和lacI基因,构建pBBR1-Ptrc质粒。质粒元件构成如图2所示。该质粒载体能够在大肠杆菌、恶臭假单胞菌等多种革兰氏阴性菌中正常扩增表达,具有可以连接外源基因片段的多克隆位点,并可以通过控制IPTG的添加调控其连接的目的基因的表达。
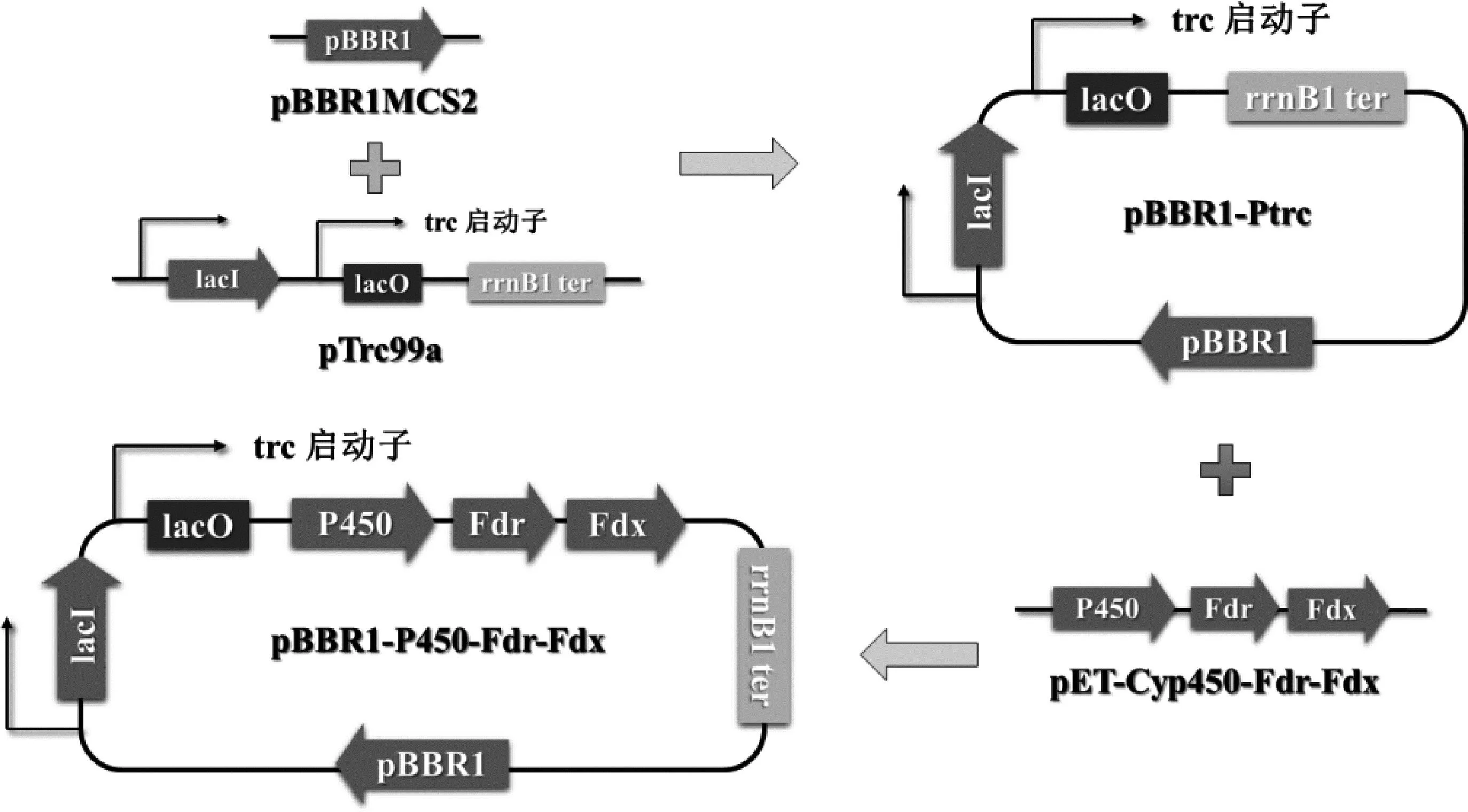
图2 质粒构建示意图Fig.2 Construction of plasmids.
2.2 CymAab和P450酶表达载体构建及验证
获得可用的表达载体后,需要表达目的蛋白CymAab和P450酶。CymAab为恶臭假单胞菌F1来源,分为CymAa和CymAb两部分,以纯化的恶臭假单胞菌F1基因组作为模板,通过引物扩增与Gibson组装构建成质粒pBBR1-cymAab。本研究中所使用的P450酶为Mycobacteriumsp.HXN-1500 来源,分为主体P450酶、辅因子铁氧还蛋白、铁氧还蛋白还原酶3个部分,其序列经过大肠杆菌密码子偏好优化后通过公司合成为质粒pET-Cyp450-Fdr-Fdx,并通过引物扩增与Gibson组装构建成质粒pBBR1-Cyp450-Fdr-Fdx。质粒元件构成与P450酶生物合成紫苏醇示意图如图2所示。
将含有目的基因的质粒转化进大肠杆菌BL21 (DE3)与恶臭假单胞菌F1中,并以含有空质粒pBBR1-Ptrc的菌株EcC和PpC作为空白对照,添加10 mmol/L柠檬烯作为底物,检测诱导后24 h和48 h后发酵液中的细胞密度和紫苏醇浓度。由OD600值测定结果可以看出,添加了10 mmol/L柠檬烯后,大肠杆菌BL21 (DE3)的生长状态受到很大程度抑制,而恶臭假单胞菌F1几乎没有受到影响(图3-a)。对于紫苏醇的产量检测,表达CymAab酶的实验组EccymAab、PpcymAab均没有检测到紫苏醇生成;而表达P450酶的实验组中,由于前述大肠杆菌BL21 (DE3)的生长受到抑制,只检测到较低浓度的紫苏醇产量,而恶臭假单胞菌F1组即菌株PpP450在24 h 时达到最高紫苏醇积累,且产量最高组为96.43 mg/L(图3-b)。从单位OD600的紫苏醇产量结果也可看出,恶臭假单胞菌F1发酵24 h的产量为15.32 mg/L,明显高于大肠杆菌BL21发酵48 h的产量7.64 mg/L(图3-c)。
2.3 不同底物浓度与紫苏醇产量关系验证
由于前序实验中菌株EccymAab、PpcymAab没有检测到紫苏醇产物,且大肠杆菌BL21 (DE3)的生长状态受到较大影响,因此选择P450酶进行后续实验,并调整了底物柠檬烯的添加浓度,设置1 mmol/L、5 mmol/L和10 mmol/L的浓度梯度范围,使用大肠杆菌BL21 (DE3)与恶臭假单胞菌F1作为发酵宿主,设置了不添加柠檬烯的空质粒组pBBR1-Ptrc作为对照,检测诱导24、48 h后发酵液中的细胞密度和紫苏醇产量。在菌体生长方面,加入柠檬烯后大肠杆菌BL21 (DE3)的生长状态依然受到了较大的抑制,并且抑制程度随着添加浓度的升高而增强;与之相对,添加柠檬烯的恶臭假单胞菌F1实验组生长情况随着柠檬烯浓度升高实验组的生长情况保持稳定(图4-a)。在紫苏醇产量方面,大肠杆菌BL21 (DE3)由于生长受到限制,在添加1 mmol/L柠檬烯的情况下经过48 h发酵所得紫苏醇最高浓度为28.8 mg/L;而对于恶臭假单胞菌F1,各组添加了不同浓度柠檬烯后所获得的紫苏醇产量也没有明显差异,菌株PpP450在添加1 mmol/L柠檬烯的情况下经过48 h发酵所得紫苏醇最高质量浓度为75.6 mg/L,对于柠檬烯的转化率达到49.66%(图4-b)。添加5 mmol/L柠檬烯的大肠杆菌BL21虽然在24 h获得较高紫苏醇产量,但在48 h时产量骤然减少;与之相比恶臭假单胞菌F1各组的紫苏醇生产积累较为稳定,添加1 mmol/L柠檬烯时在发酵48 h后达到最高单位OD600紫苏醇产量38.49 mg/L(图4-c)。
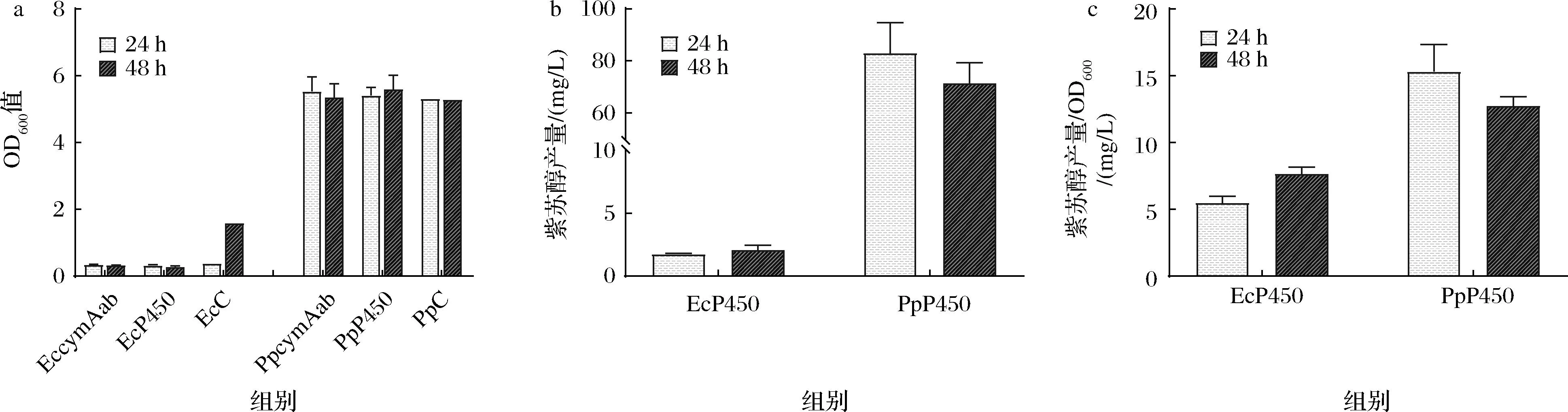
a-OD600值结果;b-紫苏醇产量结果;c-紫苏醇产量/OD600结果图3 添加10 mmol/L柠檬烯大肠杆菌BL21 (DE3)和恶臭假单胞菌F1的OD600和紫苏醇产量结果Fig.3 OD600 and Perillyl alcohol yield results of E.coli BL21 (DE3) and P.putida F1 with the addition of 10 mmol/L limonene
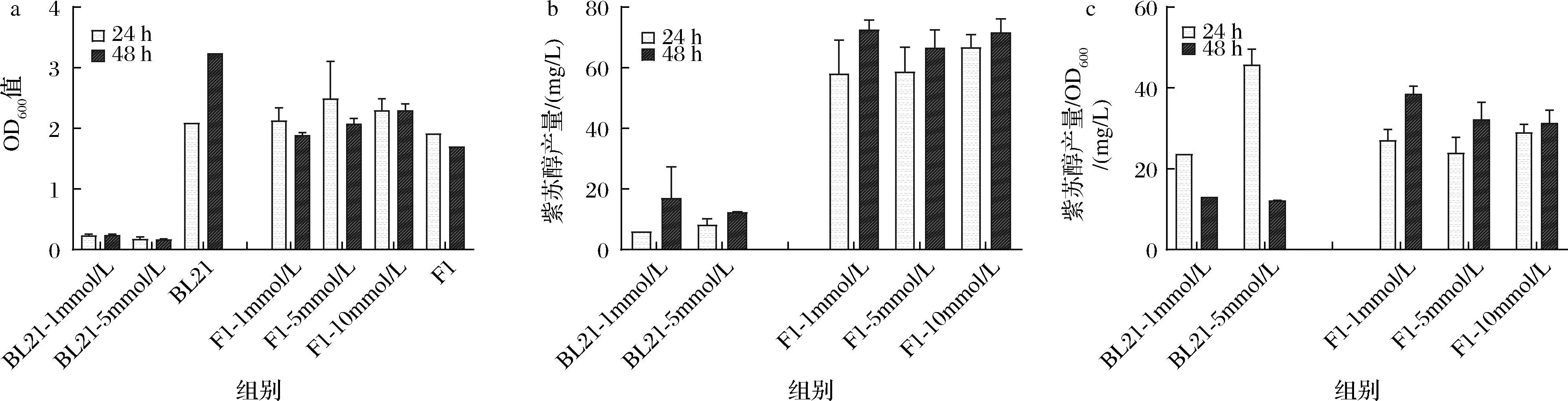
a-OD600值结果;b-紫苏醇产量结果;c-紫苏醇产量/OD600结果图4 添加不同浓度柠檬烯大肠杆菌BL21 (DE3)和恶臭假单胞菌F1的OD600和紫苏醇产量结果Fig.4 OD600 and perillyl alcohol yield results of E.coli BL21 (DE3) and P.putida F1 with the addition of different concentration of limonene
3 讨论
紫苏醇作为单萜类化合物,在医药、食品、日化等方面具有广泛的应用价值,然而化学合成法的高昂成本与环境污染、生物合成法的低选择性与对宿主毒性都是获取紫苏醇的过程中亟需解决的问题。P450酶的引入实现了将柠檬烯特异性转化为紫苏醇,极大程度推动了微生物合成紫苏醇的研究进程。但是由于萜类物质对微生物具有毒性,更高的底物、产物浓度意味着对宿主菌株生长的更大压力。
大肠杆菌作为常用的工业模式菌株,其明确的代谢背景、易于培养等特点,使得大肠杆菌作为表达外源基因宿主受到广泛应用。而如实验结果显示,大肠杆菌BL21 (DE3)对于柠檬烯的耐受度较低,在外源添加柠檬烯的环境中大肠杆菌BL21 (DE3)的生长会受到较大影响,从而影响其蛋白表达、进而使得生物转化能力受到限制。而无论是否添加柠檬烯,恶臭假单胞菌F1的生长状态均没有受到明显影响,对于10 mmol/L以内的柠檬烯具有较高耐受性。
在羟化酶的选择上,本研究使用了恶臭假单胞菌F1自身来源的CymAab和有生物转化柠檬烯生成紫苏醇相关报道的P450酶,结果证明CymAab并没有原先猜测的能选择性羟化(S)-(-)-柠檬烯的能力,而P450酶在恶臭假单胞菌F1中效果良好。在进一步进行恶臭假单胞菌F1表达P450酶催化紫苏醇合成实验探究时,发现不同柠檬烯添加浓度所获得的紫苏醇产量并无较大差别,因此可以推断在添加1 mmol/L柠檬烯时底物浓度对于P450酶的催化效率已达到饱和,即一定范围内更高浓度的柠檬烯添加虽然不会影响恶臭假单胞菌F1的生长状态,但也不能被利用生成更多产物。如果在现有的体系基础上进一步进行提升紫苏醇的产量的后续实验,可以从P450酶表达量、活性等方面着手。
结合菌体生长与紫苏醇产量二者的数据,在以柠檬烯为底物生物合成紫苏醇的过程中,恶臭假单胞菌F1相较于大肠杆菌BL21 (DE3)或许更适合于作为发酵宿主。与VAN等[15]在使用恶臭假单胞菌GPo12时所遇到的情况不同,恶臭假单胞菌F1在含有10 mmol/L柠檬烯浓度以内的环境下展现出较高的耐受性,或许可以成为突破萜类物质毒性影响宿主生长问题的关键。另一方面,梯度浓度添加的底物的紫苏醇产物结果也为后续实验缩小了底物使用范围,并将限制产量的因素引导向P450酶方向。如先前描述表达载体构建时,本实验所使用的P450酶经过大肠杆菌密码子偏好优化,且恶臭假单胞菌F1为野生型菌株,后续针对产量提高的相关改造具有较大潜力。
4 结论
本研究通过构建广宿主表达载体,并在其上连接P450酶及其辅因子3个基因后,将质粒转入大肠杆菌BL21 (DE3)和恶臭假单胞菌F1中,外源添加柠檬烯并进行浓度调整后,获得对柠檬烯具有较高耐受性的恶臭假单胞菌F1,添加1 mmol/L柠檬烯底物发酵48 h后获得最高产量75.6 mg/L,转化率达到49.66%,缩小了生物合成紫苏醇的有效底物添加范围,并提供了具有改造潜力的宿主菌株。
