柱花草SgPAL3基因启动子的克隆及上游转录因子的筛选
2024-02-02戴镕徽高梦泽王芳蒋凌雁罗丽娟
戴镕徽 高梦泽 王芳 蒋凌雁 罗丽娟


doi:10.11733/j.issn.1007-0435.2024.01.007
引用格式:
戴镕徽, 高夢泽, 王 芳,等.柱花草SgPAL3基因启动子的克隆及上游转录因子的筛选[J].草地学报,2024,32(1):66-74
DAI Rong-hui, GAO Meng-ze, WANG Fang,et al.Cloning of SgPAL3 Gene Promoter and Screening of Upstream Transcription Factors in Stylosanthes[J].Acta Agrestia Sinica,2024,32(1):66-74
收稿日期:2023-08-14;修回日期:2023-10-02
基金项目:国家自然科学基金项目(32201449,31872409);海南大学协同创新中心项目(XTCX2022NYC02);海南省自然科学基金高层次人才项目(320RC466);海南省科技专项(ZDYF2020211)资助
作者简介:
戴镕徽(1999-),女,汉族,黑龙江富锦人,硕士研究生,主要从事抗病相关基因克隆与功能研究,E-mail:dairh1999@163.com;*通信作者Author for correspondence,E-mail:lyjiang@hainanu.edu.cn
摘要:柱花草(Stylosanthes spp.)是热带地区广泛种植的重要草种,炭疽病是危害柱花草的严重病害,柱花草SgPAL3基因具有抗炭疽菌的功能。本研究对启动子区域-2 000~0 bp,-1 500~0 bp序列分别构建诱饵载体并检测自激活,结果表明500 ng·mL-1金担子素(Aureobasidin A,AbA)可以抑制两种诱饵载体的自激活。利用Gateway技术构建了柱花草响应炭疽菌的酵母cDNA文库,其容量为1.20×107,插入片段主要分布在750~2 000 bp,重组率为100%;利用酵母单杂交技术,筛选与SgPAL3基因启动子互作的转录因子,并验证了3个转录因子(SgASIL2,SgHAT5和SgZHD8)与SgPAL3启动子的互作关系;qRT-PCR分析表明,SgASIL2,SgHAT5和SgZHD8均响应炭疽菌的侵染,说明它们可能调控柱花草对炭疽病的抗性。本研究为进一步解析SgPAL3响应炭疽菌侵染的转录调控机制奠定了基础。
关键词:柱花草;启动子;酵母单杂;转录因子;SgPAL3基因
中图分类号:Q943.2 文献标识码:A 文章编号:1007-0435(2024)01-0066-09
Cloning of SgPAL3 Gene Promoter and Screening of Upstream
Transcription Factors in Stylosanthes
DAI Rong-hui1,2, GAO Meng-ze1,2, WANG Fang1,2, JIANG Ling-yan1,2*, LUO Li-juan1,2
(1.School of Tropical Agriculture and Forestry, Hainan University, Haikou, Hainan Province 570228, China;
2.Sanya Institute of Breeding and Multipication, Hainan University, Sanya, Hainan Province 572025, China)
Abstract:Stylosanthes (stylo) is an important leguminous forage widely grown in tropical areas. Anthracnose is a serious disease affecting the growth of stylo. Previous studies show that SgPAL3 gene of stylo has function in the resistance against Colletotrichum gloeosporipides. In this study,the promoter regions of -2 000 to 0 bp and -1 500 to 0 bp were cloned into bait vectors,and the concentration of AbA that can inhibit the self-activation of bait vectors was determined. The results showed that 500 ng·mL-1 (Aureobasidin A,AbA) inhibited the self-activation of both bait vectors. The yeast cDNA library of stylo in response to C. gloeosporioides infection was constructed using the Gateway technology. The capacity of the library was 1.20×107. The inserted fragments were mainly distributed from 750 to 2 000 bp,and the recombination rate was 100%. The transcription factors interacting with SgPAL3 gene promoter were screened by yeast one-hybrid technique,and the the interactions of three transcription factors (SgASIL2,SgHAT5 and SgZHD8) with the SgPAL3 promoter were verified by yeast point-to-point experiments. The qRT-PCR analysis showed that the expression of SgASIL2,SgHAT5 and SgZHD8 were all responsive to C. gloeosporioides infection,indicating the these three transcription factors involved in regulating the defense responses of stylo against C. gloeosporioides. These results would lay a foundation for further research on transcriptional regulation mechanisms of SgPAL3 in response to C. gloeosporioides infection.
Key words:Stylosanthes;Promoter;Yeast one-hybrid;Transcription factors;SgPAL3 gene
柱花草是重要的热带豆科牧草,因适应性强、产草量高等优良特性,还被广泛用于绿肥和热区林果草生态工程建设等[1-3]。由胶孢炭疽菌(Colletotrichum gloeosporipides)引起的炭疽病是危害柱花草生产的严重病害[4]。苯丙烷途径是植物体内最重要的次生代谢途径之一,可以产生多种重要的次生代谢产物[5]。其中,苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)是苯丙烷类代谢途径的第一个关键酶,广泛存在于高等植物和微生物中,并在植物的生长发育和抗病过程中起重要作用[6]。作者团队前期通过对超量表达SgPAL3拟南芥(Arabidopsis thaliana)植株接种胶孢炭疽菌的病症表型观察、胶孢炭疽菌在植株内表达量和侵染进程检测,表明超量表达SgPAL3增强了植株对炭疽菌的抗病性,暗示着柱花草SgPAL3基因在柱花草抗炭疽病过程中发挥着重要作用[7]。但是,目前有关SgPAL3基因功能在分子水平上的调控机制鲜有报道,与SgPAL3基因互作蛋白也有待挖掘。
酵母单杂交(Yeast one-hybrid system,Y1H)是在酵母体内研究转录因子和启动子之间相互作用的技术[8]。目前,已通过该项技术在烟草(Nicotiana tabacum)、水稻(Oryza sativa)等模式植物中筛选出可以调控目的基因的转录因子,但在柱花草中应用该技术较少[9-10]。
为筛选与SgPAL3基因启动子结合的转录因子,解析柱花草PAL基因的分子调控机制,本研究从‘热研5号柱花草(Stylosanthes guianensis ‘Reyan No.5)基因组中克隆SgPAL3基因的启动子序列,并对启动子区域-2 000~0 bp,-1 500~0 bp序列分别构建诱饵载体,利用酵母单杂交技术筛选并验证了与SgPAL3启动子互作的转录因子。研究结果为深入研究SgPAL3基因的转录调控机制提供了基础,也为柱花草抗病品种选育提供了实验依据。
1 材料与方法
1.1 试验材料及试剂
植物材料为苗龄1个月的‘热研5号柱花草叶片。
菌种为胶孢炭疽菌强致病菌DZ-19和弱致病菌WC-02,由作者团队筛选保存[11]。
产物纯化、质粒提取试剂盒购自诺唯赞生物科技(南京)股份有限公司。限制性内切酶Kpn Ⅰ,Xho Ⅰ和Bstb I购于NEB(美国)有限公司,T4连接酶购于Thermo Fisher(美国)有限公司。酵母培养所需的酵母氮源培养基(Yeast Nitrogen Base,YNB)购于索莱宝科技(北京)有限公司。金担子素(AbA)和缺陷型培养基(Do Supple ment/-Ura,SD/-Ura,Do Supplement/-Leu,SD/-Leu)购自酷来搏科技(北京)有限公司。
柱花草cDNA文库由欧易生物医学科技(上海)有限公司构建。酵母单杂交菌株Y1H Gold、诱饵载体pAbAi及Prey载体pGADT7均由欧易生物医学科技(上海)有限公司提供,试验所用引物均由北京擎科生物科技有限公司完成(表1)。测序由楠山生物技术(海口)有限公司完成。
1.2 试验方法
1.2.1 柱花草SgPAL3基因启动子的克隆及顺式作用元件分析 根据SgPAL3基因启动子序列,分别截取起始密码子5方向上游1 500 bp和2 000 bp作为SgPAL3基因启动子候选序列,使用Oligo 7设计上下游引物并分别引入Kpn Ⅰ和Xho Ⅰ限制性内切酶位点。提取‘热研5号柱花草的基因组DNA作为模板,pAbAi-SgPAL3-A/B-F,pAbAi-SgPAL3-R为引物(表1),使用高保真DNA聚合酶2 × Phanta Max Master Mix进行PCR扩增得到SgPAL3基因启动子。反应程序为95℃ 3 min,95℃ 15 s,53℃ 15 s,72℃ 80 s,32个循环。
利用在线分析软件PlantCARE(http://bioinformatics.psb.ugent.be/Webtools/plantcare/html/),预测SgPAL3基因启动子区域的顺式作用元件。
1.2.2 诱饵载体的构建及转化酵母Y1H Gold 用Kpn Ⅰ和Xho Ⅰ酶对载体pAbAi和SgPAL3启动子的纯化片段分别进行双酶切,用T4连接酶在16℃过夜连接。将连接产物转入大肠杆菌DH5α感受态细胞中,筛选阳性克隆送至公司进行测序。获得诱饵载体pAbAi-SgPAL3,并将重组诱饵载体分别命名为pAbAi-SgPAL3-A,pAbAi-SgPAL3-B。
用Bstb I酶线性化诱饵载体pAbAi-SgPAL3-A,pAbAi-SgPAL3-B。将1 μg纯化后的线性化载体转入Y1H酵母感受态细胞中,涂布于SD/-Ura平板上,28℃培养3~5 d后挑取单菌落,使用pAbAi-F/R(表1)为检测引物进行PCR鉴定。若扩增出一段条带约0.39 kb+insert size的片段,则表明诱饵载体成功整合到酵母Y1H Gold基因組中,即为诱饵菌株Y1H[pAbAi-SgPAL3-A],Y1H[pAbAi-SgPAL3-B]。
1.2.3 诱饵酵母菌株对AbA敏感性的检测 从SD/-Ura平板上挑取鉴定为阳性的酵母单菌落,置于SD/-Ura液体培养基中28℃,200 r·min-1振荡培养;使用ddH2O重悬至OD600=0.002(即每100 μL重悬液中包含2 000个细胞),各取100 μL上述菌液涂布在含有不同AbA浓度的SD/-Ura培养基上,AbA质量浓度分别为0,100,200,300,400,500 ng·mL-1,28℃培养3 d,根据酵母菌落的生长情况确定抑制诱饵菌株生长所需的最小AbA质量浓度。
1.2.4 酵母cDNA文库的构建 采用全株喷洒孢子悬浮液的方式对1月龄‘热研5号柱花草分别喷洒胶孢炭疽菌DZ-19和WC-02,提取接种后0,24,48,60,96小时(hours post inoculation,hpi)的10种样品RNA,并等量混匀,委托欧易生物医学科技(上海)有限公司通过Gateway技术构建酵母cDNA文库。
1.2.5 酵母单杂交cDNA文库的筛选及测序分析 根据欧易生物医学科技(上海)有限公司提供的说明书进行酵母单杂筛库实验。将次级酵母文库质粒10 μg分别转化到诱饵酵母菌株Y1H[pAbAi-SgPAL3-A],Y1H[pAbAi-SgPAL3-B]感受态细胞里,取转化后的重悬菌液100 μL,涂布到含有相应浓度AbA的SD/-Leu固体培养基上,28℃恒温培养3~5 d,单克隆长出至大小1~2 mm,初筛完成;将初筛平板上长出的阳性克隆转移到同样的筛选培养基SD/-Leu/AbA*上,进行二次筛选。挑取生长较大的阳性克隆进行PCR鉴定,使用表1检测引物3AD/T7进行PCR鉴定,PCR产物送至公司进行测序。将测序序列在NCBI(https://www.ncbi.nlm.nih.gov/)上进行Blast比对,结合接种胶孢炭疽菌的柱花草转录组学数据分析[4]及Nr同源物种注释结果对其进行功能注释,并在CDD网站(https://www.ncbi.nlm.nih.gov/cdd)中进行保守结构域的预测。
1.2.6 候选转录因子的酵母单杂交验证 根据转录组测序的转录本序列,获得候选转录因子全长cDNA序列。通过PCR扩增候选转录因子的全长,利用同源重组的方法构建到pGADT7载体上,正反向引物序列见表1。
提取候选转录因子的质粒,将诱饵酵母制备成感受态细胞,通过共转的方式将质粒转化至酵母感受态中,使用3AD/T7(表1)为检测引物进行PCR鉴定;挑取阳性克隆,接种于SD/-Leu液体培养基于28℃摇床扩繁。使用ddH2O将菌液按照1∶10,1∶100,1∶1 000稀释后,分别点于SD/-Leu和SD/-Leu/AbA*平板,倒置于28℃培养箱3~5 d,观察生长情况。
1.2.7 候选基因qRT-PCR鉴定 为了明确候选转录因子在接种胶孢炭疽菌后的表达特性,对1月龄‘热研5号柱花草喷洒接种胶孢炭疽菌DZ-19,提取接种后0,24,48,60,72,96 hpi的样品RNA,采用Vazyme公司的反转录试剂盒将RNA反转为cDNA,用Oligo 7设计目的基因的引物(表1),以UBCE1为内参基因,进行qRT-PCR检测。采用2-△△Ct方法计算各基因的相对表达量。
2 结果与分析
2.1 柱花草SgPAL3基因的克隆和序列分析
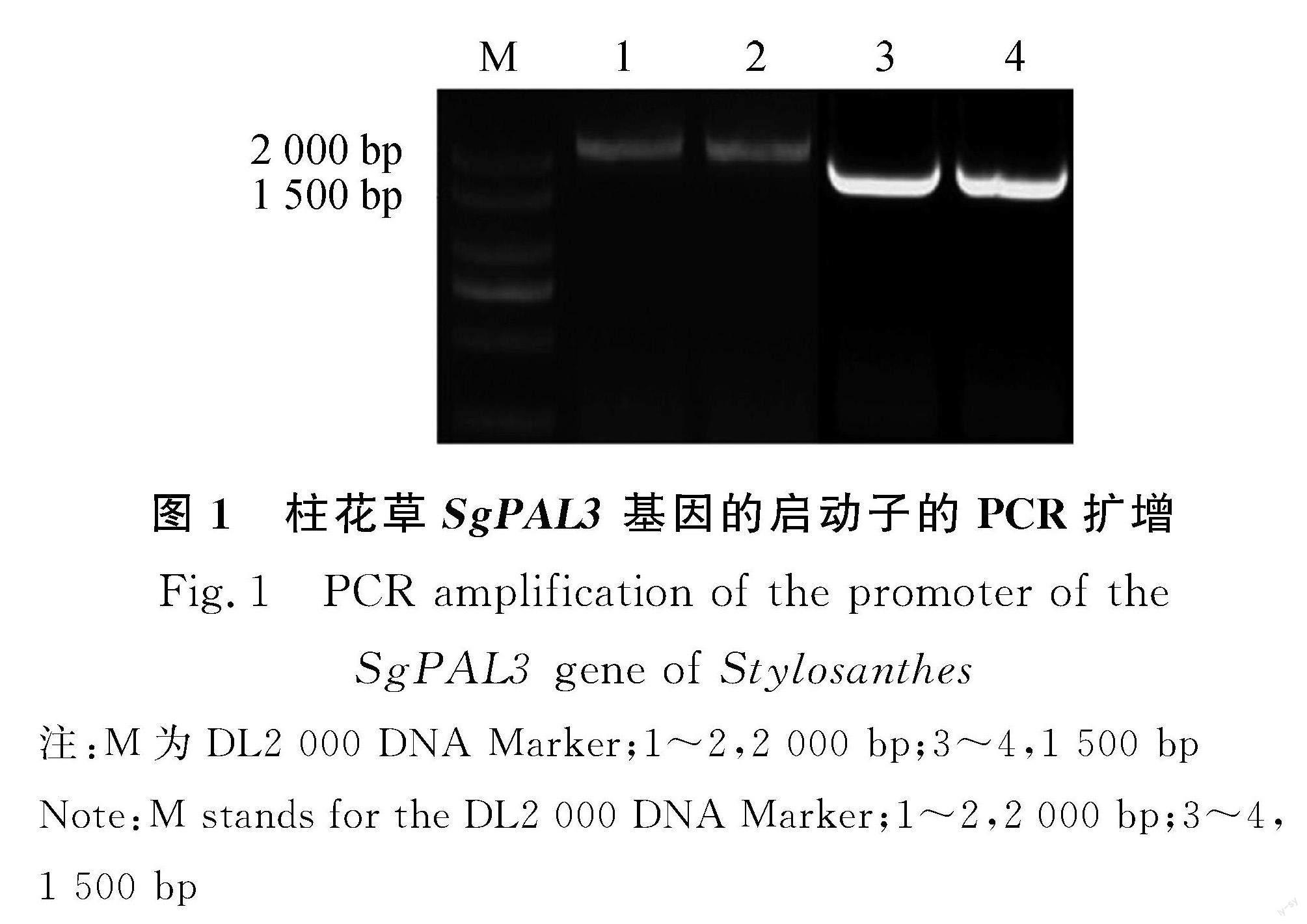
以‘热研5号柱花草叶片的DNA為模板,扩增SgPAL3基因的启动子序列。结果如图1所示,扩增的条带大小分别约为2 000 bp和1 500 bp。将所克隆的片段回收后连接到pAbAi载体上,挑选阳性克隆送至公司进行测序。构建完成的重组质粒测序结果与目的序列一致,相似性达100%。根据测序获得的启动子序列,利用在线网站PlantCARE对SgPAL3启动子进行顺式作用元件分析。表2结果表明,在SgPAL3启动子区中含有核心启动子元件TATA-box,CAAT-box,植物激素响应元件ERE,TCA-element,ABRE,AAGAA-motif,光响应元件Box-4,G-box,LAMP-element,环境胁迫响应元件ARE,WUN-motif,分生组织表达调节元件CAT-box,细胞周期结合元件MSA-like以及MYB,MYC转录因子结合元件。但是,仅在2 000 bp的SgPAL3启动子中发现了WRKY转录因子结合元件W-box。
2.2 诱饵载体的构建及酵母菌株的转化
用载体引物对转入诱饵载体的单菌落进行菌落PCR验证,得到与目的基因大小一致的条带,如图2A所示。将对应菌液送至公司进行测序,测序结果与目的片段一致,表明上述诱饵载体构建成功。
将构建好的诱饵载体pAbAi-SgPAL3-A,pAbAi-SgPAL3-B用Bst BI单酶切鉴定,酶切后的质粒与原质粒的条带大小存在差异,如图2B所示,说明成功获得线性化载体。回收A中的线性化载体并转入Y1H Gold酵母菌感受态细胞中,使用通用引物对单菌落进行菌落PCR验证,如图2C所示,酵母单菌落中分别含有约2.39 kb(2.0 kb+0.39 kb)和一段约1.89 kb(1.5 kb+0.39 kb)的片段,说明诱饵载体成功转入酵母基因组,成功获得了酵母诱饵菌株Y1H[pAbAi-SgPAL3-A],Y1H[pAbAi-SgPAL3-B]。
2.3 AbA抗性筛选
挑取上述两种酵母菌株的阳性菌落,用ddH2O重悬细胞,直至OD600=0.002,分别涂布于含AbA浓度0,100,200,300,400,500 ng·mL-1的SD/-Ura培养基上。检测结果如图3所示,转化菌株在100 ng·mL-1 AbA培养基上生长良好,而在500 ng·mL-1 AbA培养基上完全停止生长,说明500 ng·mL-1可用于酵母单杂筛选。
2.4 酵母cDNA文库的构建与质量检测
采用接种胶孢炭疽菌后的柱花草叶片构建了酵母cDNA文库(图4A),库容量为1.20×107。随机挑取24个克隆进行菌落PCR鉴定,插入片段主要分布在750~2 000 bp,重组率为100%,结果如图4B所示,说明文库质量较好,且符合筛库标准。
2.5 SgPAL3启动子片段与柱花草cDNA文库的酵母单杂筛选
在SD/-Leu/AbA(500 ng·mL-1)平板初筛中,Y1H[pAbAi-SgPAL3-A]共获得198个的阳性酵母菌落,Y1H[pAbAi-SgPAL3-B]共获得68个阳性酵母菌落。划线二次培养后,使用通用引物进行阳性克隆的PCR检测,PCR产物送至公司进行测序,结果如图5所示,Y1H[pAbAi-SgPAL3-A]共得到132条序列,Y1H[pAbAi-SgPAL3-B]共得到42条序列。
在NCBI上对测序结果进行Blast比对,并结合柱花草响应炭疽菌侵染的转录组学数据和Nr同源物种的注释信息,共获得了83个候选基因。将候选基因的核酸序列在CDD网站进行保守结构域分析,共筛选到3个基因具有典型的DNA结合域,预测为转录因子(表3),分別为Trihelix家族的ASIL2、HD-Zip家族的HAT5和ZF-HD家族的ZHD8。
2.6 酵母单杂交验证
为了验证SgASIL2,SgHAT5和SgZHD8是否与SgPAL3-A启动子存在互作关系,将诱饵载体SgPAL3-A分别与3个转录因子构建的酵母表达载体共转化后观察酵母细胞的生长情况。结果如图6所示,在SD/-Leu培养基上,诱饵酵母细胞均能生长,说明AD质粒已转入诱饵酵母细胞;在添加了500 ng·mL-1 AbA的SD/-Leu培养基上,阳性对照和3个候选转录因子均能正常生长,阴性对照不生长,表明SgASIL2,SgHAT5和SgZHD8与SgPAL3-A启动子区存在互作关系。
2.7 候选基因荧光定量表达分析
为确定转录因子SgASIL2、SgHAT5和SgZHD8是否响应炭疽菌的侵染,以接种胶孢炭疽菌后0,24,48,60,72和96 hpi‘热研5号柱花草叶片的cDNA为模板,通过qRT-PCR技术检测其相对表达量,结果如图7所示,在接种胶孢炭疽菌后,SgASIL2的相对表达量呈现整体下调的趋势,SgHAT5和SgZHD8的相对表达量则呈现先降低、后升高、再降低的趋势,并在60 hpi达到峰值。以上结果表明,SgASIL2,SgHAT5和SgZHD8均对炭疽菌的侵染有响应,推测它们可能为SgPAL3启动子响应炭疽菌的调控因子。
3 讨论
研究发现,大量的转录因子参与植物苯丙烷的代谢调控,不同类型的转录因子可分别结合到PAL,C4H及4CL等基因的启动子区,激活或抑制其表达[9,12]。转录调控依赖于顺式作用元件和反式作用因子的协调作用,是植物基因表达调控中的重要环节[13-14]。顺式作用元件具有序列和功能保守型,如TCA-element,ABRE,TGACG-motif是植物激素生长素、脱落酸、茉莉酸甲酯的响应元件,MBS,ARE,LTR是植物干旱响应、厌氧诱导、低温胁迫相关的响应元件[15]。转录因子通过与各种生物及非生物胁迫应答基因启动子区的顺式作用元件相互作用,调控下游逆境胁迫应答靶基因的表达,使植物适应各种逆境[16]。如植物转录因子可以与靶基因启动子结合,激活或抑制其表达,从而参与激素介导的抗病反应[17]。SgPAL3在柱花草接种炭疽菌后显著上调,超量表达SgPAL3的植株对炭疽菌的抗病性增强,预示SgPAL3是柱花草抗炭疽菌的正调控因子[18]。本研究对SgPAL3基因上游2 000 bp和1 500 bp启动子区域的顺式作用元件进行了预测(表2),表明其可能在植物抵御病原菌侵染、生长发育、响应激素信号分子的刺激等生物过程中发挥作用。为了进一步探究SgPAL3受哪些转录因子的调控,本研究通过构建响应炭疽菌侵染的酵母cDNA文库、单杂交技术筛库和点对点实验(图4~6),证明了SgASIL2,SgHAT5和SgZHD8与SgPAL3的2 000 bp启动子区域存在互作关系。
ASIL2属于Trihelix家族,该基因家族既调控植物的生长发育,又能帮助植物响应逆境胁迫[19-20]。Ruiz等[21]研究发现,ASIL1及其同源基因ASIL2可能参与营养阶段对某些生物和非生物胁迫的反应。ASIL2基因负调控番茄(Solanum lycopersicum)对干旱和盐胁迫的适应性[22]。HAT5属于HD-Zip家族,番茄中过表达PsHAT5增强了番茄的耐旱耐盐性和低温敏感性[23],吉林人参(Jilin Ginseng)中HD-Zip家族的表达模式存在时空特异性,目前无生物胁迫方面的报道[24]。ZHD8属于ZF-HD家族,该基因家族在植物生长发育、非生物响应和生物胁迫过程中起到重要的调控作用[25]。Wang等[26]研究发现,葡萄(Vitis vinifera L.)在接种白粉菌(Erysiphe necator)后,多数VvZHD基因表达下调,如VvZHD1,4,8和12。黄瓜在接种白粉菌(Sphaerotheca fuliginea)和霜霉菌(Pseudoperonospora cubensis)后,CsZHD家族出现了差异表达,CsZHD8和CsZHD4在接种后显示出先降低、后升高、再降低的表达模式[27]。本研究通过荧光定量实验,比较了不同时间处理后的相对表达量。结果表明,在接种炭疽菌后,SgASIL2在接种炭疽菌后显著下调表达(图7A),预示其在柱花草抗炭疽菌过程中可能发挥负调控作用,与向小雪[22]的结果类似。SgHAT5(图7B)和SgZHD8(图7C)在接种后呈现先下调、后上调、再下调的趋势,表达趋势与黄瓜CsZHD4,CsZHD8,葡萄VvZHD8相似,预示本研究中SgASIL2,SgHAT5和SgZHD8参与了柱花草抗炭疽菌的过程。在60 hpi SgHAT5(图7B)和SgZHD8(图7C)的表达量达到峰值,可能与响应炭疽菌的模式有关。
综上所述,转录因子SgASIL2,SgHAT5和SgZHD8的相对表达量响应炭疽菌的侵染而发生变化,且SgPAL3基因可与转录因子SgASIL2,SgHAT5和SgZHD8结合,但SgASIL2,SgHAT5和SgZHD8通过调控SgPAL3参与柱花草抗炭疽菌的作用机制还有待进一步研究。
4 结论
本研究通过构建柱花草的cDNA酵母文库、酵母单杂交筛库和点对点验证实验证实了3个可与SgPAL3基因启动子区域互作的转录因子:Trihelix家族的SgASIL2,HD-Zip家族的SgHAT5和ZF-HD家族的SgZHD8。荧光定量实验验证了柱花草中,SgASIL2,SgHAT5和SgZHD8均响应炭疽菌的侵染。研究结果为进一步解析SgPAL3响应炭疽菌侵染的转录调控机制奠定了基础。
参考文献
[1]張世子,杨丽云,高静,等. 柱花草响应炭疽菌侵染的差异磷酸化蛋白质组学分析[J]. 草地学报,2023,31(3):699-709
[2]邹晓燕,王林杰,黄杰,等. 柱花草SgNramp1和SgNramp2基因克隆与表达分析[J]. 草地学报,2022,30(6):1388-1395
[3]王俐媛,王坚,丁西朋,等. 3种圭亚那柱花草根系分泌物对杂草幼苗生长的影响[J]. 草地学报,2022,30(6):1500-1508
[4]JIANG L Y,WU P P,YANG L Y,et al. Transcriptomics and metabolomics reveal the induction of flavonoid biosynthesis pathway in the interaction of Stylosanthes-Colletotrichum gloeosporioides[J]. Genomics,2021,113(4):2702-2716
[5]耿晓姗,朱宇林,蒙柳密,等. 牛大力苯丙氨酸解氨酶的克隆和生物信息分析[J]. 分子植物育种,2022,20(5):1514-1521
[6]DONG N,LIN H. Contribution of phenylpropanoid metabolism to plant development and plant environment interactions[J]. Journal of Integrative Plant Biology,2021,63(1):180-209
[7]万敉町. 胶孢炭疽菌侵染柱花草和拟南芥的分子检测技术研究[D]. 海口:海南大学,2022:38-41
[8]王雪,王盛昊,于冰. 转录因子和启动子互作分析技术及其在植物应答逆境胁迫中的研究进展[J]. 中国农学通报,2021,37(33):112-119
[9]余婧,杨慧,余世洲,等. 烟草NtCBT基因启动子酵母单杂诱饵载体构建及互作蛋白筛选[J]. 生物技术通报,2022,38(10):73-79
[10]李濯雪. 利用酵母单杂交方法对OsHsfB2c启动子结合蛋白的筛选[D]. 长沙:湖南农业大学,2015:34
[11]GAO M Z,WAN M T,YANG L Y,et al. Molecular and physiological characterization of Arabidopsis-Colletotrichum gloeosporioides pathosystem[J]. Plant Pathology,2021,70(5):1168-1179
[12]NING Y,WANG G L. Breeding plant broad-spectrum resistance without yield penalties[J]. Proceedings of The National Academy of Sciences of The United States of America,2018,115(12):2859-2861
[13]XIE Z L,NOLAN T M,JIANG H,et al. AP2/ERF Transcription Factor Regulatory Networks in Hormone and Abiotic Stress Responses in Arabidopsis[J]. Frontiers in Plant Science,2019(10):228
[14]刘宽,李剑,段钰晶,等. 植物非生物逆境诱导型启动子研究进展[J/OL].http://kns.cnki.net/kcms/detail/46.1068.S.20220410.2211.016.html,2022-04-12/2023-08-14
[15]张雪,程荔书,张军,等. 高等植物不同类型启动子及其相关顺式元件研究进展[J]. 高师理科学刊,2023,43(4):60-67
[16]WANG Y,XU W,CHEN Z X,et al. Gene structure,expression pattern and interaction of Nuclear Factor-Y family in castor bean (Ricinus communis)[J]. Planta,2018,247(3):559-572
[17]刘东晓,王幼平,吴健. WRKY转录因子在植物激素介导的抗病途径中的作用[J/OL].http://kns.cnki.net/kcms/detail/46.1068.S.20220512.0937.010.html,2022-05-12/2023-08-14
[18]王荟. 柱花草与炭疽菌互作的生理响应及苯丙氨酸解氨酶基因SgPAL1的功能研究[D]. 海口:海南大学,2018:55-56
[19]BUBNA G A,LIMA R B,ZANARDO D Y,et al. Exogenous caffeic acid inhibits the growth and enhances the lignification of the roots of soybean (Glycine max)[J]. Plant Physiol,2011,168(14):1627-1633
[20]王震,马伟. 中药大青叶、板蓝根基原植物菘蓝Trihelix基因家族鉴定及非生物胁迫下表达模式分析[J]. 中华中医药杂志,2023,38(5):2109-2115
[21]RUIZ K A,PELLETIER J M,WANG Y C,et al. A reevaluation of the role of the ASIL trihelix transcription factors as repressors of the seed maturation program[J]. Plant Direct. 2021,5(10):e345
[22]向小雪. Trihelix轉录因子SlASIL2在番茄生长发育及非生物胁迫中的功能研究[D]. 重庆:重庆大学,2022:97-98
[23]LIU X Y,LI A,WANG S S,et al. Overexpression of Pyrus sinkiangensis HAT5 enhances drought and salt tolerance,and low-temperature sensitivity in transgenic tomato[J]. Frontiers in Plant Science,2022(13):1036254
[24]李俐. 吉林人参HD-Zip基因家族的系统分析及PgHB14-2基因转化番茄的研究[D]. 长春:吉林农业大学,2017:31-32
[25]付鸿博,李杰,杨永超,等. 石榴ZF-HD基因家族鉴定与分析[J]. 河南农业科学,2022,51(6):119-125
[26]WANG H,YIN X J,LI X Q,et al. Genome-wide identification,evolution and expression analysis of the grape (Vitis vinifera L.) zinc finger-homeodomain gene family[J]. International Journal of Molecular Sciences,2014,15(4):5730-5748
[27]LAI W,ZHU C X,HU Z Y,et al. Identification and Transcriptional Analysis of Zinc Finger-Homeodomain (ZF-HD) Family Genes in Cucumber[J]. Biochemical Genetics,2021,59(4):884-901
(责任编辑 刘婷婷)
