‘热研2 号’柱花草对不同亲缘植物根系分泌物的生长响应
2022-03-21王俐媛赵元辰李雪枫
王俐媛,王 坚,赵元辰,许 超,李雪枫
(1. 热带特色林木花卉遗传与种质创新教育部重点实验室 / 海南大学林学院,海南 海口570228;2. 海南大学动物科技学院,海南 海口 570228)
在生态系统中,植物以种群或群落状态共存,意味着周围存在着同种或异种植物个体,导致相邻植物间因共同利用光、温度、水分和养分等而产生资源竞争。植物与异株植物之间的竞争强度和竞争方式会因邻株植物具体身份的不同而不同。根据植物与邻近植物亲缘关系的远近来调整自身生长发育,从而调整竞争策略的能力被称为植物的亲缘识别或植物的身份识别[1-2]。通过对邻近植株的身份识别,植物可以辨别自我/非自我以及亲缘关系的远近,从而产生相应的响应策略,获得最佳适合度[3]。然而,不同植物的响应策略存在着明显的物种差异,如豌豆(Pisum sativum)朝向非我邻株一侧生长的侧根长度显著大于朝向自我邻株一侧的侧根长度[4];裂叶牵牛(Ipomoea hederacea)与产自同母株的实生苗伴生时的根系生物量显著小于异母株实生苗伴生的根系生物量[5];美洲海滩芥(Cakile edentula)与同母株实生苗伴生时的根生物量比异母株实生苗伴生的根生物量少[6]。研究表明,根系分泌物是植物通过根系进行亲缘识别的关键影响因素[2-3,7]。通过根系分泌物的介导,植物能够探测邻近植物的身份,进而调整生物量分配、根系行为和根系构型等,以最佳生长反应来缓和与近亲缘个体之间的竞争[1-2,7]。近年来,牧草的亲缘识别与响应方面的研究已证明一年生黑麦草(Lolium multiflorum)能够识别亲缘邻居身份,通过减少根系分配量来减弱与亲缘邻居之间的地下竞争,提高群组适合度[8];白三叶(Trifolium repens)在较高密度时也表现出显著的亲缘识别响应,邻株为近亲时的生物量分配和比叶面积与邻株为非亲属种时相比差异显著[9]。
柱花草(Stylosanthes guianensis)是刈牧兼用型优质豆科牧草,具有抗旱、耐高温、保持水土、适应性强等优点[10-11]。中国自20 世纪80 年代初大量引进柱花草种质资源,现已培育出多个优良品种[12],被广泛用于我国热带、亚热带地区栽培草地建植、天然草地改良、果园与经济林下绿肥[13-15]。目前,人们对于柱花草的研究主要体现在其产量与品质[14]、高效固氮根瘤菌的筛选[16]、与常见杂草的竞争[17]以及遗传进化关系分析[18-19]等方面。在柱花草生产利用中主要着眼于某品种与另一种植物间混作[13,15],忽视了因亲属识别而产生的生物量分配策略及其他生长响应结果,忽视了柱花草种/品种组合效应的应用。亲属识别支配的生物量分配策略所减少的无意义竞争与人们对牧草生物量的需求紧密相关,明晰柱花草的亲属识别效应对通过构建适宜的种/品种组合来发展草地混播栽培新技术具有重要意义。因此,本研究以适应性强、在我国南方地区大面积推广种植的‘热研2 号’柱花草为研究对象,采取根系分泌物营养液处理的方法,研究‘热研2 号’柱花草幼苗对不同亲缘植物根系分泌物的生长响应,以期为探索柱花草的根系识别与响应机制,构建高产、可持续的柱花草混播栽培新模式提供理论基础。
1 材料与方法
1.1 试验材料
研究对象‘热研2 号’柱花草是从柱花草属中起源最早、分支最多、分布最广的圭亚那柱花草中选育出的一个品种[20]。根据种/品种选育来源,以来自同一亲本的‘热研2 号’柱花草作为自我品种,以同属于圭亚那柱花草的‘热研5 号’柱花草、‘热研21 号’柱花草和‘热研24 号’柱花草为种内近缘亲属品种(简称近亲),以柱花草属内属于其他种的‘大叶’柱花草(S. grandifolia)、‘细茎’柱花草(S.gracilis)、‘有钩’柱花草(S. hamata)和‘西卡’柱花草(S. scabra)为种间远缘亲属种(简称远亲)。8 种柱花草的种子均由中国热带农业科学院热带作物品种资源研究所提供,其中‘热研5 号’、‘热研21 号’、‘热研24 号’、‘有钩’和‘西卡’柱花草均为经国家草品种审定委员会审定通过、在南方地区已经具有良好适应性的柱花草品种,而‘大叶’和‘细茎’柱花草为近年经引种选育表现良好、正在试行推广的新草种。所选物种的编号及亲缘关系如表1 所列。

表1 试验材料编号与亲缘关系Table 1 Number and kin relationship of plant species and varieties used in the study
1.2 试验方法
1.2.1 试验设计
参考魏嘉禾和陈斌[21]、黄冬芬等[22]的试验方法,用含有亲缘植物根系分泌物的营养液处理替代邻近种植植物进行水培试验。将‘热研2 号’柱花草-自我、‘热研2 号’柱花草-近亲、‘热研2 号’柱花草-远亲分别配对,共组成8 个处理对,每个处理对设6个重复。先将不同种柱花草幼苗种植在1/2 Hoagland营养液中收集柱花草种/品种的根系分泌物[22],然后将‘热研2 号’柱花草幼苗置于相对应的营养液中培养,生长7 d 后测定其生长指标。营养液的主要成分 为Ca(NO3)2·4H2O 472.50 mg·L-1, KNO3253.00 mg·L-1,NH4NO340.00 mg·L-1,KH2PO468.00 mg·L-1,MgSO4246.50 mg·L-1, FeSO4·7H2O 27.80 mg·L-1,EDTA-Na237.30 mg·L-1, H3BO332.86 mg·L-1,MnSO4·4H2O 2.13 mg·L-1,ZnSO4·7H2O 0.22 mg·L-1,CuSO4·5H2O 0.08 mg·L-1, (NH4)6Mo7O24·4H2O 0.02 mg·L-1。
1.2.2 试验方法与指标测定
种子预处理:分别选取大小一致、颗粒饱满的8 种柱花草种子,每种柱花草种子先用75%的酒精表面消毒10 min,洗净酒精后再用无菌水漂洗3~4 次,然后80 ℃水浴5~6 min 去除硬实[14],摊开自然冷却、晾干。
种子预萌发:将预处理后的各柱花草种子分别均匀放置在铺有双层滤纸、直径90 mm 的培养皿中,每皿50 粒,用无菌水浸润滤纸后,放入人工气候箱,在光照/黑暗10 h/14 h、25 ℃、相对湿度75%的条件下萌发,待胚根突破种皮0.5 cm 即可用于水培试验。
根系分泌物收集:选取已萌发的每种柱花草种子,移植至盛有1/2 Hoagland 营养液(pH 为5.8)、液面覆双层脱脂纱布的15 mL 玻璃管中,每管1 株柱花草,玻璃管放入上盖带孔的培养箱各孔洞中,使浸入营养液的根系避光生长。培养箱置于与种子萌发条件一致的人工气候箱内,每天定时向玻璃管内补充营养液,使水培溶液保持在恒定水平。待各柱花草植株生长10 d (处于三叶一心期),各玻璃管内的营养液中均浓集了柱花草的根系分泌物后,将原生长植株取出,试管中含根系分泌物的营养液即可用于根系分泌物影响试验。
根系分泌物影响试验:选取同期萌发、长势一致的‘热研2 号’柱花草。以根系置入另一收集有‘热研2 号’柱花草根系分泌物的营养液中培养为自我处理,即对照组;以根系置入收集有近亲柱花草(‘热研5 号’、‘热研21 号’、‘热研24 号’)根系分泌物的营养液中继续培养为近亲处理组;以根系置入收集有远亲柱花草(‘大叶’、‘细茎’、‘有钩’、‘西卡’)根系分泌物的营养液中继续培养为远亲处理组。为消除位置间的光照不均对生长的影响,每天随机调整试管位置。在根系分泌物营养液中生长7 d 后,测量每株‘热研2 号’柱花草幼苗的根长和株高,计数其侧根数,然后用吸水纸吸干各柱花草植株表面的水分,分离茎叶和根,用感量0.1 mg 天平测定其茎叶生物量与根生物量(鲜重)。
1.3 数据处理与分析
采用SPSS 21.0 对各生长指标进行单因素方差分析,用Duncan 法在P< 0.05 水平进行显著性检验,其中根长、侧根数量、根生物量、茎叶生物量、总生物量和根冠比指标方差齐性检验合适,株高因方差齐性检验不合适采用log 函数转化后再检验。用灰色关联法评判‘热研2 号’柱花草对7 种亲缘柱花草根系分泌物的生长响应程度[23]。采用GraphPad Prism 8.0 制图,所有数据用平均值 ± 标准差表示。
2 结果与分析
2.1 不同亲缘植物根系分泌物对‘热研2 号’柱花草株高的影响
远亲处理组的平均株高为43.78 mm,比自我处理组降低了10.52%,且处理间差异显著(P< 0.05),近亲处理组的平均株高与自我处理组之间无显著差异(P> 0.05) (图1)。‘热研2 号’柱花草在‘热研24 号’、‘有钩’和‘细茎’柱花草的根系分泌物营养液中生长时,其株高分别为41.27、39.20 和40.55 mm,比自我处理分别显著降低了15.67%、19.89%和17.13% (P< 0.05);‘热研5 号’、‘热研21 号’、‘大叶’和‘西卡’柱花草根系分泌物营养液中生长时,其株高均与自我处理无显著差异(P> 0.05)。
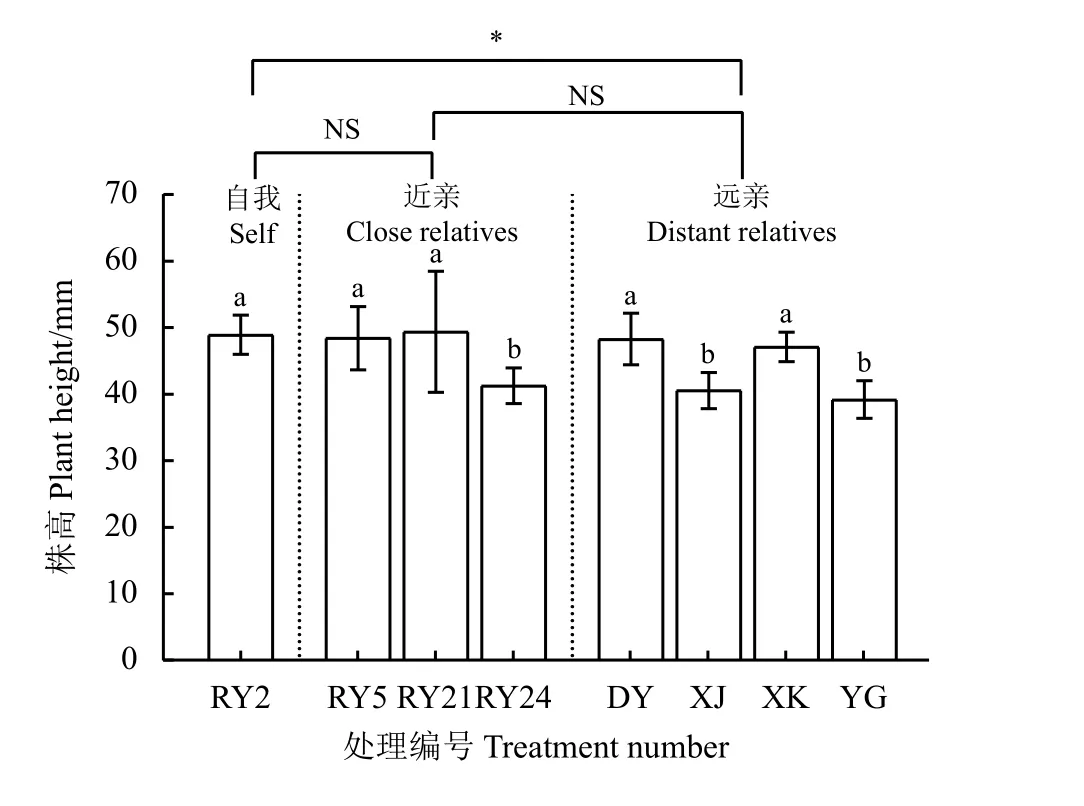
图1 不同亲缘植物根系分泌物对‘热研2 号’柱花草株高的影响Figure 1 Effects of root exudates from different relatives on plant height of Stylosanthes guianensis ‘Reyan No. 2’
2.2 不同亲缘植物根系分泌物对‘热研2 号’柱花草根系生长的影响
2.2.1 不同亲缘植物根系分泌物对根长的影响
远亲处理组的平均根长为46.64 mm,分别比近亲处理组和自我处理组的平均根长显著增加了14.14%和21.35% (P< 0.05),近亲处理组和自我处理组的平均根长之间无显著差异(P> 0.05) (图2)。在‘热研5 号’、‘热研21 号’和‘热研24 号’柱花草的根系分泌物营养液中生长时,与‘热研2 号’柱花草的根长之间无显著差异(P> 0.05);在‘西卡’柱花草的根系分泌物营养液中生长时,‘热研2 号’柱花草的根长为48.73 mm,分别比自我和‘大叶’柱花草根系分泌物处理下显著增加了26.80%和10.76% (P<0.05),但与‘细茎’、‘有钩’柱花草根系分泌物处理间无显著差异。
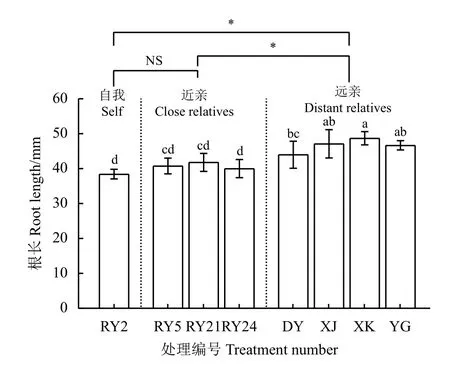
图2 不同亲缘植物根系分泌物对‘热研2 号’柱花草根长的影响Figure 2 Effects of root exudates from different relatives on root length of Stylosanthes guianensis ‘Reyan No. 2’
2.2.2 不同亲缘植物根系分泌物对侧根数量的影响
近亲处理组的平均侧根数量为3.61,远亲处理组的平均侧根数量为4.89,分别比自我处理组显著增加了2.50 和3.75 倍(P< 0.05),近亲处理组与远亲处理组的平均侧根数量之间无显著差异(P> 0.05)(图3)。除‘热研21 号’和‘大叶’柱花草根系分泌物对‘热研2 号’柱花草的侧根数量无显著影响(P>0.05)外,其他亲缘柱花草的根系分泌物处理均使其侧根数量显著增加(P< 0.05),其中‘西卡’、‘有钩’、‘热研24 号’柱花草根系分泌物营养液处理的侧根数量分别比自我处理增加了6.00、4.33 和3.17 倍。
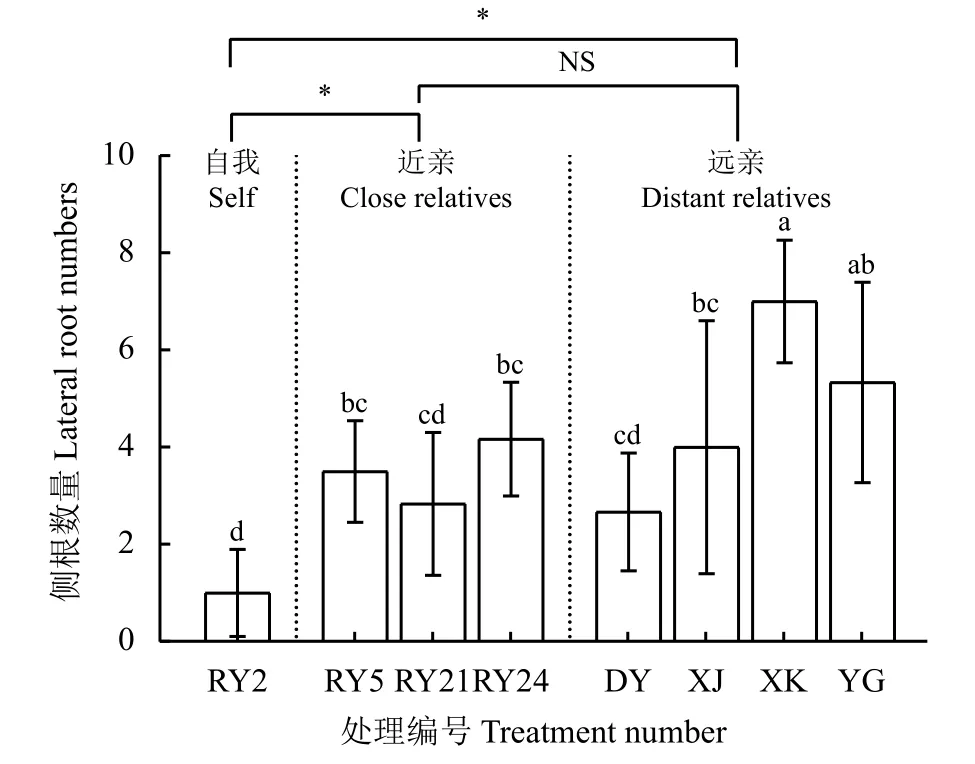
图3 不同亲缘植物根系分泌物对‘热研2 号’柱花草侧根数量的影响Figure 3 Effects of root exudates from different relatives on lateral root numbers of Stylosanthes guianensis ‘Reyan No. 2’
2.3 不同亲缘植物根系分泌物对‘热研2 号’柱花草生物量积累和分配的影响
2.3.1 不同亲缘植物根系分泌物对生物量的影响
近亲处理组的平均总生物量(32.95 mg)、平均茎叶生物量(29.73 mg)和平均根生物量(3.22 mg)分别比自我处理组显著增加了15.38%、13.13%和41.85%(P< 0.05),远亲处理组的平均总生物量(31.69 mg)和平均根生物量(3.14 mg)比自我处理组分别显著增加了11.00%和38.33% (P< 0.05);远亲处理组和近亲处理组的各平均生物量之间均无显著差异(P>0.05) (图4)。

图4 不同亲缘植物根系分泌物对‘热研2 号’柱花草生物量的影响Figure 4 Effects of root exudates from different relatives on the biomass of Stylosanthes guianensis ‘Reyan No. 2’
‘热研5 号’和‘大叶’柱花草根系分泌物处理下,‘热研2 号’柱花草的茎叶生物量比自我处理显著增加了24.73%和18.42% (P< 0.05),但‘热研21 号’、‘热研24 号’、‘细茎’、‘西卡’和‘有钩’柱花草的根系分泌物对其茎叶生物量无显著影响(P> 0.05)。除‘热研5 号’柱花草之外,其他亲缘柱花草根系分泌物处理下,‘热研2 号’柱花草的根生物量均比自我处理显著增加(P< 0.05),其中在‘热研24 号’柱花草根系分泌物处理下达4.15 mg,增长了82.82%,‘细茎’柱花草根系分泌物处理次之(49.78%)。
2.3.2 不同亲缘植物根系分泌物对根冠比的影响
远亲处理组的平均根冠比(0.11 : 1)比自我处理组显著增加了29.14% (P< 0.05),近亲处理组的平均根冠比与自我处理组间无显著差异(P> 0.05) (图5)。除‘热研5 号’和‘大叶’柱花草根系分泌物处理对‘热研2 号’柱花草的根冠比无显著影响(P> 0.05)外,其他亲缘植物的根系分泌物处理均使‘热研2 号’柱花草的根冠比显著增大(P< 0.05),其中‘热研24 号’柱花草根系分泌物处理的增长率最大,达74.42%,‘细茎’柱花草根系分泌物处理次之(47.67%)。
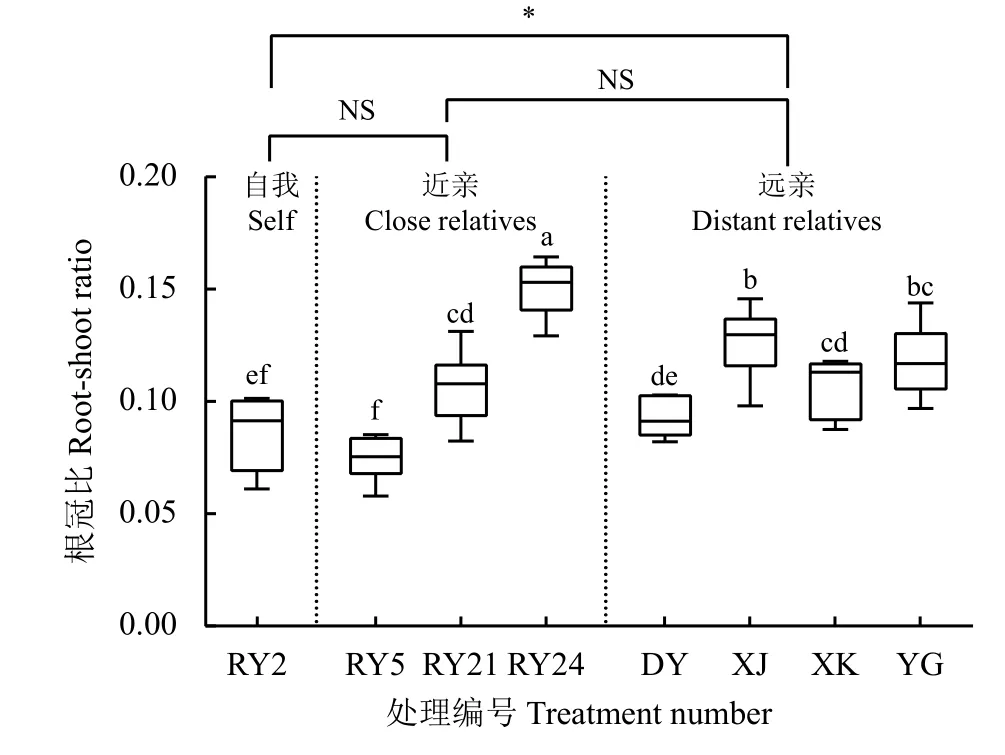
图5 不同亲缘植物根系分泌物对‘热研2 号’柱花草根冠比的影响Figure 5 Effects of root exudates from different relatives on root-shoot ratio of Stylosanthes guianensis ‘Reyan No. 2’
2.4 综合分析
为准确评判‘热研2 号’柱花草对不同种/品种柱花草的亲缘识别能力大小,采用灰色关联法对‘热研2 号’柱花草在不同亲缘植物根系分泌物处理下的生长响应进行了综合量化分析。首先将7 个指标(株高、根长、侧根数量、总生物量、根生物量、茎叶生物量和根冠比)进行无量纲化处理,然后以‘热研2 号’自我处理的对应指标作为“参考值”(母序列),分辨系数取0.5,计算7 个亲缘柱花草与‘热研2 号’柱花草的关联关系(关联度)。通过灰色关联度得出,‘热研21 号’柱花草的关联度最高(0.689),其次是‘热研5 号’柱 花 草(0.688),‘有 钩’柱 花 草 的 关 联 度 最 低(0.524),‘热研24 号’柱花草的关联度居于倒数第2 位(0.567) (表2)。
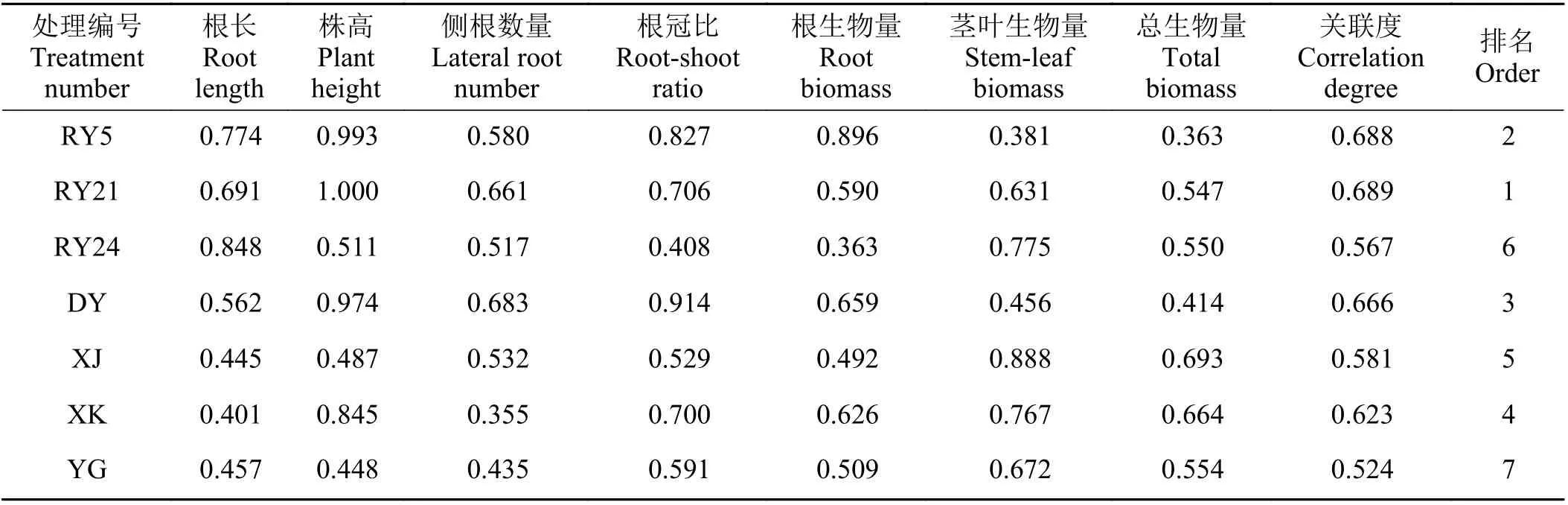
表2 各指标的灰色关联系数及关联度Table 2 Grey correlation coefficients and correlation degrees from each index
3 讨论与结论
动物主要依靠个体间血缘关系的远近来界定亲缘关系,但植物由于无性繁殖和自体受精导致种群的相似度较高,亲缘关系的界定比动物更为复杂。经过人为驯化培育而成的植物品种高度纯化,品种内的个体间没有亲属和非亲属差异,其亲属识别只能发生在近缘品种之间[3]。本研究结果与目前对植物亲缘识别生长响应的研究结论基本一致,即植物与近亲植物共存时植株间的生长影响相对较小,与远亲植物共存时植株间的生长影响相对激烈[24],但同一处理组内各柱花草品种/种根系分泌物对‘热研2 号’柱花草幼苗生长的影响情况并不完全一致。由生长影响情况得到的4 种远缘亲属与‘热研2 号’柱花草的亲缘距离为‘有钩’ > ‘细茎’ > ‘西卡’ > ‘大叶’,这一结论与苏庆祥[25]的‘大叶’、‘细茎’和圭亚那柱花草为遗传关系较近的同一类型,‘有钩’和‘西卡’柱花草分别属于其他类型的结论不吻合,原因可能是现有的柱花草遗传关系和亲缘关系的研究结果存在争议,需要对各种质的遗传关系进行进一步分析;在试验过程中,对1/2 Hoagland 营养液只进行了量的补充,没有精细考虑每种柱花草对其养分吸收的差异,影响了试验结果,后续还将对其进行验证。3 种近缘亲属中‘热研24 号’与‘热研2 号’柱花草的关联程度较差,原因可能在于‘热研24 号’柱花草是‘热研2 号’柱花草经太空诱变育成的品种[26],其基因型已经发生了显著变化。‘热研5 号’、‘热研21 号’与‘热研2 号’柱花草关联紧密,特别是‘热研5 号’柱花草根系分泌物处理使其茎叶生物量显著增加。由此可推测出,在生产中将亲缘关系相近的‘热研5 号’、‘热研21 号’与‘热研2 号’柱花草混播可以减少竞争消耗,从而提高牧草产量。
现有植物亲属识别研究主要表现为调整生长、繁殖和防御策略[3]。本试验仅对生长调整情况进行了研究,具体生长指标的变化规律与其他植物的相关研究结果并不完全一致。如:近亲处理对‘热研2 号’柱花草的株高无显著影响,远亲处理使其株高显著降低。裂叶牵牛(Pharbitis nil)的株高在近亲伴生时也无显著变化,在远亲伴生时却显著增加[5];硬粒小麦(Triticum turgidum)的株高与伴生邻居的亲缘远近无依赖关系[27]。远亲处理使‘热研2 号’柱花草的根长和侧根数量均显著增加,近亲处理对其根长无影响。这种变化与美洲海滩芥(Cakile edentula)[6]、大豆(Glycine max)[28]、拟南芥(Arabidopsis thaliana)[29]等的亲缘响应情况基本一致,与盐草(Distichlis spicata)[30]的亲缘响应规律相反。远亲处理显著增加‘热研2 号’柱花草的根生物量和根冠比,近亲处理下的根冠比无显著变化,茎叶生物量和根生物量均显著增大。伴生植物亲缘远近对盐草的生物量和根冠比均无影响[30],但远亲伴生使水稻(Oryza sativa)的根生物量增加而不影响其茎生物量[31]。说明植物的亲缘识别与响应机制非常复杂,根系分泌物诱导的身份识别反应虽然避免了邻居存在产生其他信号的干扰[22,30],但摒除了根系分泌物在土壤中的变化对响应情况的影响,也缺少对植物生理响应情况和整个生命周期相关指标的研究与分析。因此,在柱花草的亲缘识别研究方面还需要对其土培条件下的响应情况进行进一步的研究,但由此却可以推测亲缘识别是柱花草与其邻近植物竞争和相互作用的重要机制。
综上,‘热研2 号’柱花草在近亲处理组中的株高、根长和根冠比与自我处理间无显著差异,总生物量和茎叶生物量显著增加,而远亲处理组的株高显著降低,根长、侧根数量、根生物量和根冠比均显著增加。这些指标的变化表明,‘热研2 号’柱花草能通过根系分泌物识别出亲缘关系的远近,从而与近亲间的竞争相对较弱,与远亲间的竞争较为激烈。因此,利用亲缘识别效应选择柱花草品种组合混播是提高牧草产量的可能途径。
