不同脂肪源对克氏原螯虾生长性能与肠道菌群的影响
2024-02-01王超男郭睿婕曹鑫盛李辉廷莫翠琴
王超男,黄 凯,郭睿婕,于 凯,曹鑫盛,李辉廷,莫翠琴
(1.广西大学动物科学技术学院,南宁 530004;2.天津赞兰科技有限公司,天津 300000)
克氏原螯虾(Procambarusclarkii),俗称小龙虾、淡水龙虾,其分类属甲壳纲(Crustacea)十足目(Decapoda)螯虾科(Cambarus)原螯虾属(Procambarus),是淡水杂食性虾类。自二十世纪三十年代被引入中国后[1,2],其凭借超高的繁殖力和适应力、丰富的营养品质,已成为中国最重要的经济水产养殖产品。
甲壳类动物需要某些必要的脂质来参与其蜕皮、生长、生殖和代谢功能等生命活动[3,4],如摄入不适宜脂肪会引起其生理、生化功能的紊乱进而导致器官的病变[5-7]。水生动物食物成分的变化可以改变其肠道微生物群[8],李秀玲等[9]研究发现不同脂肪源对卵形鲳鲹(Trachinotusovatus)肠道微生物多样性具有显著影响,也有研究表明不同脂肪酸组成的脂肪源会影响凡纳滨对虾(Litopenaeusvannamei)肠道菌群的组成[10]。而肠道微生物会参与哺乳动物的脂质代谢[11-13],对斑马鱼(Daniorerio)肠道脂肪酸的吸收和代谢具有调节作用[14],并且不同的菌群对脂滴的形成也有不同的影响。同时肠道微生物群落对虾类的健康至关重要[15],在正常生理状况下,肠道微生物之间通过相互作用维持着动态平衡,可以帮助宿主促进营养吸收,刺激免疫反应和提高疾病抵抗力。
目前,关于克氏原螯虾适宜脂肪源的研究报道和脂肪源对克氏原螯虾肠道菌群影响的研究较少。根据脂质对甲壳动物的重要性与肠道菌群与脂质之间交错的关系[14-16],本实验通过投喂不同脂肪源的饲料,研究其对克氏原螯虾生长性能、肝胰腺组织学和肠道菌群的影响,以期为克氏原螯虾的饲料脂肪源优化与健康养殖提供科学理论依据。
1 材料与方法
1.1 实验饲料
分别以豆油(SO)、鱼油(FO)、猪油(LO)和混合油(豆油∶鱼油=1∶1,MO)为脂肪源配制四种等氮等脂的实验饲料。具体方法:按比例加入经粉碎且过 80 目筛后的主要原料,再分别加入上述脂肪源和适量水在搅拌机中充分混合,用小型绞肉机制成直径3 mm,长度5 mm 的颗粒饲料,经风干后置于-20 ℃冰箱中备用,其配方如表1。

表1 饲料组成及营养水平Tab.1 Composition and nutrient levels of experimental diets %
1.2 实验用虾及饲养管理
克氏原螯虾苗均由本实验组在广西大学水产养殖基地饲养、繁育获得。在驯饵池暂养7 d后,从中挑选480尾30~40日龄、规格一致(4.00±1.00)g、健康无残缺的克氏原螯虾仔虾,随机分配至4个实验组的养殖池(1 m× 1 m× 0.6 m)中,每个实验组设置3个重复组,每个重复组40尾虾,暂养驯饵池及实验养殖池内均用不锈钢条及尼龙绳悬挂若干二指网眼尼龙网供其攀爬,并且通过遮阳网、加热棒及增氧机等器材稳定环境和水质状况[溶解氧(3.52±0.46)mg/L、水温(27.68±2.63)℃、亚硝酸盐≤0.5 mg/L]。养殖期间分别于每日06∶00及19∶30投喂两次,表观饱食投喂。每日初次投喂前用吸污机去除池内粪便、残饵并清除死虾残骸。每2 d换水1次,换水量为池高的1/3。每日观察并记录虾死亡数目、摄食状态等,及时记录摄食及死亡状况,养殖周期为60 d。
1.3 样品采集与测量
1.3.1 样品采集
取样前24 h停止投喂,每平行组随机取10尾克氏原螯虾,进行计数、称重,并计算各生长指标。抽取血液置于1.5 mL离心管中,4 ℃静置过夜后离心(4 ℃,4 000 r/min,10 min)取上清,-80 ℃保存,用于血清生化指标分析;无菌条件下剖取其胃部、肠道液氮速冻后-80 ℃保存备用,用于生理生化指标的测定;同时取肝胰脏,部分拍照后放于Bouin氏固定液保存,部分液氮速冻后-80 ℃保存,分别用于组织染色分析和生化指标测定。每平行组另随机取10尾克氏原螯虾,于无菌环境下拧动克氏原螯虾尾扇直接将肠道拔出置于5 mL灭菌离心管内,随后将3个重复组样本1∶1∶1混合后作为每大组样品,进行肠道菌群检测。
1.3.2 生长指标相关计算公式
存活率(SR)=Nf/Ni×100%;
特定生长率(SGR)=(lnWf-lnWi)/t×100%;
饲料系数(FCR)=W/(Wf-Wi)。
式中,Nf为实验结束时实验用虾尾数;Ni为实验开始时实验用虾尾数;t为实验天数;W为实验饲料总投喂量;Wf为实验结束时实验用虾总质量;Wi为实验开始时实验用虾总质量。
1.3.3 组织学切片制作与观察
肝胰脏组织标本固定24 h,经过水洗、脱水、透明、石蜡包埋等步骤后,制作5 μm厚的连续切片,HE染色。使用软件“Image-pro plus 6.0(Media Cybernetics,Inc.,Rockville,MD,USA)”使用吸管工具手动取色,分别测量区域白色脂肪空泡像素面积(H∶0-30;S、I∶0-255),计算出组织像素面积,求出脂肪空泡率(脂肪空泡面积比例)。
脂肪空泡率=A1/A2×100%
式中,A1为脂肪空泡像素面积;A2为组织像素面积。
1.3.4 生化指标测定
将胃、肝胰脏与肠道等组织用生理盐水按重量体积比,在冰水浴条件下制备成组织匀浆液;离心取上清后,按照各自试剂盒(南京建成生物工程研究所)中说明书所描述的方法,分别对胃部的胃蛋白酶(PPS)、肠道的淀粉酶(AMY)与肝胰脏的脂肪酶(LPS)、谷丙转氨酶(GPT)和谷草转氨酶(GOT)等指标进行测定。将血清样品同样按照南京建成生物工程研究所试剂盒中说明书分别测定总蛋白(TP)、总胆固醇(CHO)和甘油三酯(TG)等指标。
1.4 肠道菌群检测
采用16S rDNA 法对肠道微生物组成进行测定,首先根据QIAamp Fast DNA Stool Mini Kit试剂盒说明书方法进行总菌群DNA提取纯化,并对16S rRNA基因V3-V4区进行扩增,引物为:GTACTCCTACGGGAGGCAGCA和GTGGACTACHVGGGTWTCTAAT,热反应条件为94 ℃变性4 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s的30个循环;最后在72 ℃下延长7 min。PCR 产物使用 1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP 核酸纯化试剂盒纯化,使用购自赛默飞公司的胶回收试剂盒对目的条带电泳后的产物进行回收。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq 6000进行上机测序。使用软件USEARCH v7对经过严格过滤处理得到最终的有效数据进行聚类,默认以97%的一致性将序列聚类成为OTU(Operational Taxonomic Units)。经过降噪与物种注释分析获得分类学信息并分别在各个分类水平统计各样本的群落组成,均一化处理后使用Qiime软件(Version 1.9.1)计算覆盖率、chao指数、observed_sPecies指数、香浓指数、辛普森指数。
1.5 数据处理与统计
实验数据均用SPSS 26.0软件统计分析,采用单因素方差分析(one-way ANOVA)与Duncan’s多重检验进行比较,所有数据值均由平均值±标准差(mean±SD)表示,P<0.05表示差异显著。
2 结果
2.1 不同饲料脂肪源对克氏原螯虾生长指标的影响
表2结果表明,MO组存活率显著高于其他三组,特定生长率显著高于FO组与LO组,与SO组差异不显著;而LO组存活率与特定生长率均显著低于其他组;其他指标未呈现显著性差异。综合来看MO组终末体质量、存活率、特定生长率最高,LO组终末体质量、存活率、特定生长率最低。饲料系数则相反,LO组最高(1.50),MO组最低(1.37)。
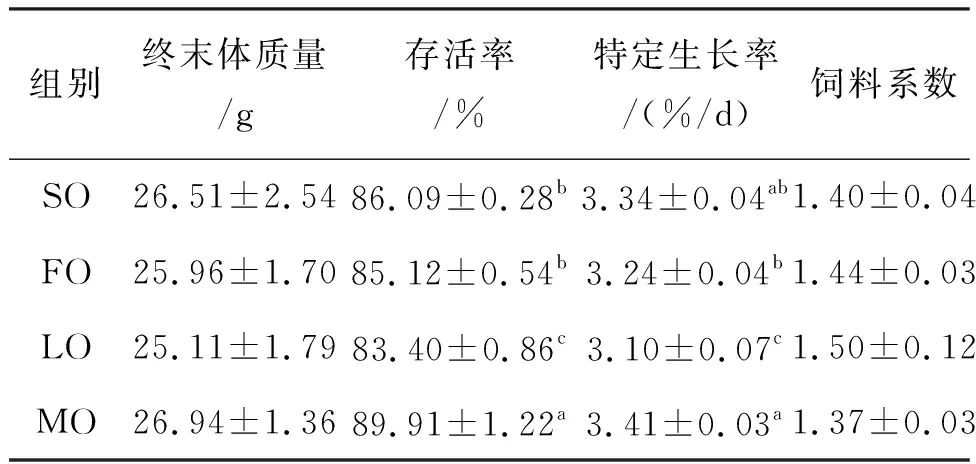
表2 饲料脂肪源对克氏原螯虾生长性能的影响Tab.2 The influence of feed lipid source on growth peformance of P.clarkia
2.2 饲料脂肪源对克氏原螯虾消化酶活性及营养代谢指标的影响
不同饲料脂肪源对克氏原螯虾消化酶活性指标的影响如表3。仅LO组LPS显著高于其他三组,其他三组间LPS无显著差异;PPS与AMY则在组间差异不显著。
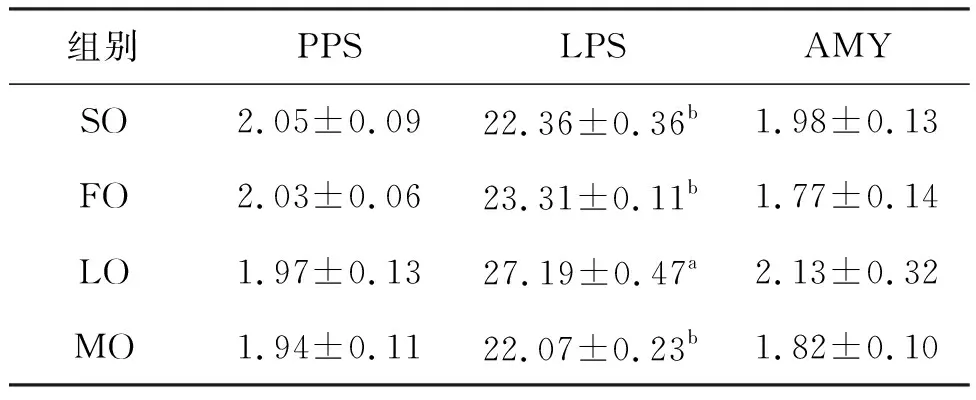
表3 饲料脂肪源对克氏原螯虾消化酶活性的影响Tab.3 Effects of dietary lipid sources on digestive enzyme activities of P.clarkia U/mg
营养代谢指标如表4,CHO、GPT、GOP均呈现LO组显著高于其他三组的情况;TP与TG则在组间均无显著性差异,但是也呈现LO组最高的情况。
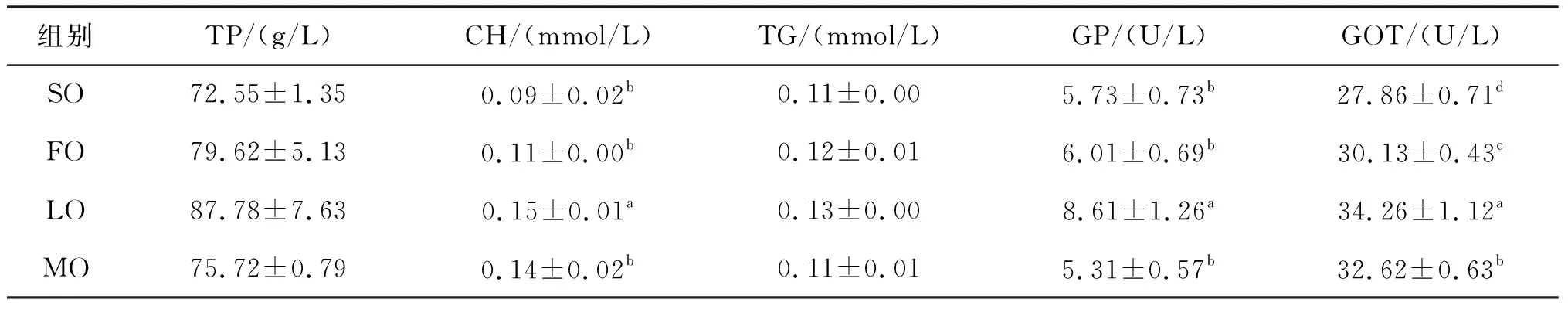
表4 饲料脂肪源对克氏原螯虾营养代谢指标的影响Tab.4 Effects of dietary lipid sources on nutritional and metabolic indexes of P.clarkia
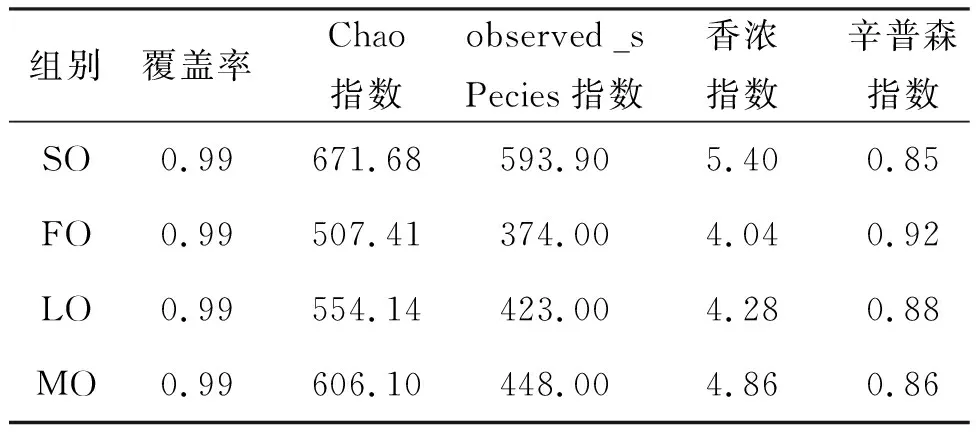
表5 Alpha多样性指数统计表Tab.5 Statistical table of Alpha diversity index
2.3 脂肪源对肝胰腺组织学的影响
四种不同脂肪源对克氏原螯虾肝胰脏组织的影响见图1。SO组与FO组肝胰脏结构和细胞形态差异不明显,脂肪空泡比例分别为(51.76±2.23)%与(52.67±4.83)%,差异不显著;MO组脂肪空泡总面积略多于SO组和FO组,但脂肪空泡率为(53.88±1.43)%,与SO组和FO组差异不显著,且肝小管结构更为丰满;LO组脂肪空泡总面积和单个脂肪空泡面积在四组中最大,脂肪空泡率为(66.86±3.68)%,显著高于其他组,且肝胰脏沉积脂肪最多。
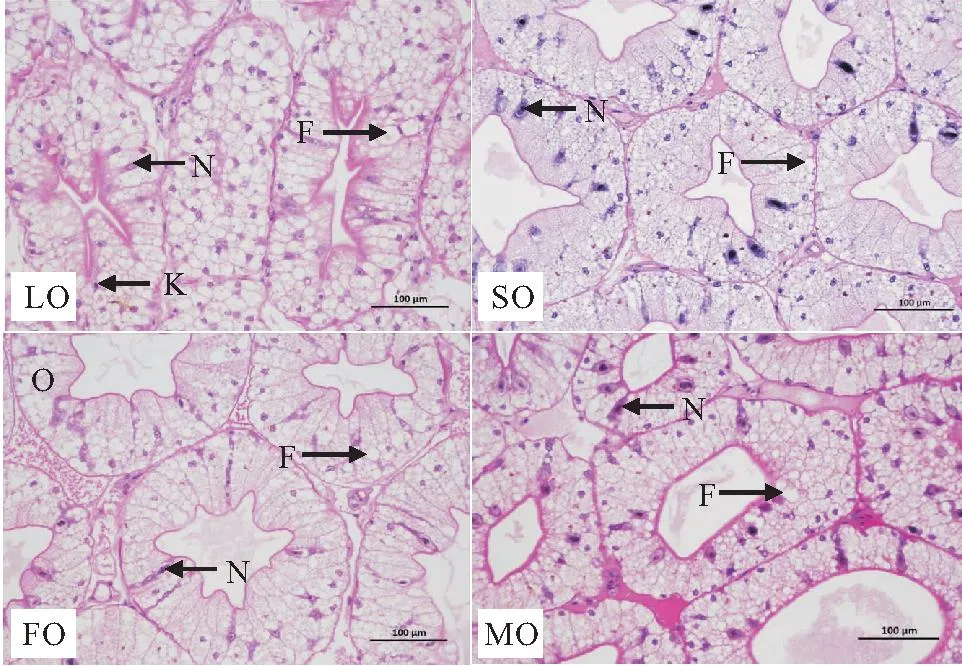
图1 饲料不同脂肪源小龙虾的肝胰脏组织学观察Fig.1 Observation of the histology of hepatopancreas1.LO组:示细胞核、脂肪空泡、核固缩,倍数200,标尺=100 μm;2.SO、FO、MO组:示细胞核、脂肪空泡,倍数200,标尺=100 μm;3.N:细胞核;F:脂肪空泡;K:核固缩
2.4 饲料脂肪源对克氏原螯虾肠道菌群的影响
2.4.1 多样性分析
用Alpha多样性指数分析克氏原螯虾肠道菌群多样性的差异,如表6所示覆盖率均在99%,表明微生物种类基本覆盖,测序结果可代表克氏原螯虾肠道菌群的真实情况。其中SO组chao指数、observed_sPecies指数、香浓指数最高,其次是MO组,说明SO组物种丰富度和多样性最高,其次是MO组。
同时基于各组OTU值绘制的韦恩图(图2)显示,各组样品共有OTU数目为150,占OTU总数的18.5%,说明不同脂肪源对克氏原螯虾肠道菌群多样性影响较大。LO组、FO组、SO组、MO组分别特有的OTU数目为444、224、273、298,LO组特有的OTU数显著高于另外三组,说明LO组的肠道菌群最复杂。
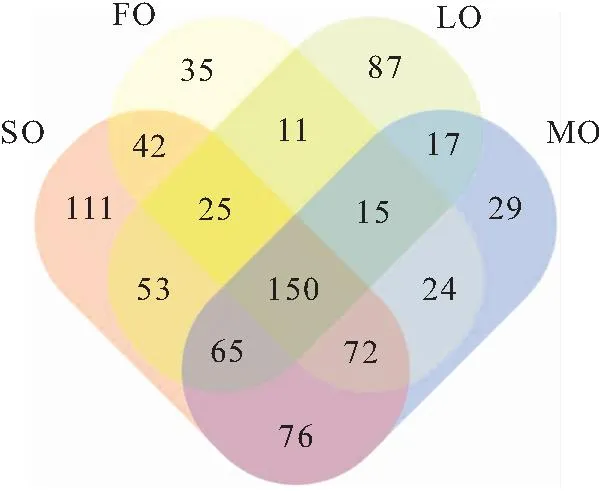
图2 各实验组OTU数目韦恩图Fig.2 Venn diagram of the number of OTU in each group
2.4.2 门分类水平上的菌群组成
4个组在门的水平上共检查到19个菌门,其中13门为4组共有。选取四个组在门(Phylum)水平上的共有门类最大丰度排名前7的门类,绘制物种相对丰度堆积柱形图(图3)。结果表明,实验组克氏原螯虾肠道主要菌群为:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、RsaHf231门、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)。但是各组间同菌门相对丰度存在显著差异。SO组变形菌门丰度为其他三组的4倍左右;拟杆菌门丰度在LO组最大,是SO组的4倍多,FO组和MO组的2倍左右;厚壁菌门丰度SO∶FO∶LO∶MO为20∶29∶17∶30。
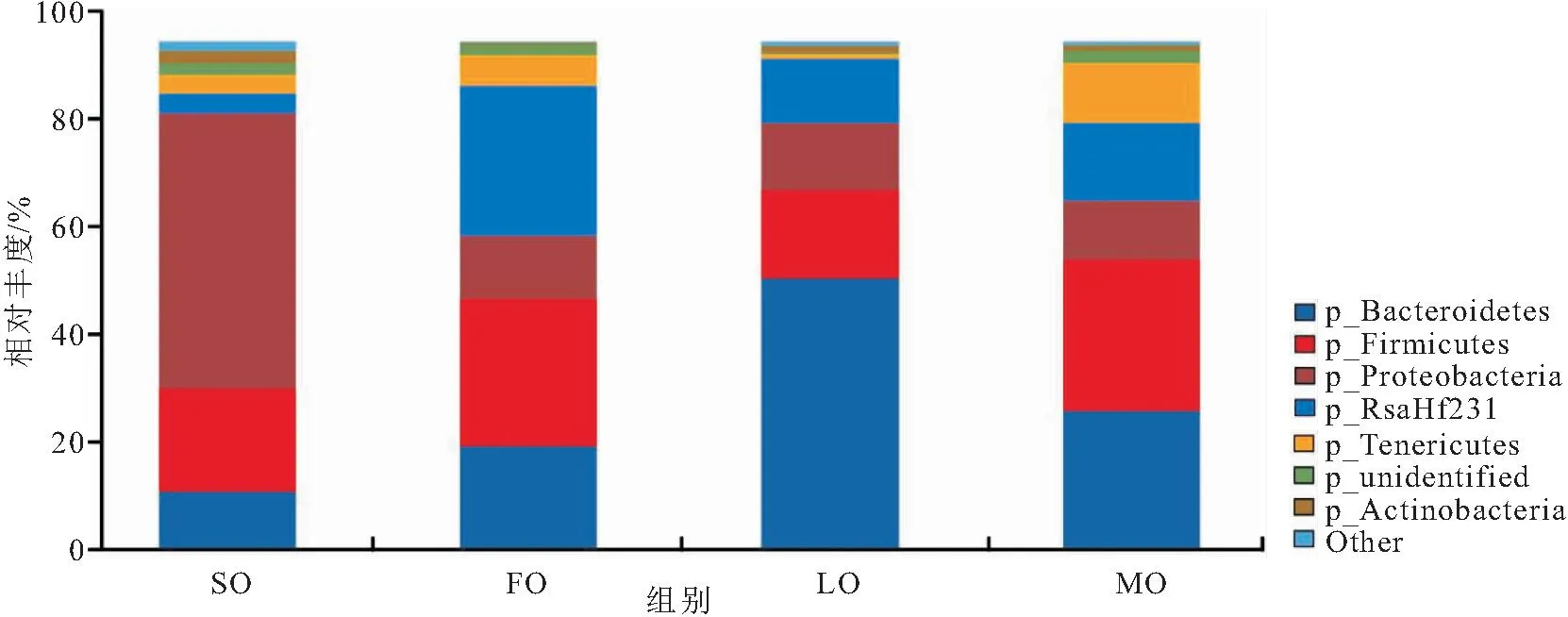
图3 门水平上物种相对丰度堆积柱状图Fig.3 Histogram of relative abundance accumulation at Phylum level
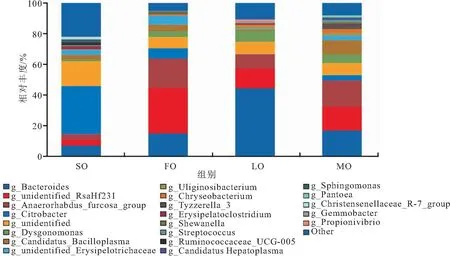
图4 属水平上物种相对丰度堆积柱形图Fig.4 The column diagram of relative abundance accumulation on Genus level
2.4.3 在属水平上的菌群组成
通过高通量测序,测得4组克氏原螯虾肠道菌群属水平上的分类共有341属,其中四组共有菌属99属,SO组特有属32属,FO组属特有10属,LO组属特有23属,MO组属特有4属。
各组共有优势菌属(丰度>5%,下同)只有拟杆菌属(Bacteroides),在LO组占比最大为44.40%,是SO组的6倍左右,是FO与MO组的近3倍;未知的RsaHf231与Anaerorhabdus_furcosa_group属是FO组、LO组与MO组共有的优势菌属,占比分别为29.67%、12.75%、15.44%与19.27%、9.26%、17.26%。
柠檬酸杆菌属(Citrobacter)仅为SO组与FO组的优势菌群,且SO组丰度为FO组的近5倍;Dysgonomonas仅为FO与MO组的优势菌群,占比分别为7.28%、5.62%;FO组特有一个丹毒丝菌属(unidentifiedErysipelotrichaceae)占6.03%;MO组特有一个Candidatus_Bacilloplasma占9.72%。
3 讨论
3.1 不同脂肪源对克氏原螯虾生长性能的影响
本实验研究发现,饲料中添加不同脂肪源对克氏原螯虾存活率与特定生长率均有影响。已有研究表明,饲料中添加不同脂肪源可以影响饲料中各类脂肪酸的比例,进而影响虾类的生长和健康[4,16]。本实验中LO组在四个实验组中生长状况最差,饲料系数最高,和WU等[17]研究结果相似,ZHOU等[18]对凡纳滨幼虾的研究中也发现猪油组生长性能最差。推测可能是由于猪油缺乏长链多不饱和脂肪酸(LC-PUFA)和必需脂肪酸(EFA),不能满足克氏原螯虾生长营养需要,而且其饱和脂肪酸比例过高,导致其饲料利用率较差[19]。MO组在本实验中生长性能最好,推测是因为其中鱼油的含量已经足以提供克氏原螯虾生长所需的EPA与DHA,而其中的豆油另外提供了亚油酸(LOA)促进克氏原螯虾的生长[20]。而且虾类在其生长发育过程中有进行食性转变的特点,同样也会导致其营养需求变化[21]。本实验结果证明将动物性与植物性脂肪源进行搭配会具有协同效应,更能满足克氏原螯虾生长需要,但是其最佳脂肪源配比仍有待进一步的研究。
3.2 不同脂肪源对克氏原螯虾营养代谢的影响
消化酶影响着水生生物对营养物质的消化能力,同时也影响其自身的生长性能[22]。饲料的营养结构是影响甲壳类动物消化酶活性的重要因素,鲁耀鹏等[23]的实验研究中也指出,不同脂肪源对红螯螯虾(Cheraxquadricarinatus)和中华绒螯蟹(Eriocheirsinensis)消化酶活力均有直接影响。本实验结果显示(表3),克氏原螯虾三项消化酶指标中仅脂肪酶活性在组间差异显著,说明豆油、鱼油与猪油对蛋白酶和淀粉酶的影响有限,而脂肪酶活性可能受SFA的影响更大,而且图1、表4表明LO组克氏原螯虾肝胰脏组织切片脂肪空泡率显著高于其他实验组,营养代谢指标也均呈现LO组最高的情况,说明克氏原螯虾对高饱和度脂肪难以消化、吸收和利用,所以LO组肝胰脏产生更多的脂肪酶用于消化,并且过度的高饱和脂肪还造成肝胰脏脂肪堆积进而引起病变和肝细胞损伤,TCHO、GPT、GOT、TG由肝细胞中进入体液循环,机体产生更多TP用以修复肝脏损伤,引起各项指标测定值上升。
3.3 不同脂肪源对克氏原螯虾肠道菌群的影响
本实验分析发现,在门水平上,实验组主要肠道菌群为变形菌门、厚壁菌门、拟杆菌门、RsaHf231门、软壁菌门、放线菌门,和其他学者对甲壳类物种的研究结果相似[25-27],但是本实验各组菌群结构差别明显。在本实验中,4组饲料除脂肪源种类不同外其他原料组成都是相同的,因此脂肪源种类是决定菌群结构的主要因素。
变形菌门是多种水产动物如大黄鱼(Larimichthyscrocea)、中华绒螯蟹、凡纳滨对虾等肠道中的优势菌群[28],在陈一铭等[28]、谢梦琪等[29]对克氏原螯虾肠道菌群的研究中均发现变形菌门为最大优势菌群,而在本实验中,只有SO组变形菌门占比最大;不过本实验LO组、FO组、MO组中变形菌门所占比例与王飞飞等[30]的研究结果相似。目前在甲壳动物研究上,还未明确指出变形菌门在甲壳动物的作用,但在张立强等[31]对健康和患病克氏原螯虾肠道微生物群落结构和多样性分析中表明患病克氏原螯虾肠道微生物中变形菌门的占比显著上升。有研究指出:肠道中变形菌门的大量繁殖反映了生态失调或不稳定的肠道微生物群落结构[32],且该门丰度过高易导致消化吸收紊乱[33]。此外有研究表明,当变形菌门所占比例适宜,它们看起来就会是良性的,而当在某些肠道环境下时,它们就会成为可引发炎症反应的微生物[32]。所以变形菌门丰度过高,可能有很大的患病隐患。
拟杆菌的主要功能是帮助宿主降解碳水化合物(尤其是多糖)、蛋白质和其他物质,可以参与到胆汁酸以及类固醇的代谢中,以提高宿主的营养利用率。LO组拟杆菌门为最大优势菌门,占比达到了53.82%,同时也是四组中拟杆菌门丰度最多的一组,推测可能与LO组总胆固醇在四组中最高有关。厚壁菌有助于膳食纤维的降解,并将纤维降解为挥发性脂肪酸以供宿主利用。而且拟杆菌与厚壁菌之间存在着一种相互促进的共生关系,它们共同促进宿主吸收或储存能量,其比值的变化会影响机体内肠道菌群的代谢潜力[29]。而四组中LO组的生长性能最差,同时其拟杆菌门与厚壁菌门的比例与其他三组差别最大,推测厚壁菌门与拟杆菌门的比例,很有可能是影响生长性能的重要因素。软壁菌门对鱼体生长和抑制致病细菌有积极作用,四组中只有MO组软壁菌门丰度在10%以上。
在属水平上,四个组共有的拟杆菌属是克氏原螯虾的常驻菌群。研究发现,许多拟杆菌属可影响纤维素晶体和木质纤维素的降解[34];还有研究表明,拟杆菌属(Bacteroides)可通过分泌三磷酸肌醇(inositol triphosphate,IP3)诱导组蛋白脱乙酰基酶3(histone deacetylase 3,HDAC3)的表达,介导肠道上皮对脂质的吸收和代谢[35];也有研究表明拟杆菌还有助于增强机体免疫力[36]。
未知的RsaHf231菌属和Anaerorhabdus_furcosa_group属是除了SO组外其他三组的优势菌群,目前在水生生物方向,还未见有关于这两种菌属生物学作用研究的相关报道,但在大多数水生动物肠道内都提取到Anaerorhabdus_furcosa_group属[37],在不同地区的健康甲壳类动物体内也同样提取到此菌属;而未知的RsaHf231菌属则常见于海螺(Hermetiaillucens)、大西洋鲑(Salmosalar)和小龙虾(P.clarkii)[26],在其他物种中的相关报道较少;因此未知的RsaHf231属与Anaerorhabdus_furcosa_group属应为健康克氏原螯虾常见菌属[38-40]。柠檬酸杆菌属(Citrobacter)是SO组与FO组的优势菌群,沈锦玉等[41]研究表明弗氏柠檬酸杆菌是红螯螯虾的致病菌,且毒力很强;肖宁等[42]的实验确定弗氏柠檬酸杆菌是引发克氏原螯虾暴发性疾病的病原,目前已有柠檬酸杆菌感染中华鳖(Trionyxsinensis)、棘胸蛙(Quasipaaspinosa)和青鱼(Mylopharyngodonpiceus)等引发疾病的报道[43]。本实验中柠檬酸杆菌属是SO组的最大优势菌属,占比31.31%,说明SO组具有极大的患病风险。虽然柠檬酸杆菌属在FO组也是优势菌属,但是占比只有6.74%。
Candidatus_Bacilloplasma是MO组优势菌群,已在中华绒螯蟹[44]、红螯螯虾[45]、龙虾[46]和斑节对虾((P.monodan)[47]等多种甲壳动物肠道中发现,虽然该菌群的作用目前尚未阐明,但是在陈一铭等[28]的研究中其在甲壳动物肠道中的丰度在白斑综合症病毒感染后急剧下降,推测其对甲壳动物的健康有着重要的作用。在GONG等[48]的研究中Candidatus_Bacilloplasma也是健康克氏原螯虾的优势菌群且其丰度与患病虾存在极显著差异。
