湖南烟草弯孢菌叶斑病和炭疽病病原鉴定及生物学特性研究
2024-01-30肖艳松李思军吴文信刘天波周向平
肖艳松,李思军,吴文信,刘天波,周向平,黎 萍,钟 杰*
湖南烟草弯孢菌叶斑病和炭疽病病原鉴定及生物学特性研究
肖艳松1,李思军2,吴文信2,刘天波3*,周向平4,黎 萍5,钟 杰5*
(1.湖南省烟草公司郴州市公司,湖南 郴州 423000;2.湖南省烟草公司郴州市公司桂阳县公司,湖南 郴州 424400;3.湖南省烟草科学研究所,长沙 410004;4.湖南省烟草公司永州市公司,湖南 永州 425000;5.湖南农业大学植物保护学院,长沙 410128)
2020年到2023年,在湖南省郴州市的烟草上发现了类似弯孢菌叶斑病和炭疽病的两种叶部病害,为了明确引起该病害的病原种类及生物学特性,本研究利用组织分离法对病叶进行分离纯化,形态学观察和柯赫氏法则验证,并对其生物学特性进行研究。结合形态学及rDNA内转录间隔区(ITS)的进化分析,确定烟草弯孢菌叶斑病病原为车轴草弯孢菌;利用ITS及肌蛋白(ACT)、微管蛋白(TUB)、几丁质合成酶(CHS-1)和甘油醛-3-磷酸脱氢酶(GPDH)多基因的系统进化分析,确定烟草炭疽病病原为喀斯特炭疽菌。生物学特性研究表明,车轴草弯孢菌菌丝生长最适温度为25 ℃,最适pH为7,以水溶性淀粉为碳源、牛肉膏为氮源时对菌丝生长最有利;喀斯特炭疽菌菌丝生长最适温度为25 ℃,最适pH为7,以葡萄糖为碳源、牛肉膏为氮源时对菌丝生长最有利。这是湖南省首次在烟草上发现这两种病害,且到目前为止我国尚无喀斯特炭疽菌引起烤烟病害的报道,研究结果可为科学有效防治该类病害提供参考。
车轴草弯孢菌;喀斯特炭疽菌;弯孢菌叶斑病;炭疽病;烟草病原菌
烟草(L.)是我国重要的经济作物,烟叶总产量和总销量都占世界的40%左右[1]。在部分烟区烤烟生长中后期叶斑类病害发生偏重,严重影响烟叶生产[2]。目前已报道的常见叶部病害包括真菌病害炭疽病、赤星病等[3-4],细菌性病害野火病、青枯病等[5-6]以及由TMV、CMV、PVY等引起的烟草病毒病[7]。
弯孢菌属()寄主范围广泛,可引起多种植物叶斑、苗枯等症状[8],危害水稻[9]、玉米[10]、燕麦[11]等多种禾本科植物。由弯孢菌引起的叶斑病新病害在许多作物中相继出现,如由新月弯孢引起的鹧鸪茶叶斑病[12]、由引起的茭白叶斑病[13]以及由引起的红薯叶斑病[14]等,表明弯孢菌属真菌对农业生产的威胁在不断加重。90年代我国首次在广西壮族自治区发现由Tandou et Bilgrami引起的烟草叶斑病[15],2016年CHEN等[16]在贵州省发现了由车轴草弯孢菌引起的烟草叶斑病。
炭疽病是烟草上发生最为普遍的真菌病害之一,在我国主要烟区均有发生,危害严重。2016年在贵州烟田[17]发现由果生炭疽菌引起的烟草炭疽病,2022年在湖南省[18]发现兰花炭疽菌引起烟草炭疽病,其症状表现为水浸状的黄绿色斑点,后变成褐色、合并成大的坏死斑。除了普通烟草,在2018—2019年间,海南省部分雪茄烟种植区发生了由喀斯特炭疽菌引起的严重烟草炭疽病[19]。
2020—2023年间,在对湖南各烟叶生产区进行病害发生情况调查时,发现了类似弯孢菌叶斑病和炭疽病症状的2种叶部病害,通过镜检初步鉴定为弯孢菌和炭疽菌引起的病害。为了明确病害的具体病原,本研究进行了病原菌的分离、纯化、形态学和分子鉴定以及科赫氏法则测定,为掌握该类病害病原菌发生特征,进一步对其生物学特性进行了研究,以期为烟草叶部病害的诊断识别及制定科学防治策略提供依据。
1 材料与方法
1.1 供试材料
病害样品采集自湖南省郴州市桂阳县烟田中烤烟云烟87具有黄褐色坏死病斑的病叶。
1.2 试验方法
1.2.1 病叶采集和病原菌分离 2020—2023年间在湖南郴州烟区桂阳县烟田中发现了2种病斑不同的叶部病害。分别于2020和2022年5月将病叶采集后装入干净的牛皮纸袋中带回实验室。采取常规组织分离法进行病原菌分离[20],剪取病健交界处约5 mm×5 mm的小块叶片组织,用70%的乙醇消毒30 s,1%升汞消毒1 min,最后置于无菌水中漂洗3次,用灭菌滤纸吸干水分后移入PDA平板上(含50 mg/mL链霉素),28 ℃恒温培养3 d。待菌落长出后,从菌落边缘挑取少量菌丝转接至新的PDA培养基上,通过单孢分离进行纯化后置于4 ℃冰箱备用。
1.2.2 病原菌的致病性测定 采用盆栽烟草活体接种方法进行病原菌的致病性测定。将云烟87烟草种子播种于装有灭菌育苗土(基质∶蛭石=1∶1)的小钵中,选取2月龄烟苗进行接种。将不同菌株接种于100 mL马铃薯葡萄糖液体培养基中,于180 r/min,28 ℃的摇床振荡培养5 d。经两层灭菌纱布过滤,然后用无菌水清洗两次,取过滤后的孢子液将浓度调整到106mL-1。将生长良好、长势一致的烟苗叶片用70%酒精浸湿的棉球擦拭进行表面消毒,然后每盆烟草叶面喷洒5 mL各菌株的孢子液进行接种,每盆烟草接种2片叶,每个菌株处理3盆健康烟草。以同样的方法喷洒无菌水作为对照组。将接种后的盆栽烟草植株放置在用酒精消毒的密封接种盒中保湿培养48 h后,置于温室中(光照12 h/d)26 ℃培养,定期观察发病情况,并记录结果。待发病后从病组织处再次分离病原菌,并进行形态学和分子鉴定及科赫氏法则验证。
1.2.3 病原菌菌落及孢子形态观察 将分离纯化的菌株转接于PDA培养基上,28 ℃培养5 d左右,观察菌落形态特征。在光学显微镜下观察病原菌形态特征,记录分生孢子形态、大小。通过诱导分生孢子萌发形成附着胞,观察附着胞形态、大小,对病原菌进行形态学鉴定。
1.2.4 病原菌的分子鉴定 采用CTAB法提取病原菌基因组DNA[21]作为模板,扩增病原菌的rDNA内转录间隔区(ITS)、肌蛋白(ACT)、微管蛋白(TUB)和甘油醛-3-磷酸脱氢酶(GPDH)和几丁质合成酶(CHS-1)基因部分区域[22],并进行序列测定,所用引物如表1所示[3]。扩增反应体系为50 μL,包括:2×Es Taq Master Mix 25 μL、DNA模板2 μL、10 μmol/L上下游引物各2 μL、ddH2O 19 μL。反应条件为:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环;最后72 ℃延伸8 min。PCR产物经1%琼脂糖凝胶电泳检测后,回收目标DNA片段,交由生物工程(上海)股份有限公司测序。将获得的序列提交到NCBI/GenBank获得基因登录号。对各个所测的基因序列用BLASTn在NCBI数据库进行同源性比对。将多基因序列进行合并后,利用MEGA 6软件的邻接法(Neighbor-joining, NJ)构建多基因联合的系统发育树,采用自举法(bootstrap)进行1000次重复检验[23]。
1.3 病原菌生物学特性测定
1.3.1 碳、氮源对病原菌菌丝生长的影响 参照朱俊子等[24]的方法,在基础培养基中加入2%水溶性淀粉、2%蔗糖、2%半乳糖、2%葡萄糖、2%甘油、2%果糖、2%麦芽糖和2%甘露醇制成不同碳源培养基。在基础培养基中加入2%葡萄糖,然后分别加入0.2%酵母浸膏、0.2%蛋白胨、0.2%牛肉膏、0.2%硝酸钠、0.2%氯化铵、0.2%甘氨酸、0.2%酪氨酸和0.2%缬氨酸,制成不同氮源培养基。在培养5 d的代表性病原真菌菌株的菌落边缘打取8 mm菌饼,接种至不同培养基平板中央,于26 ℃恒温下培养5 d后测量菌落直径,计算菌丝生长抑制率。菌丝生长抑制率=(对照菌落直径−处理菌落直径)/对照菌落直径×100%。每处理3个重复。
1.3.2 温度对病原菌菌丝生长的影响 将病原菌在PDA培养基上培养5 d后,在菌落边缘打取8 mm的菌饼接种到PDA平板中央。分别置于5、10、15、20、25、30和35 ℃黑暗培养5 d后,测量菌落直径并计算菌丝生长抑制率,每处理3个重复。
1.3.3 pH对病原菌菌丝生长的影响 以PDA为基础培养基,用HCl和NaOH将PDA培养基pH分别调至4、5、6、7、8、9、10。将菌株菌饼接种至不同pH的PDA平板中央,于26 ℃恒温下培养5 d后测量菌落直径,计算菌丝生长抑制率,每处理3个重复。
1.4 数据分析
采用SPSS 22.0软件对试验数据进行统计分析,应用Duncan氏新复极差法进行显著性检验。
2 结 果
2.1 病害症状特点及病原菌的分离纯化
病害主要发生在烤烟旺长期和成熟期的叶片上。弯孢菌叶斑病最开始在叶片出现褪绿区,随后变成深色坏死斑,随着坏死区域扩大,变成灰色、灰褐色或浅棕色,圆形或椭圆形,边缘深褐色,有少许黄色晕圈包围(图1-A)。选取典型症状叶片进行分离,共获得6个菌落形态相似的菌株,选取Ct-4用于后续研究。炭疽菌叶斑病发生时在叶片上出现小圆点,中心浅灰色,边缘有狭窄的褐色边界,周围有暗绿色晕圈(图1-B)。选取典型症状的烟叶进行组织分离,共获得形态相似的菌株8株,选择Ck-8作进一步鉴定分析。
注:A,第一种叶斑病田间样品症状;B,第二种叶斑病田间样品症状。
Note: A, Symptoms of the first leaf spot disease; B, symptoms of the second leaf spot disease.
图1 烟草叶片病害的田间症状
Fig.1 Field symptoms of tobacco leaf diseases
2.2 病原菌的致病性测定
利用活体接种将菌株Ct-4和Ck-8的孢子悬浮液喷洒于盆栽烟草叶片。接种Ct-4后,烟草叶片上产生水浸状不规则型病斑,病斑中间灰褐色,叶肉变薄腐烂,边缘有黄色晕圈(图2A、B);接种Ck-8的烟草叶片,最开始有黑绿色的小点产生,呈现水渍状,病斑边缘表现为棕色至棕黄褐色,中央灰白色,部分凹陷,后期随着病情的扩展,出现穿孔的现象(图2C、D)。接种清水的对照组烟草未见侵染症状。分别选取接种Ct-4和Ck-8菌株的显症叶片进行病原菌再分离,通过形态学和分子鉴定,确定了重新分离的菌株与接种菌株一致,证明菌株Ct-4和Ck-8分别为各自病害的病原菌。

注:A-B,接种病原菌4 d后烟叶的症状;C-D,接种4 d后烟叶的症状。
Note: A-B, symptoms of the leaves after 4 days of inoculation with the; C-D, symptoms of the leaves after 4 days of inoculation with the
图2 人工接种烟草的症状
Fig. 2 Symptoms of artificially inoculated tobacco
2.3 病原菌形态学鉴定
菌株Ct-4在PDA培养基平板上生长较为缓慢,前期为灰褐色,后转变为红褐色至褐色,菌丝向外扩展,在PDA培养基上可分泌褐色色素(图3-A、B)。分生孢子单生,弯曲,近纺锤形,大多具3个隔膜,中间1~2个细胞膨大,大小为(16.6~27.7)μm×(8.3~13.8)μm,中部颜色略深,两边颜色逐渐变浅(图3-C)。
菌株Ck-8菌丝灰白色,边缘整齐、菌丝致密,后期变为淡黄色(图3-D、E)。菌株Ck-8的分生孢子无色、单孢、长椭圆形至卵圆形。附着胞卵圆形或姜瓣型,产生黑色素。分生孢子大小为(11.1~27.7)μm×(5.5~9.7)μm(图2-F),附着胞大小为(8.3~11.1)μm×(5.5~8.3)μm(图3-G)。

注:A-B,菌株Ct-4在PDA培养基上培养6 d后的菌落形态正面和背面;C,Ct-4的分生孢子;D-E,菌株Ck-8在PDA培养基上培养6 d后的菌落形态正面和背面;F,Ck-8的分生孢子;G,附着胞。标尺,C、F、G为100 μm。
Note: A-B, the upper and reverse of colony morphology of strain Ct-4 cultured on PDA medium for 6 days; C, conidia of Ct-4; D-E, the upper and reverse of colony morphology of strain Ck-8 cultured on PDA medium for 6 days; F, conidia of Ck-8; G, appressorium. Bars: C, F, G=100 μm.
图3 车轴草弯孢菌和喀斯特炭疽菌在PDA平板上的菌落形态
Fig. 3 Morphological characteristics ofandcultured on PDA
2.4 分离病原菌的分子鉴定
以分离菌株Ct-4和Ck-8的基因组DNA为模板,用通用引物ITS4和ITS5进行PCR扩增,扩增出约500~750 bp的PCR产物。序列测定显示Ct-4的ITS序列长度为574 bp。用BLASTn在GenBank中进行同源性比较,结果(表2)表明Ct-4(登录号为OM269041)与菌株KUC5010(登录号为GQ241277.1)具有100%的相似性。通过构建ITS基因的系统发育树(图4)发现Ct-4与车轴草弯孢菌聚集在一起,形成一个独立的分支。结合形态学特征与分子鉴定,确定菌株Ct-4为车轴草弯孢菌。
序列测定显示Ck-8的ITS序列长度为566 bp。Ck-8的ITS序列(登录号为OM269042)与属菌株具有99.10%~100%的相似性。为了进一步明确菌株的分类地位,对菌株Ck-8的、、和序列进行扩增,获得大小分别为242、733、229和299 bp的目的片段。将序列测序后提交到NCBI/GenBank(OM275478,OM275479,OM275480,OM275481)。同源性比对发现Ck-8的各个基因与具有99.13%~100%的相似性。利用ITS、、、和序列进行多基因联合系统进化分析(序列登录号信息如表2所示),结果显示,菌株Ck-8与喀斯特炭疽菌位于同一分支(图5)。结合形态学特征与分子鉴定,确定Ck-8为喀斯特炭疽菌。
2.5 病原菌的生物学特性
2.5.1 碳、氮源对病原菌生长的影响 菌株Ct-4和Ck-8在不同的碳、氮源培养基上的生长情况如表3、表4所示。菌株Ct-4在8种碳源和8种氮源培养基上均能生长,但在水溶性淀粉为碳源和牛肉膏为氮源的培养基上菌丝生长最快,培养5 d后菌落直径分别为45.43和47.03 cm,显著高于其他碳、氮源处理,说明菌株对其利用效果最好,而对葡萄糖为碳源以及缬氨酸为氮源的利用效果最差,菌落直径分别为19.37和32.43 cm。菌株Ck-8对葡萄糖为碳源和牛肉膏为氮源利用效果最好,培养5 d菌落直径分别为52.40和53.63 cm,而对半乳糖为碳源和硝酸钠为氮源的利用效果最差,菌落直径仅为32.67和35.73 cm。

图5 基于ITS、ACT、TUB、GAPDH和CHS-1基因序列构建的菌株Ck-8 的系统发育树
注:表中数据为平均数±标准差。不同字母表示经检验在<0.05水平差异显著。下同。
Note: Data are mean±SD. Different lowercase letters on the bars indicate significant difference at<0.05 level by t test,respectively. Same below.
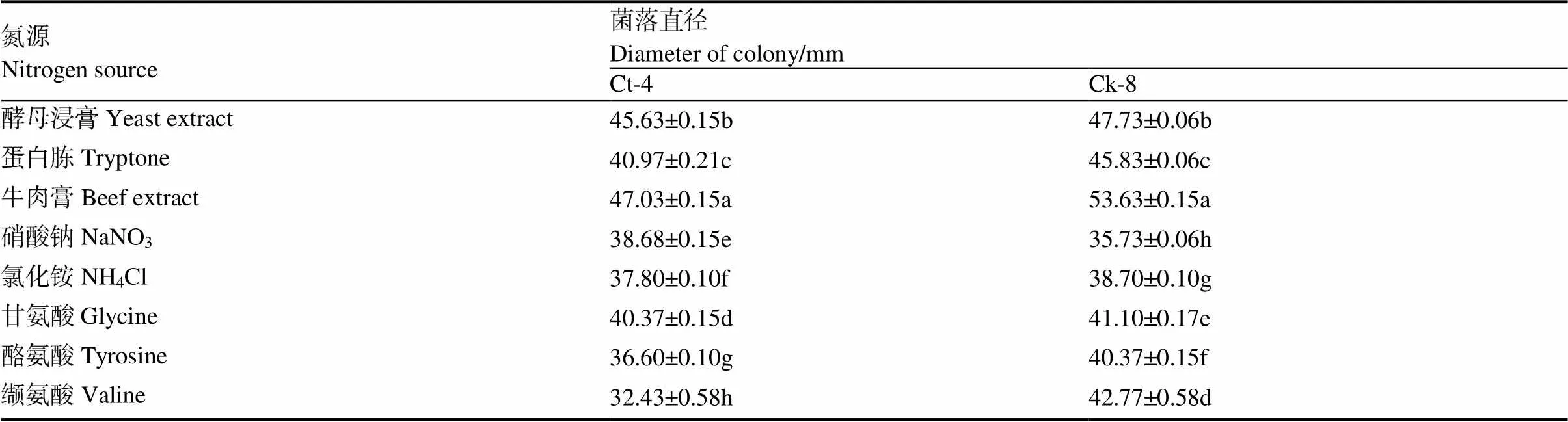
表4 不同氮源对Ct-4和Ck-8生长的影响
2.5.2 温度对病原菌生长的影响 如图6所示,菌株Ct-4和Ck-8的生长温度范围较广,在10~30 ℃范围内均能生长,菌株的最适生长温度为20~30 ℃。在温度为5 ℃时菌丝几乎停止生长。在25 ℃时Ct-4和Ck-8都生长最快,培养5 d菌落直径分别为44.30和58.63 cm,其中菌株Ct-4气生菌丝发达,培养基颜色最深。
2.5.3 pH对病原菌生长的影响 如图7所示,在pH 4~10时,菌株Ct-4和Ck-8均能生长,说明其对酸碱环境的适应范围较宽,当pH为7时最适宜菌株Ct-4的生长,培养5 d菌落直径为44.77 cm。当pH为7时,Ck-8的菌丝生长最快,培养5 d菌落直径为55.10 cm。
3 讨 论
本研究从疑似弯孢菌叶斑病和炭疽病的烟草植株上分离了2种病原真菌,经形态学特征观察、分子鉴定和致病性试验,确定了引起2种烟草叶部病害的病原分别为车轴草弯孢菌和喀斯特炭疽菌。
两种病害都侵染烟草叶片,其中车轴草弯孢菌引起的烟草弯孢菌叶斑病病斑不规则,病斑外围晕圈不明显,且无黑色小粒点,这可以与另一种由引起的烟草叶斑病进行区分[25]。目前车轴草弯孢菌引起烟草叶斑病仅在贵州有报道[16],我国其他地区还未见车轴草弯孢菌引起烟草病害的报道。喀斯特炭疽菌常引起各类植物炭疽病,如引起巴西的苹果叶上炭疽病和墨西哥的鳄梨炭疽病[26-27]。在烟草上喀斯特炭疽菌只被报道在海南引起雪茄烟炭疽病[19],目前还没有在烤烟上引起病害的报道。喀斯特炭疽菌引起的烟草炭疽病症状与近期本课题组在湖南报道的由兰炭疽菌孢引起的烟草炭疽病[18]类似,因而本研究也将为明确烟草炭疽病病原种类及其科学防治提供重要参考依据。
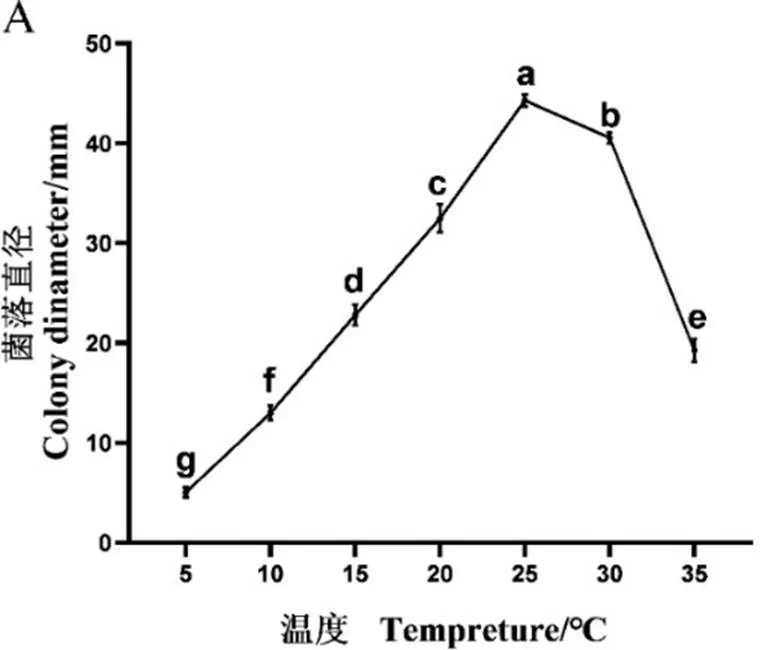

注:A,菌株Ct-4;B,Ck-8。下同。
Note: A, strain Ct-4; B, strain Ct-4. Same below.
图6 不同温度对Ct-4和Ck-8生长的影响
Fig. 6 Effects of different temperatures on the mycelial growth of Ct-4 and Ck-8


图7 不同pH对Ct-4和Ck-8生长的影响
本研究对车轴草弯孢菌菌株Ct-4和喀斯特炭疽菌Ck-8进行了最适碳源、氮源,温度和pH等生物学性状研究。研究表明,车轴草弯孢菌和喀斯特炭疽菌均能利用多种碳源和氮源。车轴草弯孢菌最适碳源为可溶性淀粉,最适氮源为牛肉浸粉,与何世芳等[28]研究结果一致。喀斯特炭疽菌对葡萄糖为碳源和牛肉膏为氮源利用效果最好,研究结果与引起其他植物病害的同种病原存在差异[29],可能是寄主、地理位置不同导致的。本研究发现车轴草弯孢菌和喀斯特炭疽菌最适生长温度范围都为20~30 ℃。何世芳等[28]报道引起烟草叶斑病的棒状弯孢最适宜生长温度为28 ℃,冉飞等[29]报道的引起百香果炭疽病的喀斯特炭疽最适生长温度为25 ℃,与本研究结果基本一致。此外本研究中高温有利于车轴草弯孢菌产生更多色素,使得培养基颜色更深,这也与何世芳等[28]、刘飞等[30]结果一致。菌株生长的适宜温度范围也与该病害在湖南春夏之交为高发期的规律相吻合。两种病原菌均对酸碱环境适应范围较广,在pH 4~10内均能生长,在pH=7时最适宜菌丝生长,表明中性条件有利于菌丝生长。虽然本研究发现和报道了湖南烟草上的两种叶部病害,但对于该类病害的发生规律、侵染机制、防控技术等仍需进一步研究。
4 结 论
本研究对湖南省两种烟草叶部病害病原进行了鉴定。通过形态学和分子生物方法确定病原分别为车轴草弯孢菌和喀斯特炭疽菌。生物学特性研究表明,车轴草弯孢菌菌丝生长最适温度为25 ℃,最适pH为7,以水溶性淀粉为碳源、牛肉膏为氮源时对菌丝生长最有利;喀斯特炭疽菌菌丝生长最适温度为25 ℃,最适pH为7,以葡萄糖为碳源、牛肉膏为氮源时对菌丝生长最有利。本研究为烟草弯孢菌叶斑病和炭疽病的识别和精准防控提供了参考依据,下一步将深入探究病害发生规律,确定关键防治时期,为这两种病害的高效防治提供参考。
[1] 马云飞,许灵杰,李德仑,等. 贵州烤烟与主要粮蔬作物的生产效率比较[J]. 贵州农业科学,2020,48(7):18-22.
MA Y F, XU L J, LI D L, et al. Comparison of production efficiency between flue-cured tobacco and main grain & vegetable crops in Guizhou[J]. Guizhou Agricultural Sciences, 2020, 48(7): 18-22.
[2] 陈庆园,商胜华,陆宁. 贵州烤烟叶部主要病害危害损失调查与分析[J]. 贵州农业科学,2009,37(9):95-98.
CHEN Q Y, SHANG S H, LU N. Analysis on loss caused by main leaf diseases of flue-cured tobacco in Guizhou[J]. Guizhou Agricultural Sciences, 2009, 37(9): 95-98.
[3] 田华,朱艳梅,董瑜,等. 毁灭炭疽菌诱抗蛋白对烟草抗病性的诱导[J]. 植物保护学报,2017,44(1):67-74.
TIAN H, ZHU Y M, DONG Y, et al. Induced resistance of tobacco by the protein elicitor of[J]. Journal of Plant Protection, 2017, 44(1): 67-74.
[4] 朱承广,任民,蒋彩虹,等. 以关联分析发掘烟草抗赤星病基因分子标记[J]. 中国烟草科学,2017,38(1):68-72.
ZHU C G, REN M, JIANG C H, et al. Identification of molecular markers for tobacco brown spot resistant genes through association analysis[J]. Chinese Tobacco Science, 2017, 38(1): 68-72.
[5] 魏代福,谭青涛,张广民. 防治烟草野火病的药剂测定与筛选[J].中国烟草科学,2010,31(2):42-44.
WEI D F, TANG Q T, ZHANG G M. Determination and selection of pesticides against tobacco wildfire disease (pv.tabaci)[J]. Chinese Tobacco Science, 2010, 31(2): 42-44.
[6] 段燕平,梁梅,秦西云. 云南保山烟草青枯病的病原鉴定及发生规律[J]. 中国烟草科学,2008,29(5):48-51.
DUAN Y P, LIANG M, QIN X Y. Pathogen identification ofE. F Smith on tobacco and its occurrence in Baoshan[J]. Chinese Tobacco Science, 2008, 29(5): 48-51.
[7] 董鹏,朱三荣,蔡海林,等. 湖南烟草病毒病种类检测与系统进化分析[J]. 中国烟草科学,2020,41(3):58-64.
DONG P, ZHU S R, CAI H L, et al. Detection and phylogenetic analysis of tobacco viruses in Hunan province[J]. Chinese Tobacco Science, 2020, 41(3): 58-64.
[8] MARIN-FELIX Y, HERNáNdez-RESTREPO M, CROUS P W. Multi-locus phylogeny of the genusand description of ten new species[J]. Mycological Progress, 2020, 19(6): 559-588.
[9] 徐辉,侯冕,檀根甲,等. 水稻弯孢叶斑病病原鉴定及其生物学特性[J]. 安徽农业大学学报,2020,47(1):129-134.
XU H, HOU M, TAN G J, et al. Identification and characterization of causal organism of riceleaf spot disease[J]. Journal of Anhui Agricultural University, 2020, 47(1): 129-134.
[10] 王新华,高金欣,高士刚,等. 玉米新月弯孢叶斑病研究进展[J].植物病理学报,2019,49(4):433-444.
WANG X H, GAO J X, GAO S G, et al. Research progress on maizeleaf spot caused by[J]. Acta Phytopathologica Sinica, 2019, 49(4): 433-444.
[11] 张笑宇,孙雪梅,周洪友,等. 燕麦叶斑病病原菌鉴定及其生物学特性[J]. 植物保护学报,2017,44(3):473-480.
ZHANG X Y, SUN X M, ZHOU H Y, et al. Identification and biological characteristics of leaf spot pathogenin oat[J]. Journal of Plant Protection, 2017, 44(3): 473-480.
[12] LIU Z, LIU T, CHEN D, et al. First report ofcausing leaf spots on Partridge tea [(Miq.) Mll. Arg.] in China[J]. Journal of Plant Pathology, 2019, 101(2):439-439.
[13] CHEN X, TANG T, CHEN C, et al. First report ofleaf spot caused byonin China[J]. Journal of Plant Pathology, 2021, 103(3):1073.
[14] LAI J H, LIU T K, LIU B, et al. First report ofcausing leaf spot on sweet potato () in China[J]. Plant Disease, 2021, 106(6): 1753.
[15] 朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2002.
ZHU X C, WANG Y T, WANG Z F. Chinese tobacco disease[M]. Beijing: China Agriculture Press, 2002.
[16] CHEN R, ZHANG J, CHENG J, et al. Leaf spot of tobacco (L.) caused byin Guizhou Province of China[J]. Plant Disease, 2017, 101(8): 8, 1549.
[17] WANG H C, HUANG Y F, CHEN Q, et al. Anthracnose caused byon tobacco () in China[J]. Plant Disease, 2016, 100(6): 1235.
[18] WANG Y R, HU Z, ZHONG J, et al. First report ofcausing leaf spot on tobacco () in Hunan Province of China[J]. Plant Disease, 2022, 106(1): 316.
[19] ZHAO Q, XIA C J, WANG J, et al. First report ofcausing anthracnose on cigar tobacco in Hainan, China[J]. Plant Disease, 2020, 104(7): 2025-2025.
[20] 方中达. 植病研究方法[M]. 北京:中国农业出版社,1998.
FANG Z D. Plant disease research method[M]. Beijing: China Agriculture Press, 1998.
[21] WHITE T J, BRUNS T, LEE S J W T, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR protocols: a guide to methods and applications. San Diego: Academic press, 1990, 18: 315-322.
[22] 崔海洋,冯丽娜,齐慧霞,等. 秦皇岛市北苍术三种叶部病害病原菌的鉴定[J]. 植物病理学报,2021,51(5):807-812.
CUI H Y, FENG L N, QI H X, et al. Identification of fungal pathogens of three foliar diseases inin Qinhuangdao City[J]. Acta Phytopathologica Sinica, 2021, 51(5): 807-812.
[23] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
[24] 朱俊子,邱泽澜,高必达,等. 黄花菜叶斑病菌鉴定、生物学特性分析、防治药剂筛选及LAMP检测体系的建立[J]. 植物保护学报,2022,49(6):1631-1641.
ZHU J Z, QIU Z L, GAO B D, et al. Identification, biological characteristics, screening of fungicides and establishment of loop-mediated isothermal amplification for the pathogen causing leaf spot of citron daylily[J]. Journal of Plant Protection, 2022, 49(6): 1631-1641.
[25] GUO Z, YU Z, WANG H, et al. Leaf spot caused byon tobacco in China[J]. Plant Disease, 2021, 105(2): 501.
[26] VELHO A C, STADNIK M J, CASANOVA L, et al. First report ofcausing glomerella leaf spot on apple in Santa Catarina State, Brazil[J]. Plant Disease, 2014, 98(1): 157-158.
[27] VELÁZQUEZ-DEL VALLE M G, CAMPOS-MARTÍNEZ A, FLORES-MOCTEZUMA H. E, et al. First report of avocado anthracnose caused byin Mexico[J]. Plant Disease, 2016, 100(2): 154.
[28] 何世芳,桑维钧,曹毅,等. 烟草弯孢菌叶斑病病原菌鉴定及生物学特性研究[J]. 中国烟草科学,2021,42(5):50-56.
HE S F, SANG W J, CAO Y, et al. Identification and biological characterization ofcausing the tobacco leaf spot disease[J]. Chinese Tobacco Science, 2021, 42(5): 50-56.
[29] 冉飞,陈佳,莫飞旭,等. 百香果炭疽病菌生物学特性及室内药剂筛选[J]. 热带作物学报,2021,42(4):1080-1085.
RAN F, CHEN J, MO F X, et al. Biological characteristics of the pathogen and fungicides screening in laboratory for Anthracnose ofSims[J]. Chinese Journal of Tropical Crops, 2021, 42(4): 1080-1085.
[30] 刘飞,伍晓丽,李富华,等. 四川省玉米弯孢叶斑病菌的种类及生物学特性研究[J]. 西南师范大学学报(自然科学版),2008(1):43-48.
LIU F, WU X L, LI F H, et al. Studies on the classification and biological character of the pathogen ofleaf spot in Sichuan[J]. Journal of Southwest China Normal University (Natural Science Edition), 2008(1): 43-48.
Identification and Biological Characterization ofLeaf Spot and Anthracnose Diseases on Tobacco in Hunan Province
XIAO Yansong1, LI Sijun2, WU Wenxin2, LIU Tianbo3*, ZHOU Xiangping4, LI Ping5, ZHONG Jie5*
(1. Chenzhou Tobacco Company of Hunan Province, Chenzhou, Hunan 423000, China; 2. Guiyang Tobacco Company of Chenzhou in Hunan Province, Chenzhou, Hunan 424400, China; 3. Hunan Tobacco Science Research Institute, Changsha 410004, China; 4. Yongzhou Tobacco Company of Hunan Province, Yongzhou, Hunan 425000, China; 5. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China)
From 2020 to 2023, two foliar diseases suspected to beleaf spot and anthracnose were found on tobacco in Chenzhou City, Hunan Province. The objective of this study was to clarify the pathogens and provide theoretical reference for scientific and effective control of the diseases. The fungal pathogens were isolated from symptomatic leaves by tissue isolation and the diseases were identified to be leaf spot and anthracnose by both morphological observation and Koch’s postulates. Combined with the morphological characteristics and ITS based phylogenetic analysis, the pathogen of the tobacco leaf spot was determined to be, while the pathogen of the tobacco anthracnose was identified asusing both the morphological and molecular characteristics by ITS,,,andgene regions. The study of biological characteristics showed that the optimum temperature for mycelium growth ofwas 25 ℃, the optimum pH was 7, and it was most favorable for mycelium growth when soluble starch was used as carbon source and beef powder as nitrogen source. The optimum temperature for mycelium growth ofwas 25 ℃, the optimum pH was 7, and it was most favorable for mycelium growth when glucose was used as carbon source and beef powder as nitrogen source. To our knowledge, this is the first time that these two diseases are reported in Hunan Province of China. Up to now, there is no report ofcausing disease in flue-cured tobacco in China. The results can provide a basis for the scientific and effective prevention and control of these diseases.
;;leaf spot; anthracnose; tobacco pathogens
S435.72
A
1007-5119(2023)06-0044-09
湖南省郴州市烟草公司烟草农业科技创新项目(CZYC2022JS03);中国烟草总公司湖南省公司科技重点项目(HN2021KJ01);湖南省郴州市烟草公司烟草农业科技创新项目(CZYC2023JS05)
肖艳松(1981-),女,副研究员,主要从事烤烟栽培及植保技术研究。E-mail:xiaoyansong106@126.com*通信作者。E-mail:刘天波,tianboliu@126.com;钟 杰,wzzhtx@sina.com
2023-06-07
2023-09-01
10.13496/j.issn.1007-5119.2023.06.007
