青岛烟区马铃薯Y病毒株系鉴定及系统传导特性
2024-01-30郭光耀宋丽云江连强沈广材张富强董文凤何青云申莉莉
郭光耀,宋丽云,2*,江连强,沈广材,张富强,董文凤,何青云,申莉莉*
青岛烟区马铃薯Y病毒株系鉴定及系统传导特性
郭光耀1,宋丽云1,2*,江连强3,沈广材4,张富强4,董文凤1,何青云1,申莉莉1*
(1.中国农业科学院烟草研究所,青岛 266101;2.潍坊职业学院农林科技学院,山东 潍坊 262737;3.四川省烟草公司凉山州公司,四川 西昌 615000;4.云南省烟草公司保山市公司,云南 保山 678000)
为明确引起青岛试验田烟草脉坏死及花叶的PVY的发生规律、分子进化和系统传导特性,通过病毒病害表型,发病率和病情指数明确青岛试验田病毒病害流行规律;利用MEGA7构建系统发育树鉴定PVY青岛分离物的株系;通过qRT-PCR,western blotting和PVY-GFP荧光明确PVY侵染烟株的传导路径;通过不同叶位、不同症状病叶取样,利用qRT-PCR检测PVYmRNA相对含量,明确显症和隐症叶片的病毒含量差异,以及TMV、CMV、PVY单独、两者混合、三者混合侵染时的干扰或协生作用。结果显示:烟株成熟期,PVY与TMV和CMV混合发生严重,PVY分离物为N:O株系,未突破基因抗性。在侵染早期,病毒从接种叶沿叶脉进入茎,开始双向运输时,先向根部移动,进而到达苗端;再扩散至上部叶,较慢移动至下部叶;最后伴随烟株生长持续向两端新生部位运输。侵染中期病株上部叶隐症现象显著,病叶症状与病毒浓度呈正相关。烟田中后期,PVY与TMV和CMV混合侵染,病毒间的干扰和协生作用导致症状复杂多变。研究结果有助于提高品种抗性鉴定试验的准确性和药效试验的靶标性。
马铃薯Y病毒;株系鉴定;系统传导;隐症;混合侵染
马铃薯Y病毒(potato virus Y,PVY)是危害植物的十大病毒之一,主要经农事操作和蚜虫取食传播,严重为害马铃薯、烟草、番茄、辣椒等作物[1]。PVY在自然界中存在很多株系,根据与马铃薯抗病基因的识别关系,将其划分为C、O、N、Z、E等株系[2-4]。株系C和O引起烟草花叶和脉明,而N株系导致脉坏死。由O和N重组产生的N:O、NTN、N-Wi、NTN-NW、NA-NTN等株系[5],因含有N型HC-Pro,均引起普通烟草脉坏死[6-8]。来自烟草品种VAM的隐性基因抗PVY多个株系,被应用于抗病育种。但随着型抗病品种的广泛种植,已在多国发现克服抗性的突变毒株[9-10]。PVY-CJ是我国首个被报道的突破抗性的毒株,在分子进化上归于NTN株系[11]。
隐症是指被病毒侵染的植物在系统发病显症一段时间后,新生部分的症状出现减轻或消失的现象,一旦恢复适宜发病的条件,症状又可重新出现[12]。不同病毒株系在不同环境条件下侵染抗/感寄主,诱导产生的症状极为复杂多变[13]。烟田早期感染PVY的病株中后期上部叶常表现隐症[14]。在三生NN烟上活体保存毒源及在烟草苗期接种病毒的抗性鉴定中,PVY隐症现象尤为突出。通常,接种后1~2周上部叶出现花叶脉明和轻微反卷;2~3周俯瞰病株群体表现轻症,逐株分级调查时可见顶部叶轻微花叶脉明,中上部叶隐症,而下部叶显著脉坏死且反卷皱缩[14]。
此外,两种或几种病毒复合侵染是烟田中后期的普遍现象。多种病毒在同一植物体内发生复合侵染时,主要表现为协生或干扰作用[14-15]。明确烟草主要病毒复合侵染时病毒间的协同或干扰作用及其对应的病害表型,有助于准确判定复合侵染和发病级别。并且烟株感染PVY的显症规律和隐症现象的准确判定,是制定病情系统调查节点和病害严重度分级的关键。为探明引起青岛试验田烟草脉坏死及花叶的PVY毒株的发生规律、分子进化和系统传导特性,本文进行了田间病情普查、毒株鉴定和系统传导特性的研究,以期提高品种抗性鉴定试验的准确性和药效试验的靶标性。
1 材料与方法
1.1 供试植物、病毒和引物
供试植物:苋色藜()、本氏烟()、三生烟NN(Samsun NN)、中烟100、K326、VAM、CV91、云烟85、NC95、粘烟草。烟草花叶病毒(tobacco mosaic virus,TMV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、马铃薯Y病毒(potato virus Y,PVY)、侵染性克隆PVY-GFP,以上材料均保存于本实验室。扩增全长和荧光定量检测的引物(表1)及测序由青岛派森诺基因科技有限公司完成。
1.2 PVY大田普查、病叶采集、纯化保存及株系鉴定
2021年在青岛即墨市龙泉镇石门村试验田,于中烟100和K326团棵期至旺长期进行大田病情普查[16],统计分析发病规律。随机采集典型PVY发病症状的5个病叶样本,汁液摩擦接种在苋色藜上,单斑分离纯化,在三生烟NN上活体保存。在5~6叶期K326、VAM、CV91、云烟85和NC95两片最大展开叶上,汁液摩擦接种40倍质量浓度的病汁液,25~26 ℃培养,记录抗感表型。每处理3~6株,重复3次。下述烟苗接种PVY均按此方法。

表1 引物序列
提取病叶总RNA,以引物PVY-CP-F1/R1扩增病毒外壳蛋白全长,提交NCBI进行同源分析。下载PVY各株系为外群,采用MEGA 7.0构建系统发育树[17]。
K326接种PVY后4~16 d,以PVY-CP-F2/R2和Actin-F/R为引物,qRT-PCR检测相对于接种叶的植株不同部位中mRNA相对含量[18]。
在5~6叶期本氏烟最大展开叶上,浸润接种PVY-GFP。接种后2~16 d在紫外光下记录GFP传导路径;3.5 d检测不同部位中mRNA含量;8~16 d采用Western blot检测不同部位中CP积累量[18]。
1.3 PVY显症和隐症叶片中病毒含量检测
三生NN接种PVY后出现上部叶隐症时,自下而上取花叶脉坏死皱缩、花叶、隐症和轻微花叶的叶片,检测mRNA含量。在田间旺长期,对下部叶脉坏死皱缩、上部叶隐症的PVY病株检测不同叶位中的病毒含量。
1.4 PVY与TMV、CMV混合侵染烟株中的病毒含量检测
对K326分别进行TMV、CMV、PVY单独、两者混合、三者混合侵染的接种,设不接种空白对照,共计8个处理。接种后7 d取上部系统叶,检测mRNA含量,分析病毒间的协生或干扰作用。
1.5 实时荧光定量PCR(Quantitative Real-time PCR)检测病毒相对含量
首先利用TRIzol(Vazyme,南京)裂解烟草叶片组织提取植物总RNA,然后按照反转录试剂盒(Vazyme,南京)说明合成cDNA。最后利用SYBR Premix Ex TaqTM试剂盒(Vazyme,南京)和Applied Biosystems 7500系统进行qRT-PCR。β-肌动蛋白基因用作内源对照,用荧光定量检测的引物(表1)检测病毒外壳蛋白表达的变化。采用2-△△CT法计算目的基因的相对表达量,每处理3个生物学重复。
2 结 果
2.1 试验田PVY发生规律
普查结果显示(图1),移栽缓苗后15~20 d(6月下旬),移栽接触传毒导致TMV成串甚至成行爆发,中烟100和K326的发病率分别为4.60%和16.25%,此时偶有PVY脉坏死和花叶病株。团棵期至旺长期(7月上旬),农事接触和蚜虫传毒促使PVY发病率上升,时有连串病株,形成局部发病中心,中烟100和K326发病率分别为27.96%和25.00%;但此时上部叶隐症现象普遍,病情指数较轻,分别为13.14和18.62。此期间试验地块施药和农事操作导致TMV发病率和病情指数均较高,但CMV病株较少。始花期至打顶期(7月下旬),除TMV、PVY单独侵染病株病情较重之外,两者混合侵染显著提高,中烟100和K326发病率分别为14.43%和39.08%,病情指数分别为14.43和37.80,下部叶受PVY侵染脉坏死皱缩,上部叶受TMV侵染出现沿叶脉黄绿相间的花叶;PVY与CMV混合侵染株数较少,但花叶皱缩坏死症状较重。
上述结果表明:PVY病情略低于TMV但显著高于CMV。缓苗期以TMV为主;团棵期至旺长期以TMV和PVY单独侵染为主,偶有CMV单独侵染;始花期至成熟期是TMV和PVY单独侵染和两者混合侵染的高峰,偶有与CMV混合侵染。
2.2 PVY分离物的株系鉴定
如图2所示,病毒外壳蛋白基因的PCR扩增产物大小为804 bp。提取病叶总蛋白,Western blot免疫印迹到一条34 kDa的单一蛋白条带,与PVY CP大小一致。进化树(图3A)表明分离物PVY-Qingdao与PVY-N:O株系的核苷酸相似性最高,为98.75%,其系统关系聚为一族,显示青岛烟草分离物为N:O株系。该分离物与O、C、NTN、N株系的亲缘关系相对较远,核苷酸相似性分别为96.14%~98.01%、91.20%~91.95%、89.37%~90.67%、87.73%~89.76%。
PVY-Qingdao接种在苋色藜上表现接种叶枯斑;粘烟草表现花叶脉明;三生烟NN为上部叶脉明,下部叶脉坏死皱缩向内侧弯曲;K326为花叶脉明;VAM仅上部叶脉明;CV91接种叶之上的中部叶片脉明,向内侧微卷,上部叶轻微花叶;云烟85和NC95中部叶严重花叶皱缩内卷,脉坏死,上部叶脉明花叶(图3B)。依据这一结果,在烟草苗期接种PVY的抗性鉴定中,设置抗病对照VAM,中抗对照CV91,感病对照云烟85和NC95。VAM抗病说明该分离物未突破基因抗性。
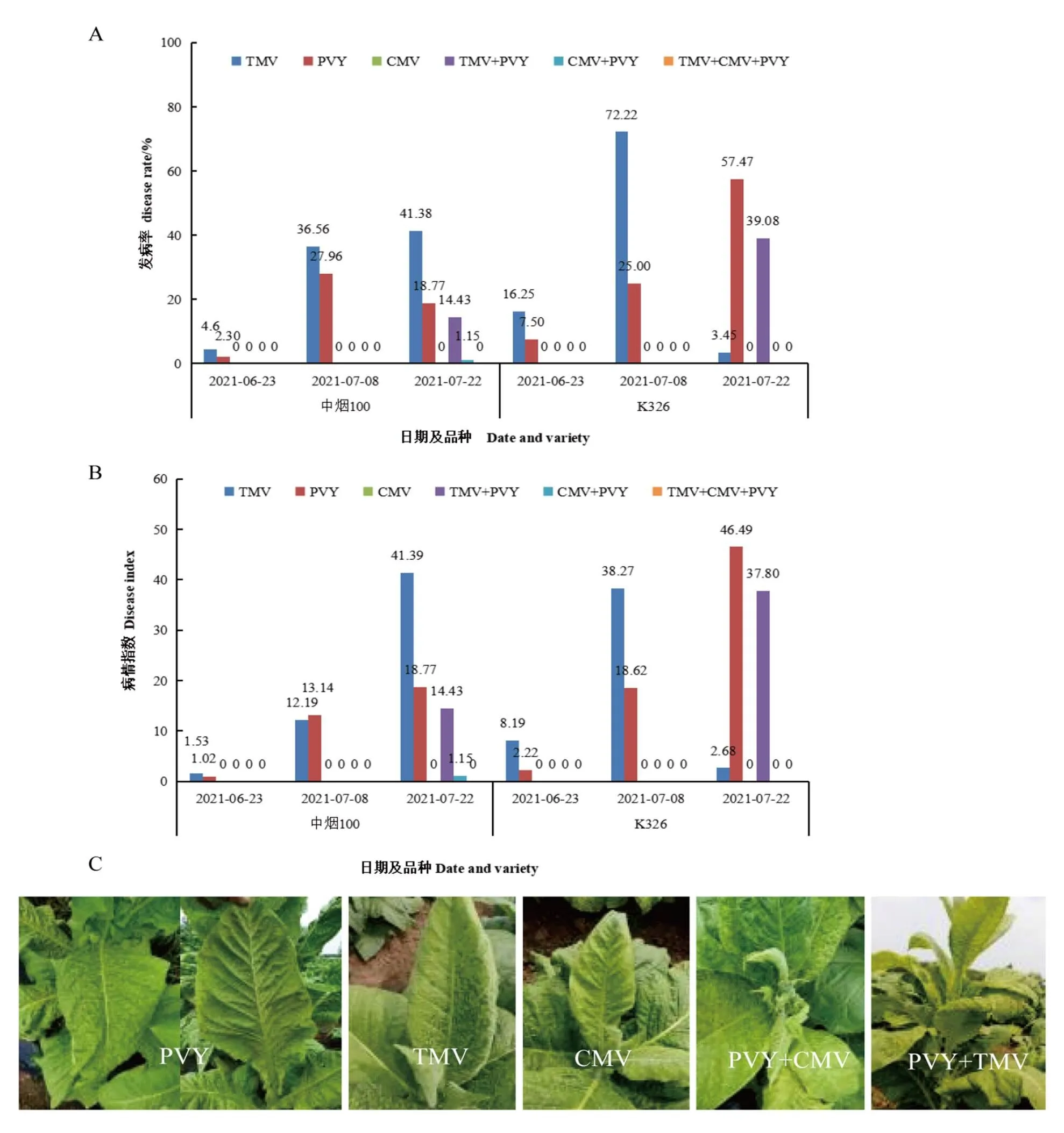
图1 试验田病毒病种类及病害表型
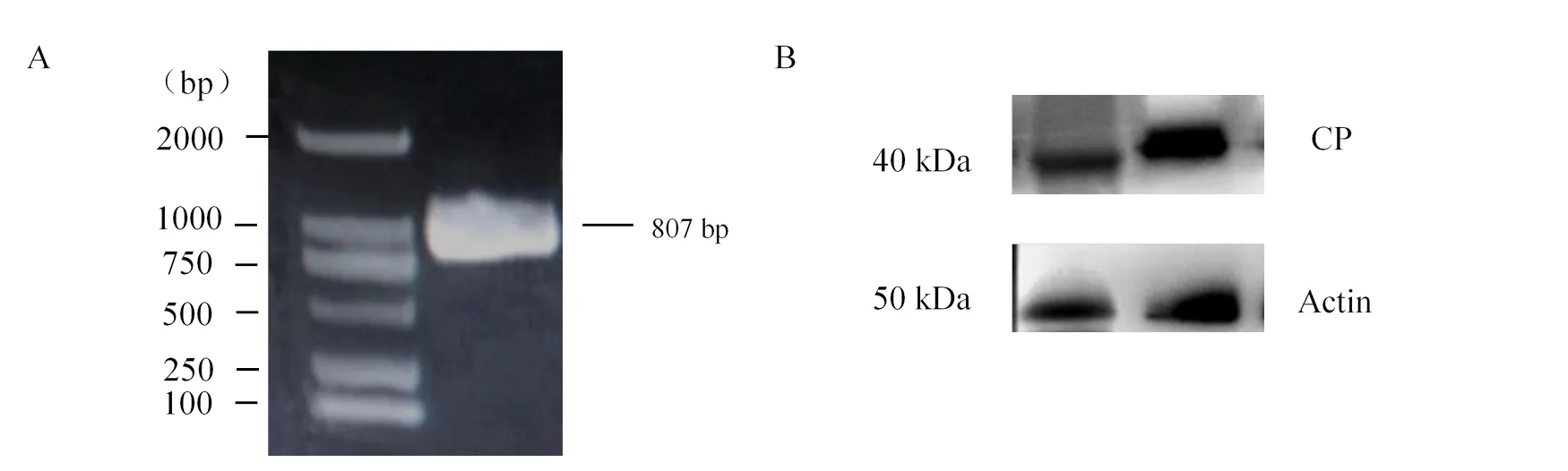
注:A,基因核酸电泳;B,CP蛋白印迹。
Note: A,gene nucleic acid electrophoresis; B, CP western blotting.
图2 PVY青岛分离物的CP检测
Fig. 2 CP Detection of PVY Qingdao isolate
注:A,CP蛋白株系进化树;B,PVY-Qingdao在寄主上的病害表型。
Note: A, CP protein strain evolution tree; B, PVY-Qingdao disease phenotype on the host.
图3 PVY青岛分离物的毒株鉴定
Fig. 3 Strain identification of PVY Qingdao isolate
2.3 PVY在K326及PVY-GFP在本氏烟上的系统传导路径
K326接种PVY后4~16 d,植株各部位mRNA表达量(图4)显示:第4天,接种叶含量最高,根和上1叶、上2叶检出PVY,显示病毒进入主茎后,先近乎同时两端运输,但此时尚未扩散至下部叶。第8天,含量排序为:下1叶<上2叶<根<下2叶<接种叶<上1叶,显示病毒布满全株,且向上运输旺盛。第12天,各部位病毒含量达到高峰,含量排序为:接种叶<上2叶<根<上1叶<下1叶<下2叶,说明病毒布满全株后开始持续向中下部叶和根扩散。第16天,含量排序为:根<下1叶<下2叶<上2叶<接种叶<上1叶,显示伴随烟株生长,病毒持续向顶叶运输。这一结果显示PVY在K326上的扩散路径为:接种叶→茎→根、心叶→上部叶、下部叶→全株→旺长的上部叶。
为示踪病毒在同一植株上系统传导路径,在本氏烟上浸润接种PVY-GFP。紫外灯下植株外部荧光显示(图5A):病毒荧光先从初侵染点沿侧脉进入主脉,扩展至茎,随即快速双向运输;第8天,心叶和根系均布满荧光,然后扩散至毗邻接种叶的上部叶,较慢到达下部叶,最后伴随植株生长持续向两端新生部位运输;第16天,新叶和新根均呈现荧光。qRT-PCR检测结果显示(图5B),接种后3.5 d各部位中mRNA相对表达量以根部最大,接种叶次之,再是心叶和上部叶。这说明病毒进入主茎后,先向根部移动,进而移动到苗端。Western blot检测接种后8~16 d各部位中CP积累量,同样显示病毒先在根部、接种叶及其上部叶积累,再扩散至下部叶布满全株;病毒含量均以中上部叶最高,根中持续有病毒,较慢到达下部叶(图5C),这与荧光分布规律相符。

注:A,K326接种PVY后16 d,3、4、5分别为接种叶、上1叶、上2叶。
Note: A, 16 days after K326 was inoculated with PVY, 3, 4, and 5 were the inoculated leaves, upper 1 leaf, and upper 2 leaves, respectively.
图4 PVY在K326上的系统传导
Fig. 4 Systemic transduction of PVY on K326
注:A,PVY-GFP在本氏烟上的扩散时程,白色箭头指病毒接种点/接种叶片,时间指接种后天数;B,qRT-PCR检测接种后3.5 d各部位mRNA相对含量;C,Western blotting检测接种后不同时间、不同部位中CP积累量(S2,上2叶;S1,上1叶;JZ,接种叶;X1,下1叶;X2,下2叶;G,根)。
Note: A, Time course of PVY-GFP diffusion on, the white arrow indicates the virus inoculation point/leaf, and the time refers to the day after inoculation; B, qRT-PCR detection of relative content ofmRNA in each part 3.5 days after inoculation; C, Western blotting detection CP accumulation at different times and in different parts after inoculation (upper 2 leaves, S2; upper 1 leaf, S1; inoculated leaf, JZ; lower 1 leaf, X1; lower 2 leaves, X2, root, G).
图5 PVY-GFP在本氏烟上的系统传导
Fig. 5 Systematic spread of PVY-GFP infected
2.4 隐症病株的病叶症状与病毒浓度的相关性
5~6叶期三生NN烟接种PVY后7~10 d,上部系统叶先出现脉明花叶,随之脉坏死、内卷皱缩,心叶花叶;14~21 d,上部叶出现隐症现象,顶端新生叶轻微花叶。第14天,花叶脉坏死皱缩的下部叶、花叶轻微变形的中部叶、隐症的上部叶、轻微花叶的心叶,其mRNA含量分别为1.477 3、0.570 0、0.041 0和0.091 0。田间表现下部叶脉坏死皱缩、中部叶花叶轻微皱缩、上部叶隐症、顶叶隐症的病株,自下而上4片叶中mRNA含量分别为8.47、7.63、1.25、0.97(图6)。结果表明:隐症叶片中病毒含量最少,且病叶症状与病毒浓度呈正相关。
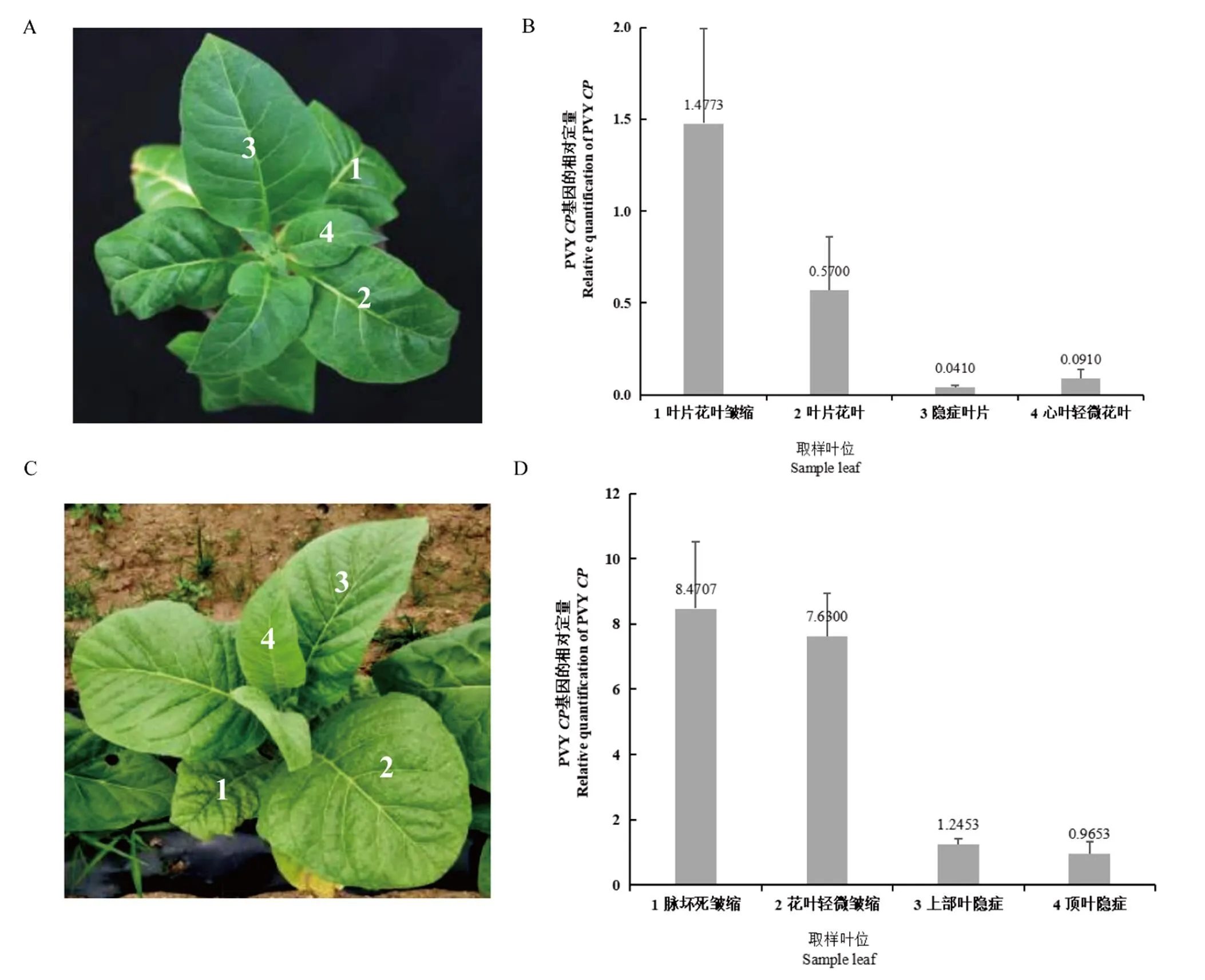
注:A,温室中感病烟株;B,温室感病烟株不同叶位中mRNA含量;C,田间感病烟株;D,田间感病烟株不同叶位中mRNA含量。
Note: A, virus infected tobacco in the greenhouse; B,mRNA content in different leaf positions of virus infected tobacco plants in the greenhouse; C, virus infected tobacco in the field; D ,mRNA content in different leaf positions of virus infected tobacco in the field.
图6 烟株感染PVY的显症/隐症叶片及其病毒浓度
Fig. 6 Symptomatic/recessive leaves of tobacco infected with PVY and their viral concentration
2.5 PVY与TMV、CMV混合侵染时的干扰或协生作用
如图7所示,在TMV、CMV、PVY单独、两者混合、三者混合侵染K326后7 d,系统叶中mRNA含量显示:(1)相比于TMV单独侵染,TMV+CMV复合侵染时,TMV表达量略有降低但差异不显著;而TMV+PVY复合侵染以及TMV+CMV+PVY同时侵染时,均显著促进TMV表达,但后者的促进作用略低。这表明两者混合侵染时,CMV对TMV的干扰不显著,PVY对TMV起协生作用,在三者混合侵染时,CMV侵染引起的干扰作用削减了PVY侵染引起的协生作用。(2)相比于CMV单独侵染,TMV+CMV复合侵染、CMV+PVY复合侵染时,CMV表达量显著被抑制,而且这种抑制作用在TMV+CMV+PVY三者同时侵染时最大。表明两者和三者混合侵染时,TMV和PVY均对CMV起干扰作用,且呈累加干扰效应。(3)相比于PVY单独侵染,TMV+CMV复合侵染、CMV+PVY复合侵染以及TMV+CMV+PVY同时侵染时,PVY表达量均显著被抑制,而且抑制程度渐次减弱。表明两者和三者混合侵染时,TMV和CMV对PVY起干扰作用,其中以TMV的干扰作用强于CMV的干扰作用,但两者无累加干扰效应。
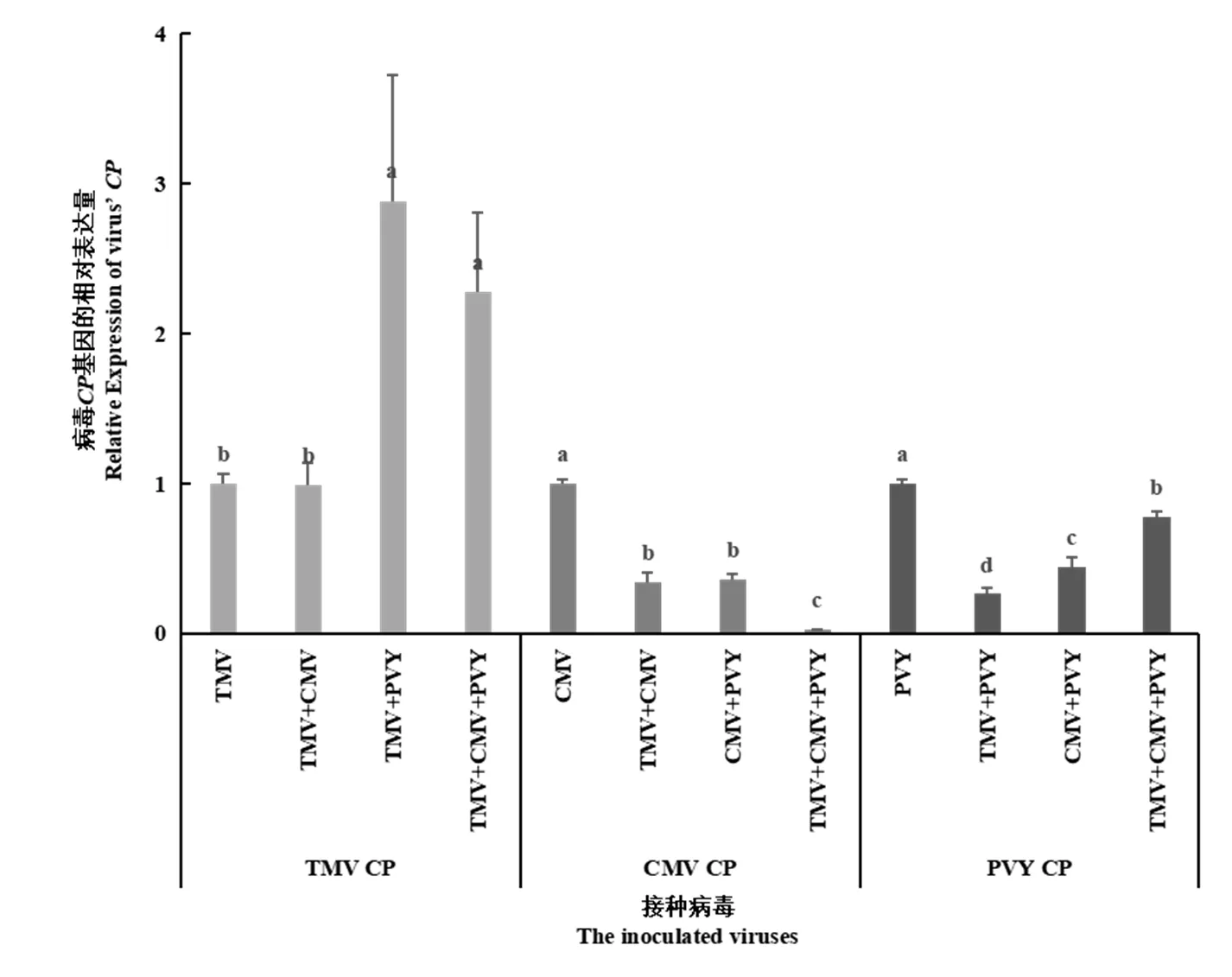
图7 不同病毒混合侵染7 d后K326系统叶中CP mRNA含量
上述结果说明3种病毒在两两复合侵染时,TMV显著抑制CMV,而CMV对TMV的抑制不显著;TMV显著抑制PVY而PVY显著促进TMV;CMV与PVY相互显著抑制。在三者同时侵染时,CMV对TMV的轻微干扰部分地抵消PVY对TMV的协生作用;TMV和PVY对CMV的干扰呈累加效应;TMV对PVY的干扰强于CMV对PVY的干扰,但无累加效应。
3 讨 论
根据危害的严重程度,PVY主要有两种类型:中度危害的花叶株系和重度危害的坏死兼花叶株系。我国各烟区已报道多种PVY株系或分离物,张帅[19]将8个主产烟区的51个PVY分离物划分为O、N、N:O、NTN 4个株系。此外,在云南昭通烟草上检出O和N株系[20],在黑龙江烟草上发现N、NTN、NW、NTN-NW株系,其中优势株系为NTN-NW[21],四川烟草分离物分为O、N、N:O株系[22],贵州烟田优势株系为N、NTN、NTN-NW[23-24],湖南烟草分离物为E和NTN-NW株系[25]。本研究中青岛烟田PVY分离物在分子进化上归于N:O株系,引起烟草花叶和脉坏死,VAM抗病,未突破抗性。
相比病毒胞间运动机制,多种病毒因子和寄主因子参与的病毒系统运输机制仍需进一步研究。通常,当病毒从侵染叶片叶脉进入微管系统时,系统侵染才开始。有研究显示韧皮部参与了病毒的长距离移动,例如花椒斑驳病毒(pepper mottle virus,PeMoV)首先通过辣椒的外韧皮部向根部移动,并在子叶节或其附近进入内韧皮部,进而移动到苗端[26]。也有研究显示植物病毒通过维管束鞘进入薄壁组织,进而渗透到伴胞/筛分子复合体中,通过筛分子快速运输到其他器官[27]。芜菁花叶病毒TuMV/6K2:GFP侵染本氏烟时,病毒复制囊泡出现在茎部各种类型细胞以及木质部汁液中;且在只留下木质部的茎部环剥株中,复制复合体仍可到达韧皮部和木质部,通过木质部导管建立系统感染[28]。本研究通过检测K326接种PVY后各部位mRNA表达量,也发现病毒在进入茎后先向根部移动、进而到达苗端。本氏烟上PVY-GFP示踪,mRNA及蛋白检测显示:病毒沿叶脉进入茎韧皮部后,先传导至根,随即至心叶;再扩散至接种叶上、下的中部叶,布满全株;最后伴随植株生长,持续向两端新生部位运输。
有关隐症的条件和内在机制,孙燕霞等[29]通过分析不同温度下PVY侵染的心叶烟()中病毒蛋白含量、症状和病毒来源的小分子干扰RNA含量,确定30 ℃以上高温引起症状消失;且常温时,检测到极少量的病毒起源的siRNAs,高温时在新生无症叶中检测不到,而下部症状保持叶中含量明显增加,显示高温激活了RNA沉默介导的抗病毒防御反应,导致隐症。本研究在三生NN、CV91、云烟85和NC95接种时,以及旺长期病情调查时,均发现隐症现象是PVY-N:O株系所具有的一种系统显症规律,且不同叶位的病毒浓度与症状呈正相关,具体的机制有待于后续研究。病毒混合侵染在烟田中后期普遍发生。夏烨[15]在TMV与CMV复合侵染K326后7 d的检测显示,两者同时侵染时,CMV对TMV干扰、TMV对CMV协生;在TMV、CMV、PVY三者同时侵染时,CMV对TMV干扰、PVY对TMV协生且占主导,TMV对CMV协生、PVY对CMV干扰且占主导。其两者混合侵染时TMV对CMV的协生,与本研究相反,且本文未检测到CMV对TMV的显著干扰。三者同时侵染时,其PVY对TMV协生且占主导,与本研究结论一致;但本文还检测到TMV和PVY均对CMV干扰,TMV和CMV对PVY干扰,且TMV干扰占主导。这可能与环境和温度差异相关,这也正说明了病毒侵染、系统传导和植株显症是复杂的动态过程。本研究结果有助于提高品种抗性鉴定试验的准确性和药效试验的靶标性。
4 结 论
本研究表明,青岛试验田中引起烟草花叶和脉坏死的PVY分离物为N:O株系,未突破基因抗性。病毒侵染早期,由接种叶沿叶脉进入茎韧皮部双向运输,先向下至根,向上至心叶,再逐渐扩散至上部叶,较慢到达下部叶,最后伴随烟株生长向两端新生部位运输。侵染中期,烟株上部叶隐症出现,病叶症状与病毒浓度呈正相关。烟株始花期至成熟期,PVY与TMV和CMV混合发生,病毒间的干扰和协生作用导致症状复杂多变。
[1] SCHOLTHOF K B G, ADKINS S, CZOSNEK H, et al. Top 10 plant viruses in molecular plant pathology[J]. Molecular plant pathology, 2011, 12(9): 938-954.
[2] SINGH R P, VALKONEN J P, GRAY S M, et al. Discussion paper: the naming of potato virus Y strains infecting potato[J]. Archives of Virology, 2008, 153(1): 1-13.
[3] BLANCHARD A, ROLLAND M, LACROIX C, et al. Potato virus Y: a century of evolution[J]. Current Topics in Virology, 2008, 7(12): 21-32.
[4] KARASEV A V, HU X, BROWN C J, et al. Genetic diversity of the ordinary strain of potato virus Y (PVY) and origin of recombinant PVY strains[J]. Phytopathology, 2011, 101(7): 778-785.
[5] 程林发,陈冠伟,姬丽云,等. 马铃薯Y病毒中国分离物的分子株系组成[J]. 植物病理学报,2021,51(5):721-733.
CHENG L F, CHEN G W, JI L Y, et al. Molecular strain composition of Chinese isolates of potato virus Y[J]. Plant Physiology Journal, 2021, 51(5): 721-733.
[6] FAUREZ F, BALDWIN T, TRIBODET M, et al. Identification of new potato virus Y (PVY) molecular determinants for the induction of vein necrosis in tobacco[J]. Molecular Plant Pathology, 2012, 13(8): 948-959.
[7] TRIBODET M, GLAIS L, KERLAN C, et al. Characterization of potato virus Y (PVY) molecular determinants involved in the vein necrosis symptom induced by PVY N isolates in infectedcv. Xanthi[J]. Journal of General Virology, 2005, 86: 2101-2105.
[8] 程林发,董文浩,张凤桐,等. 马铃薯Y病毒HC-Pro第182位赖氨酸残基参与引起烟草叶脉坏死[J]. 植物病理学报,2021,51(1):41-48.
CHENG L F, DONG W H, ZHANG F T, et al. The 182nd lysine residue of potato virus Y HC-Pro is involved in causing tobacco leaf vein necrosis[J]. Plant Physiology Journal, 2021, 51(1): 41-48.
[9] LACROIX C, GLAIS L, VERRIER J L, et al. Effect of passage of a potato virus Y isolate on a line of tobacco containing the recessive resistance gene va2 on the development of isolates capable of overcoming alleles 0 and 2[J]. European Journal of Plant Pathology, 2011, 130: 259-269.
[10] KIM J H, KIM Y S, JANG S W, et al. Characterization of a novel resistance-breaking isolate of potato virus Y in[J]. International Journal of Phytopathology, 2014, 3(1): 1-10.
[11] 李若,李尊强,万秀清,等.一株突破基因型烟草抗性的PVY病毒分离物的鉴定[J]. 中国烟草学报,2020,26(4):72-77.
LI R, LI Z Q, WAN X Q, et al. Identification of a PVY virus isolate that breaks throughgenotype tobacco resistance[J]. Acta Tabacaria Sinica, 2020, 26(4): 72-77.
[12] 王小青. 高温胁迫下烟草-TMV互作中的防御酶活性变化[D]. 郑州:河南农业大学,2006.
WANG X Q. Changed activities of defense-related enzymes in Nicotiana-TMV interaction under high-temperature stress[D]. Zhengzhou: Henan Agriculture University, 2006.
[13] 申莉莉,贾海燕,何青云,等. 毒株、苗龄及温度对烟草苗期接种TMV试验的影响[J]. 植物病理学报,2021,51(4):607-617.
SHEN L L, JIA H Y, HE Q Y, et al. Effects of virus strain, seedling age and temperature on tobacco seedling inoculation test with TMV[J]. Plant Physiology Journal, 2021, 51(4): 607-617.
[14] 王静,申莉莉,王秀芳,等. 烟草主要病虫害严重度分级图谱[M]. 北京:中国农业科学技术出版社,2021.
WANG J, SHEN L L, WANG X F, et al. Severity classification map of major tobacco pests and diseases[M]. Beijing: China Agricultural Science and Technology Press, 2021.
[15] 夏烨. 三种烟草病毒在烟田土壤中的分布动态及在烟草中的互作[D]. 广州:华南农业大学,2017.
XIA Y. Distribution dynamics of three tobacco viruses in tobacco field soil and their interactions in tobacco[D]. Guangzhou: South China Agricultural University, 2017.
[16] 任广伟,孔凡玉,王凤龙,等. 烟草病虫害分级及调查方法:GB/T 23222—2008[S].
REN G W, KONG F Y, WANG F L, et al. Grade and investigation method of tobacco diseases and insect pests: GB/T 23222—2008[S].
[17] 申莉莉,宋丽云,龚明月,等. 烟草黄瓜花叶病毒亚组Ⅰ分离物生物学特性[J]. 中国烟草科学,2021,42(6):30-35.
SHEN L L, SONG L Y, GONG M Y, et al. Biological characteristics of tobacco cucumber mosaic virus subgroup I isolates[J]. China Tobacco Science, 2021, 42(6): 30-35.
[18] 曲潇玲,宋丽云,张道顺,等. 转录因子NbNAC062及其纳米药物对PVY侵染的抑制作用[J]. 中国烟草科学,2023,44(2):35-42.
QU X L, SONG L Y, ZHANG D S, et al. Inhibitory effects of transcription factor NbNAC062 and its nanomedicine on PVY infection[J]. China Tobacco Science, 2023, 44(2): 35-42.
[19] 张帅. 我国主要烟区PVY株系分化研究[D]. 北京:中国农业科学院,2010.
ZHANG S. Research on PVY strain differentiation in major tobacco areas in my country[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.
[20] 卢训,丁铭,方琦,等. 马铃薯Y病毒云南昭通烟草分离物的检测及年度间差异比较[J]. 植物保护,2013,39(3):56-60.
LU X, DING M, FANG Q, et al. Detection of potato virus Y isolates from Yunnan Zhaotong tobacco and comparison of annual differences[J]. Plant Protection, 2013, 39(3): 56-60.
[21] 万秀清,乔婵,赵淑娟,等. 黑龙江烟区烟草马铃薯Y病毒株系的分子鉴定[J]. 烟草科技,2015,48(10):13-18,25.
WAN X Q, QIAO C, ZHAO S J, et al. Molecular identification of tobacco and potato virus Y strains in Heilongjiang tobacco-growing areas[J]. Tobacco Science and Technology, 2015, 48(10): 13-18, 25.
[22] 赵雪君. 四川省部分烟区蚜传病毒种类鉴定及LAMP体系的建立[D]. 重庆:西南大学,2015.
ZHAO X J. Identification of aphid-borne virus species in some tobacco areas of Sichuan Province and establishment of LAMP system[D]. Chongqing: Southwest University, 2015.
[23] 夏范讲,郭玉双,贾蒙骜. 贵州烟田马铃薯Y病毒优势株系全序列克隆及系统进化分析[J]. 中国农业大学学报,2017,22(7):34-39.
XIA F J, GUO Y S, JIA M A. Full sequence cloning and phylogenetic analysis of dominant potato virus Y strains in Guizhou tobacco fields[J]. Journal of China Agricultural University, 2017, 22(7): 34-39.
[24] 迟云化. 贵州省烟草主产区马铃薯Y病毒株系划分及致病力分析[D]. 泰安:山东农业大学,2019.
CHI Y H. Classification and pathogenicity analysis of potato virus Y strains in the main tobacco producing areas of Guizhou Province[D]. Tai’an: Shandong Agricultural University, 2019.
[25] 李思佳. 湖南烟草马铃薯Y病毒的检测与变异分析[D]. 长沙:湖南农业大学,2019.
LI S J. Detection and mutation analysis of Hunan tobacco and potato virus Y[D]. Changsha: Hunan Agricultural University, 2019.
[26] ANDRIANIFAHANANA M, LOVINS K, DUTE R, et al. Pathway for phloem-dependent movement of pepper mottle potyvirus in the stem of[J]. Phytopathology, 1997, 87(9): 892-898.
[27] WAIGMANN E, UEKI S, TRUTNYEVA K, et al. The ins and outs of nondestructive cell-to-cell and systemic movement of plant viruses[J]. Critical Reviews in Plant Sciences, 2004, 23(3): 195-250.
[28] WAN J, CABANILLAS D G, ZHENG H, et al. Turnip mosaic virus moves systemically through both phloem and xylem as membrane-associated complexes[J]. Plant physiology, 2015, 167(4): 1374-1388.
[29] 孙燕霞,张献军,刘兰伟,等. 高温激活RNA沉默介导的心叶烟抗病毒防御反应[J]. 植物病理学报,2008(1):58-63.
SUN Y X, ZHANG X J, LIU L W, et al. Antiviral defense response ofmediated by high temperature-activated RNA silencing[J]. Plant Physiology Journal, 2008(1): 58-63.
Identification of Potato Virus Y Strains and System Spreading Characteristics in Qingdao Tobacco-growing Areas
GUO Guangyao1, SONG Liyun1,2*, JIANG Lianqiang3, SHEN Guangcai4, ZHANG Fuqiang4, DONG Wenfeng1, HE Qingyun1, SHEN Lili1*
(1. Tobacco Research Institute of CAAS, Qingdao 266101, China; 2. College of Agriculture and Forestry Science and Technology, Weifang Vocational College, Weifang Shandong 262737, China; 3. Liangshan Prefecture Company of Sichuan Tobacco Company, Xichang, Sichuan 615000, China; 4. Baoshan Company of Yunnan Tobacco Company, Baoshan, Yunnan 678000, China)
To clarify the occurrence, molecular evolution and system conduction characteristics of potato virus Y, which causes vein necrosis and mosaic leaves in Qingdao experimental field. The prevalence of virus disease in Qingdao experimental field was determined by viral disease phenotype, incidence rate and disease index; MEGA7 was used as a phylogenetic tree to identify the strains of PVY Qingdao isolate; qRT-PCR, western blotting and PVY-GFP were used to clarify the conduction path of PVY-infected plants; diseased leaves were sampled from different leaf positions and disease symptoms, and the relative content ofmRNA was used to clarify the viral content of leaves with obvious symptoms and latent symptoms; the CP content of the three viruses when TMV, CMV, and PVY infected alone, mixed with the two, and mixed with the three were detected to clarify the interference or synergistic effects of the viruses mixed infection. The results showed that PVY mixed seriously with TMV and CMV infection in the maturity stage, and the PVY isolate was an N:O strain, which did not break through the resistance of thegene. In the early stage of infection, the virus enters the stem from the inoculated leaf along the veins, and when it begins to transport in two directions, it first moves to the root, and then reaches the seedling tip; then spreads to the upper leaves, and then slowly moves to the lower leaves; finally, it continues to transport to the new parts at both ends as the tobacco plant grows. The recessive symptoms of the upper leaves were obvious in the mid-infection stage, and the symptoms of diseased leaves were positively correlated with the virus concentration. In the middle and late stages of the tobacco field, PVY is mixed with TMV and CMV, and the interference and synergy between viruses lead to complex and changeable symptoms. The research results will help improve the accuracy of the variety resistance identification test and the target of the drug efficacy test.
potato virus Y; strain identification; system transmission; disappeared symptom; mixed infection
S435.72
A
1007-5119(2023)06-0059-10
烟草行业烟草病虫害监测与综合治理重点实验室揭榜挂帅项目(KLTPMIMT2022-02);四川省烟草公司凉山州公司科技项目(SCYC202311)
郭光耀(1998-),男,硕士研究生,主要从事病毒学研究。E-mail:1419332912@qq.com*通信作者。E-mail:宋丽云,jiayoulily2009@126.com;申莉莉,shenlili@caas.cn
2023-07-26
2023-11-24
10.13496/j.issn.1007-5119.2023.06.009
