桂郁金多糖结构表征及其体外抗氧化活性研究
2024-01-29严淑昕钱少林王雪盈陆芽春桂林理工大学广西桂林541000
关 媛,严淑昕,钱少林,王雪盈,陆芽春,李 霞(桂林理工大学,广西 桂林 541000)
郁金是郁金属植物温郁金、姜黄、广西莪术的干燥块根[1],它及其所含生物活性成分可调控多种凋亡蛋白、炎症因子、酶和非酶抗氧化剂[2]。该植物性寒,归肝、心、肺经,具有活血止痛、行气解郁、癫痫痰闭、利胆退黄等功效[3],其提取物具有抗炎、抗菌、抗抑郁、抗肿瘤、免疫调节等功能[4]。
机体氧化应激会导致皮肤衰老、免疫功能下降、内分泌紊乱、肠炎等[5-6]风险。桂郁金中富含多糖类成分,具有降血糖[7]、抗脂质过氧化、抗凝血活性[8],但目前对该类成分分离纯化、结构、活性等方面的研究较少。Xu 等[9]通过水提法得到莪术多糖,能加快糖尿病小鼠的创面收缩,促进皮肤再生。Dong 等[10]从莪术中提取多糖,能提高小鼠抗免疫调节能力,具有抑制肿瘤作用。侯敏娜等[11]以姜黄郁金为原料,研究了它对DPPH、ABTS 自由基的清除能力。本实验从桂郁金中分离得到2 种多糖,初步表征其结构特征,研究其体外抗氧化活性,旨在为开发新型天然抗氧化剂提供依据。
1 材料
1.1 试剂与药物 浓硫酸(批号210916,纯度95.0% ~98.0%)、氨基磺酸(批号210205,纯度≥99.5%)、七水合硫酸亚铁(批号161012,纯度99.0% ~101.0%)、磷酸氢二钠(批号180619,纯度≥99.0%)(汕头市西陇科学股份有限公司); 抗坏血酸[批号J2120100,阿拉丁试剂(上海)有限公司,纯度≥99.0%]; 3,5-二硝基水杨酸(批号RH249811,纯度98%)、铁氰化钾(批号S61033,纯度98%)(上海源叶生物科技有限公司); 1,1-二苯基-2-三硝基苯肼(DPPH,批号W3008E46572,美国Sigma 公司); 其他试剂均为分析纯。桂郁金(批号160401,产地广西钦州,广西南宁生源中药饮片责任有限公司),经桂林理工大学副研究员李静鉴定为广西莪术Curcuma Kwangsiensis。
1.2 仪器 SQP 电子天平 (德国 Sartorius 公司);ALPHA1-2 LD 型冷冻干燥机 (德国Martin Christ 公司);Nicolet iS 10 型傅里叶红外变换光谱仪(上海亚荣生化仪器厂); YK722PC 型紫外可见分光光度计(北京瑞利分析仪器有限公司); XD-5210A 型旋转蒸发仪、YJD20D-GL 型十功能自动煎药机(上海贤德实验仪器有限公司); 98-1-B型电子调温电热套(天津市泰斯特仪器有限公司); DL-5-B 型大型离心机(上海安亭科学仪器厂); BT100-2J 型恒流泵(保定兰格恒流泵有限公司)。
2 方法
2.1 多糖制备 参考文献[12-13]报道,将桂郁金与75%乙醇以1 ∶20 比例浸泡过夜,电热套加热5 h 以去除脂溶性杂质。乙醇提取后的药材于通风处晾晒至干燥后,与蒸馏水以1 ∶16 比例在100 ℃下提取3 h,共2 次。旋转蒸发仪浓缩后,加入无水乙醇至终体积分数为60%,静置24 h后4 000 r/min 离心15 min,收集沉淀,蒸馏水溶解,冷冻干燥,得到粗多糖,取2 g 至200 mL 蒸馏水中溶解,得到10 mg/mL溶液,在-20 ℃下冷冻24 h 后4 ℃下解冻,8 000 r/min 离心10 min,取上清,采用DEAE52 柱层析进行分离,蒸馏水洗脱得到中性糖部分WPCK-N,0.7 mol/L NaCl 洗脱得到酸性糖部分WPCK-A。
2.2 理化性质测定 以葡萄糖为对照品,采用苯酚-硫酸法测定总糖含量[14],取1 mL 0.1 g/L 样品溶液至试管中,加入0.5 mL 6%苯酚溶液、2.5 mL 浓硫酸,振荡,沸水浴反应10 min,于490 nm 波长处测定吸光度。以半乳糖醛酸为对照品,采用间羟基联苯法检测糖醛酸含量[15],在试管中依次加入400 μL 0.1 g/L 样品溶液、40 μL 氨基磺酸、2.5 mL 浓硫酸,振荡摇匀,沸水浴20 min,冷却至室温后加入40 μL 间羟基联苯试剂,室温反应15 min,于525 nm波长处测定吸光度。以牛血清白蛋白(BSA)为对照品,采用考马斯亮蓝法测定蛋白含量。采用3,5-二硝基水杨酸法测定还原糖含量[16],取1 mL 样品溶液,加入1 mL 蒸馏水、1.5 mL DNS,沸水浴5 min,冷却至室温后定容至25 mL,于540 nm 波长处测定吸光度。
2.3 单糖组成分析 以1-苯基3-甲基5-吡唑酮(PMP)进行样品衍生化。称取10 mg 样品,5 mL 3 mmol/L 三氟乙酸在105 ℃下水解6 h,加入100 μL 0.3 mmol/L 氢氧化钠、0.3 mmol/L PMP,在70 ℃下放置1 h,冷却至室温,100 μL 0.3 mmol/L 盐酸中和混合物,氯仿提取3 次,采用HPLC 法对水相进行分析,条件为安捷伦XDB-C18色谱柱(4.6 mm×250 mm,5 μm); 流动相0.05 mmol/L 磷酸盐缓冲液溶液(A,pH=6.8)-83%乙腈(B),梯度洗脱(0 ~6 min,90% ~85%A; 7~13 min,85% ~80%A; 30~36 min,65% ~60% A; 60 ~67 min,40% ~35% A); 体积流量1 mL/min; 柱温 30 ℃; 检测波长 254 nm; 进样量10 μL[16]。
2.4 多糖分子量测定 采用高效凝胶渗透色谱仪,凝胶柱选用TSK-gel G-4000PWxl; 洗脱液0.02 mmol/L 磷酸二氢钾溶液; 体积流量0.5 mL/min; 检测器Waters2414 示差折光检测器; 不同分子量葡聚糖(T1000、T500、T70、T40、T10、T5)校准色谱柱; 柱温35 ℃[17-18]。
2.5 红外光谱测定 取1 mg 样品,于玛瑙研钵中与100 mg KBr 混合,在红外烘灯下烘干研磨,取少量粉末在9.81 GPa 压力下压30 s,制成薄片,红外光谱仪在4 000 ~500 cm-1波数范围内进行红外光谱扫描[19]。
2.6 XRD 测定 参考文献[20]报道,采用X 射线粉末衍射仪对样品进行测定,条件设置为管压40 kV; 管流30 mA; 数据采集范围5 ~80°; 步幅0.02°; 计数时间0.78 s/step。
2.7 扫描电镜测定 取样品粉末适量,通过导电胶粘附于扫描电镜样品台上,喷金处理20 s,在扫描电子显微镜下观察外貌形态,放大倍数为1 000,并进行拍照。
2.8 体外抗氧化活性研究 以抗坏血酸为阳性对照,样品浓度分别为0.2、0.4、0.8、1.6、3.2 mg/mL,平行3 次。
2.8.1 DPPH 自由基清除能力 参考文献[21]报道,将50 μL 不同浓度样品溶液与200 μL 0.004%DPPH 溶液(无水甲醇溶解)混合反应,在37 ℃下避光反应1 h,12 000 r/min 离心5 min,于517 nm 波长处测定吸光度A1; 用无水甲醇代替DPPH 溶液,测定吸光度A2; 用蒸馏水代替样品溶液,测定吸光度A0,计算DPPH 自由基清除率,公式为清除率= [1- (A1-A2)]×100%。
2.8.2 羟基自由基清除能力 参考文献[22-23]报道,将50 μL 样品溶液与100 μL 9 mmol/L 硫酸亚铁、100 μL 9 mmol/L水杨酸(无水乙醇溶解)混合,加入100 μL 过氧化氢(8.8 mmol/L),在25 ℃下反应30 min,12 000 r/min离心5 min,于510 nm 波长处测定吸光度A1; 用蒸馏水代替过氧化氢,测定吸光度A2; 用蒸馏水代替样品溶液,测定吸光度A0,计算羟基自由基清除率,公式为清除率=[1- (A1-A2)/A0]×100%。
2.8.3 铁离子还原能力 参考文献[24]报道,将1.0 mL 样品溶液与1.0 mL 1%铁氰化钾溶液混合,在50 ℃下反应20 min,冷却至室温后,加1.0 mL 10% 三氯乙酸,5 000 r/min 离心15 min,取2.5 mL 上清液与0.15 mL 0.1%氯化铁混合,于700 nm 波长处测定吸光度。
3 结果
3.1 多糖组成 表1 显示,WPCK-N 主要由葡萄糖组成,还含有少量甘露糖、半乳糖,而WPCK-A 主要由半乳糖、葡萄糖组成,还含有少量甘露糖、阿拉伯糖、鼠李糖、木糖、岩藻糖; 两者酸性单糖含量均较低。综上所述,从桂郁金中提取的多糖大多为中性糖。

表1 桂郁金多糖组成分析
3.2 红外光谱 图1 显示,WPCK-N 在3 410 cm-l附近的宽拉伸峰对应于O-H 的拉伸振动,2 920 cm-1附近具有弱C-H拉伸振动的特征吸收,1 400 ~1 000 cm-1分别由O-H、C-H伸缩振动导致,678 cm-1为长链烷烃骨架振动吸收峰,而WPCK-A 的C=O 吸收峰集中在1 640 cm-1处,主要是羧基的C=O 吸收峰,峰的强度和尖锐程度可能体现羧基含量;在3 430 cm-1附近的谱带强度为O-H 的伸展频率,此处强度较大; 吸收峰集中于1 120.40 cm-1,在1 600 ~600 cm-1范围内的峰型更清晰集中; 与WPCK-N 相比,WPCK-A 吸收峰主要集中在1 419.06 cm-1处,1 200 ~950 cm-1附近峰归属于C-O-H 变角振动或吡喃糖环中C-O-C 伸缩振动(1 100~1 200 cm-1附近为吡喃糖环上C-O 吸收峰,1 070、1 023 cm-1附近C-O-H 变角振动)。

图1 桂郁金多糖红外光谱图
3.3 扫描电镜 图2 显示,WPCK-N 主要呈片状,而WPCK-A 主要由块状和少许的片状组成,两者表面都比较粗糙。研究表明,中性、酸性多糖外貌形状差异可能和所带电荷不同有关[25],而WPCK-N 整体上外貌形状比WPCK-A 小,可能与多糖本身性质有关。

图2 桂郁金多糖扫描电镜图(HE,×1 000)
3.4 XRD 分析 图3 显示,2 种多糖的最高峰都出现在20°左右,WPCK-N 在21.32°处有1 个较为宽的衍射峰,而WPCK-A 在20.29°处有1 个不明显的包峰,其他范围只有少数弱衍射峰存在,并且两者均为无定形结构。

图3 桂郁金多糖XRD 图
3.5 体外抗氧化活性研究
3.5.1 DPPH 自由基清除能力 图4 显示,在0 ~3.2 mg/mL质量浓度范围内2 种多糖均具有DPPH 自由基清除能力,并呈剂量依赖性,但均小于抗坏血酸; 为3.2 mg/mL时清除作用最强,清除率分别为56.78%、32.22%,以WPCK-N 更明显。另外,相比绵麦冬中性糖[26]、北五味子中性糖[27]、人参果[28]等植物中性糖,WPCK-N 的DPPH自由基清除能力较强。
3.5.2 羟基自由基清除能力 图5 显示,在0~3.2 mg/mL质量浓度范围内,2 种多糖对羟基自由基的清除率逐步上升,并具有剂量依赖性; 为0.8 mg/mL 后增长程度趋于平缓; WPCK-A 质量浓度为3.2 mg/mL 时清除作用最强,清除率达23.45%。Chaiwong 等[29]证实,低分子量多糖呈现出较好的羟基自由基清除率,而WPCK-N 分子量较高,为2.88×105Da,WPCK-A 分子量仅为1.39×105Da,故推测可能是后者效果更好的原因。

图5 桂郁金多糖对羟基自由基的清除能力
3.5.3 铁离子还原能力 刘宏等[30]报道,还原能力与多糖体外抗氧化能力有一定联系,多糖还原性的吸光度越高,其抗氧化能力越强。图6 显示,随着铁离子浓度升高,抗坏血酸总还原能力变化不大,但总体仍呈上升趋势; 2 种多糖的还原能力随着其质量浓度升高而逐渐增加,以WPCK-N更明显。综上所述,桂郁金多糖具有将Fe3+还原成Fe2+的能力,从而增强其体外抗氧化活性。
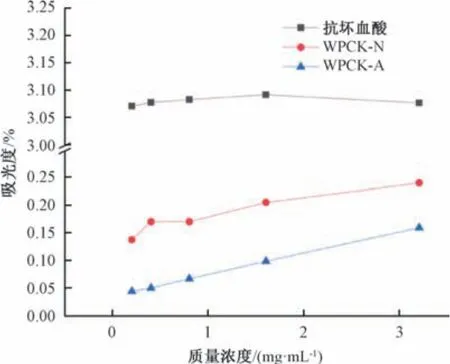
图6 桂郁金多糖铁离子还原能力
4 讨论
倪力军[31]、Chaiwong 等[29]研究表明,多糖单糖组成、含量、分子量会影响其体外抗氧化活性,含有葡萄糖的多糖抗氧化活性明显高于不含葡萄糖者。实验结果显示,WPCK-N 的DPPH 自由基清除能力及铁离子还原能力比WPCK-A 更明显,推测可能与葡萄糖含量差异有关(WPCK-N 为98.3%,WPCK-A 为21.4%),但羟基自由基清除作用恰好相反,低分子量的WPCK-A 呈现出较好的清除能。前期报道,中性糖、酸性糖存在活性差异,胡彦波[32]对薇菜多糖进行分离纯化,发现中性糖DPPH 清除率、还原能力均高于酸性糖,但羟基自由基抗氧化能力略弱于后者,与本实验结果一致。黄妮等[26]发现,绵麦冬多糖有较强的抗氧化活性,其中性糖的DPPH 自由基清除活性低于酸性糖,羟基自由基活性更高。程丽敏等[33]以金花葵茎可溶性糖为研究对象,发现其酸性糖抗氧化活性强于中性糖,该差异可能与多糖本身性质有关。
本实验以热水提取、乙醇沉淀的方法提取得到粗多糖,再利用DEAE-52 纤维素分离得到桂郁金中的中性多糖(WPCK-N)和酸性多糖 (WPCK-A)。对 WPCK-N 和WPCK-A 进行了理化性质检测和体外抗氧化分析。结果显示WPCK-N 主要由葡萄糖组成,WPCK-A 主要由半乳糖、葡萄糖组成,半乳糖醛酸和葡糖糖醛酸的所占比例较低,与红外光谱分析结果一致。扫描电镜进一步显示,WPCK-N主要是片状,WPCK-A 主要是块状和少许的片状。体外抗氧化结果表明,桂郁金多糖具有清除自由基(DPPH 和羟基自由基)的能力和良好的还原能力,且呈浓度依赖性。其中WPCK-N 的DPPH 自由基清除能力较强,质量浓度为3.2 mg/mL 时,清除率最高,达到56.78%。WPCK-A 在质量浓度为3.2 mg/mL 的羟基自由基清除率最高为23.45%。WPCK-N 的总还原能力较WPCK-A 明显。上述结果表明,桂郁金多糖有较好的抗氧化活性,具有开发为新型天然抗氧化剂及功能性食品的潜力,并为今后相关研究提供参考思路。
