中药口服液体制剂工艺过程中质量标志物传递规律及关键环节优化策略
2024-01-29康朝霞姜梦华黄一平朱法根邵建国贾晓斌
康朝霞,孙 娥*,姜梦华,杨 挡,汪 晶,黄一平*,李 超,朱法根,邵建国,封 亮,贾晓斌
(1.南京中医药大学附属中西医结合医院,江苏省中医药研究院,国家中医药管理局中药口服释药系统重点研究室,江苏 南京 210028; 2.济川药业集团有限公司,江苏省儿科中药与特色制剂重点实验室,江苏 泰兴 225400; 3.中国药科大学中药学院,江苏 南京 211198)
中药口服液体制剂(如合剂、口服液、糖浆剂等)具有吸收快、生物利用度高、服用方便等特点,但其制剂工艺面临有效成分损失的瓶颈问题。蒲地蓝消炎口服液作为中成药大品种之一,广泛用于治疗呼吸系统疾病[1-2],但其前处理阶段和制剂工艺也会损失成分,在生产过程中黄芩苷、菊苣酸从饮片到制剂的转移率分别仅为34%、11%[3-4]。因此,本实验以蒲地蓝消炎口服液为例,考察有效成分含量在工艺过程中的变化,探寻其传递规律、损失的关键环节,并提出相应的增溶技术和优化策略,以期为提升其他中药口服液体制剂的有效性、内在质量奠定基础[5]。
1 材料
Waters 2695 型高效液相色谱仪(美国Waters公司); MT5 型电子分析天平(百万分之一,瑞士Mettler-Toledo 公司); BT125D 型电子分析天平[赛多利斯科学仪器(北京)有限公司]; DFT-50型粉碎机(上海新诺仪器集团有限公司); KH-300TDB 型超声波清洗器(昆山禾创超声仪器有限公司); TD10002A 型电子分析天平(天津天马衡基仪器有限公司); DTL-21B 型电陶炉(合肥荣事达电子电器集团有限公司); pH-10 型手持式PH计(上海力辰邦西仪器科技有限公司); RE52CS-1型旋转蒸发仪(上海亚荣生化仪器厂); 80-2 型电动离心机(金坛医疗仪器有限公司); HH-S4 型恒温水浴锅(江苏金怡仪器科技有限公司); TD5.5型台式大容量高速离心机(上海卢湘仪离心机仪器有限公司)。
腺苷(批号110879-201703)、菊苣酸(批号111752-201703)、紫堇灵(批号111734-201602)、黄芩苷(批号110715-201821)、汉黄芩素(批号111514-201706)对照品均购自中国食品药品检定研究院。蒲公英、苦地丁、板蓝根、黄芩(批号190112、190118、190201、190201)均由济川药业集团有限公司提供,经中国药科大学王龙副教授鉴定为正品。甜菊糖苷(批号ASL613,上海源叶生物科技有限公司); 氢氧化钠(批号20180601,西陇科学股份有限公司); 药用乙醇 ( 批号200525130B,南京化学试剂股份有限公司)。甲醇为色谱纯(美国Tedia 公司); 水为娃哈哈纯净水。
2 方法
2.1 对照品溶液制备 精密称取腺苷、菊苣酸、紫堇灵、黄芩苷、汉黄芩素对照品适量,50%甲醇溶解,制成贮备液(每1 mL 分别含腺苷0.94 mg、菊苣酸2.04 mg、紫堇灵0.50 mg、黄芩苷2.02 mg、汉黄芩素0.40 mg),分别精密吸取适量,置于5 mL 量瓶中,50%甲醇定容,制成每1 mL 分别含腺苷37.68 μg、菊苣酸407.80 μg、紫堇灵19.88 μg、黄芩苷1.21 mg、汉黄芩素7.90 μg 的溶液,即得。
2.2 色谱条件 参考文献 [6]报道,Agilent XBridge C18色谱柱(4.6 mm×250 mm,5 μm); 流动相甲醇-0.1%磷酸,梯度洗脱(0~15 min,5% ~15%甲醇; 15 ~30 min,15% 甲醇; 30 ~35 min,15% ~25% 甲醇; 35 ~70 min,25% ~50% 甲醇;70~90 min,50% ~80%甲醇,90 ~100 min,80% ~5%甲醇); 体积流量1 mL/min; 柱温30 ℃; 检测波长280 nm; 进样量10 μL。色谱图见图1。

图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
2.3 供试品溶液制备
2.3.1 饮片 蒲公英、苦地丁、板蓝根、黄芩粉碎后过4 号筛,分别称取1.0 g,置于锥形瓶中,精密加入50%甲醇50 mL,称定质量,超声提取30 min,静置至室温,50%甲醇补足减失的质量,过0.45 μm 微孔滤膜,即得(编号S0)。
2.3.2 3 味药合提 取蒲公英500 g、板蓝根188 g、苦地丁125 g,加水煎煮2 次,每次1 h,滤过,合并滤液,浓缩至相对密度为1.13 ~1.15(60~70 ℃)的清膏,加乙醇使含醇量为75%,静置48 h,滤过,滤液回收乙醇,加水至500 mL,放置48 h,滤过,滤液用10%NaOH 溶液调pH 值至6.5,得到流浸膏。按照相关制备工艺,收集3味药提取液(S1)、3 味药浓缩液(S2)、3 味药醇沉上清液(S3)、3 味药回收乙醇后流浸膏(S4),分别精密量取0.5 mL,置于10 mL 量瓶中,50%甲醇定容至刻度,0.45 μm 微孔滤膜过滤,即得。
2.3.3 黄芩单提 取黄芩188 g,投入沸水中煎煮2 次,每次先煎煮10 min,用10% NaOH 溶液调pH 值至6.5,再煎煮1 h,滤过,合并滤液,浓缩至相对密度为1.08 ~1.11 (60 ~70 ℃),调pH 值至6.5,加乙醇使含醇量达50%,静置24 h,滤过,滤液回收乙醇,加1 倍量水混匀,滤过,滤液在80 ℃下保温,盐酸调pH 值至1.5,保温0.5 h,放置24 h,滤过,沉淀物用70% 乙醇洗至中性,得粗品,加500 mL 水,在80 ℃下保温溶解,10%NaOH 溶液调pH 值至6.5,得到流浸膏。按照相关制备过程,收集黄芩提取液(S5)、黄芩浓缩液(S6)、黄芩醇沉并回收乙醇后流浸膏(S7)、黄芩加水稀释后滤液(S8)、黄芩苷加水溶解(S9)、黄芩苷调pH 后滤液(S10),分别精密量取0.5 mL,置于10 mL 量瓶中,50% 甲醇定容至刻度,0.45 μm 微孔滤膜过滤,即得。
2.3.4 制剂阶段 将“2.3.2” “2.3.3” 项下药液合并,在2 ~8 ℃下冷藏静置,滤过,离心,滤过,加入0.5% 甜菊糖苷,滤过,定容至1 000 mL,分装、灭菌得到成品。按照相关制备过程,收集两部分合并药液 (S11)、冷藏静置后滤液(S12)、离心后滤液(S13)、加甜菊糖苷后滤液(S14)、灭菌后成品 (S15),分别精密量取0.5 mL,置于10 mL 量瓶中,50% 甲醇定容至刻度,0.45 μm 微孔滤膜过滤,即得。
3 结果
3.1 质量标志物含量测定
3.1.1 线性关系考察 分别精密吸取贮备液0.1、0.2、0.4、0.6、0.8、1.0 mL,置于1.0 mL 量瓶中,50%甲醇定容,滤过,在“2.2” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表1,可知各质量标志物在各自范围内线性关系良好。

表1 各质量标志物线性关系Tab.1 Linear relationships of various quality markers
3.1.2 精密度试验 取对照品溶液10 μL,在“2.2” 项色谱条件下进样测定6 次,测得腺苷、菊苣酸、紫堇灵、黄芩苷、汉黄芩素峰面积RSD分别为0.89%、0.98%、0.78%、0.93%、0.96%,表明仪器精密度良好。
3.1.3 稳定性试验 取供试品溶液(S14)适量,室温下于0、4、8、12、24 h 在“2.2” 项色谱条件下进样测定,测得腺苷、菊苣酸、紫堇灵、黄芩苷、汉黄芩素峰面积RSD 分别为1.5%、2.1%、0.82%、0.97%、2.6%,表明溶液在24 h 内稳定性良好。
3.1.4 重复性试验 精密吸取供试品溶液(S14)1.0 mL,共6 份,置于10 mL 量瓶中,50%甲醇定容,摇匀,0.45 μm 微孔滤膜过滤,在“2.2” 项色谱条件下进样测定,测得腺苷、菊苣酸、紫堇灵、黄芩苷、汉黄芩素含量RSD 分别为2.1%、1.7%、0.54%、0.43%、1.9%,表明该方法重复性良好。
3.1.5 加样回收率试验 精密吸取供试品溶液(S14)0.5 mL,共6 份,置于10 mL 量瓶中,精密加入对照品溶液适量,50%甲醇定容至刻度,摇匀,0.45 μm 微孔滤膜过滤,在“2.2” 项色谱条件下进样测定,计算回收率。结果,腺苷、菊苣酸、紫堇灵、黄芩苷、汉黄芩素平均加样回收率分别 为 103.9%、102.4%、96.07%、99.81%、101.6%,RSD 分别为 2.1%、0.93%、1.1%、1.6%、2.6%。
3.2 质量标志物传递规律研究
3.2.1 3 味药合提 如表2、图2 所示,提取液到流浸膏过程中腺苷转移率分别为 66.11%、58.68%、44.56%、41.16%,损失率分别为7.42%、14.12%、3.40%; 紫堇灵转移率分别为72.06%、47.97%、30.15%、27.81%,损失率分别为24.09%、17.82%、2.34%; 菊苣酸转移率分别为79.01%、64.39%、47.18%、45.26%,损失率分别为14.62%、17.22%、1.91%,可知各成分主要在浓缩、醇沉环节损失,其中菊苣酸、腺苷损失率在醇沉环节较高,而紫堇灵损失率在热处理浓缩环节较高。
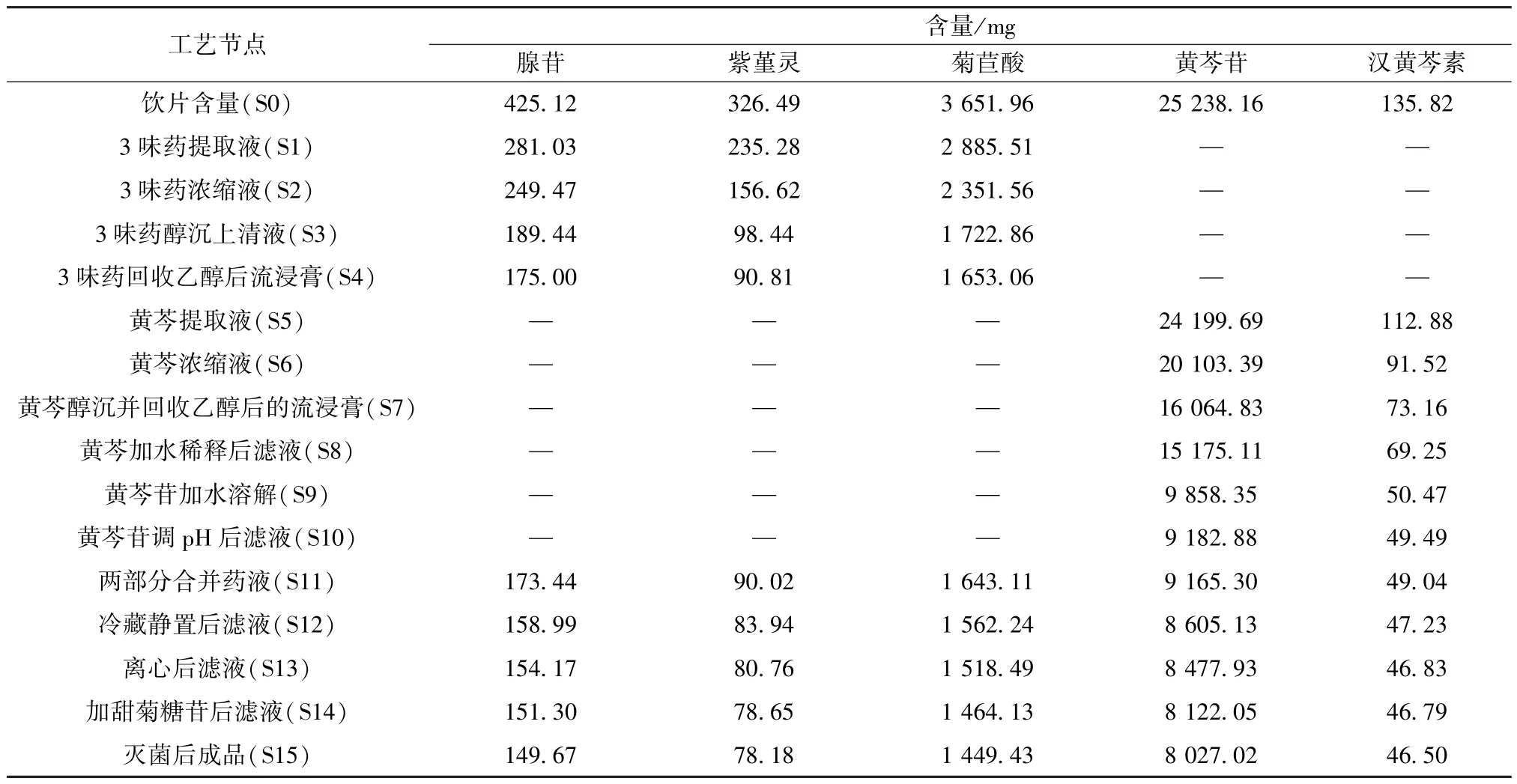
表2 各质量标志物含量测定结果Tab.2 Results of content determination of various quality markers
3.2.2 黄芩单提 如表2、图2 所示,黄芩从提取到黄芩苷调pH 后滤液环节黄芩苷转移率分别为95.89%、79.65%、63.65%、60.13%、39.06%、36.38%,损失率分别为 16.23%、16.00%、3.53%、21.07%、2.68%; 汉黄芩素转移率分别为83.11%、67.39%、53.86%、50.99%、37.16%、36.44%,损失率分别为15.72%、13.52%、2.88%、13.83%、0.72%,可知黄芩苷、汉黄芩素在浓缩热处理环节、醇沉精制除杂环节,以及黄芩单提独有的酸沉得到黄芩苷环节损失较大,并且黄芩苷在酸沉环节损失严重,损失率达21.07%。
3.2.3 制剂阶段 如表2、图2 所示,腺苷、紫堇灵、菊苣酸、黄芩苷、汉黄芩素转移率分别从40.80% 下降到34.52%,27.57% 下降到24.03%,44.99% 下降到39.08%,36.32% 下降到31.01%,36.11%下降到33.83%,其中冷藏静置环节损失较大,损失率分别为3.40%、1.86%、2.21%、2.22%、1.34%。
4 讨论与结论
本实验以蒲地蓝消炎口服液为例,系统分析其生产工艺过程中有效成分转移、损失规律,发现其损失主要集中在浓缩、醇沉环节,同时黄芩在酸沉环节也有较大损失,由于冷藏静置是制剂阶段损失相对较多的共性环节,故考虑通过筛选浓缩方式、优化精制除杂方法、pH 调节、包合技术等手段(图3)来提高质量标志物转移率,最终提升制剂有效性。
浓缩是持续加热的过程,菊苣酸等热不稳定成分可能会分解,故改变浓缩方式,优化浓缩过程中温度、压力等参数有助于保留上述成分。生产中常用的浓缩方式是常压浓缩、减压浓缩,前者适用于热稳定成分,而后者适用于热敏性或挥发性成分[7-8]。另外,反渗透浓缩、冷冻浓缩是新兴浓缩方法,前者优化膜种类和结构,可促进中药溶质与溶剂分离,而后者可通过调节冷冻温度、时间来促进不同溶质冰晶析出,从而实现浓缩分离[9-11]。
醇沉是当前中药口服液体制剂生产过程中主要的精制除杂方法,但部分活性成分会被除去而导致其转移率下降。醇沉效率受到醇沉物质浓缩液密度、温度、溶液pH、乙醇体积分数、醇沉时间、静置温度、加醇速度,搅拌速度、搅拌时间等因素影响,故优化醇沉工艺有助于减少成分损失[12]。
黄芩苷、汉黄芩素是黄芩主要成分,两者损失集中在浓缩、醇沉、酸沉环节,其中酸沉是黄芩纯化的重点,药液浓度、酸沉pH、静置温度等参数均对其保留率有影响[13-17]。另外,黄芩经碱提、醇沉后再经酸沉得黄芩苷粗品,工艺复杂,耗时长,操作繁琐,而由碱提改为直接水提时可减少酸沉工序静置步骤,节约时间,提高生产效率。
冷藏静置是去除杂质、保证澄明度而进一步提高中药口服液体制剂稳定性的过程,冷藏静置环节由于温度降低,可能会影响有效成分溶解度,故需识别因低温而导致溶解度降低的成分,并对其进行增溶,从而保证制剂的货架期。另外,中药口服液体制剂主要通过调节pH、原生多糖增溶技术(黄芩多糖)、增溶剂、表面活性剂、包合等技术增溶[18-19]。
中药口服液体制剂成分复杂,同时存在多种极性化合物,不论是药液精制除杂还是配液所用增溶方法,均需根据处方中成分理化性质和临床需求来选择合适的纯化手段,以期提升中药口服液体制剂转移率。本实验以蒲地蓝消炎口服液为例,立足中药口服液体制剂范畴,提出制剂工艺中共性环节有效性改善的研究策略,有助于其内在质量的提升。
