葫芦素B 纳米混悬剂制备及其体内药动学研究
2024-01-29薛晓菲潘思影
陈 容,田 莉,薛晓菲,潘思影,杨 雪,田 青
(1.郑州澍青医学高等专科学校,河南 郑州 450064; 2.新乡医学院,河南 新乡 453002)
葫芦素B 是从葫芦科植物中提取出的一种四环三萜类化合物,具有抗炎、降血糖、保肝、抗肿瘤等活性[1-3],对卵巢癌、乳腺癌、宫颈癌等妇科疾病也具有较强治疗作用[4-6],有着开发成妇科新药的潜力,但该成分溶解度仅为44.68 μg/mL,严重影响药物溶出速率、溶出度; 油水分配系数logP为2.46[7],表明其脂溶性较高,暂未见首关效应报道,然而生物利用度不足5%[8],故提高其溶解度、溶出速率、溶出度是改善口服吸收的关键,从而有利于临床推广。目前,已有葫芦素B 固体分散体[8]、磷脂复合物[9]、纳米结构脂质载体[10]、自微乳等[11]报道,但固体分散体存在析晶现象,磷脂复合物存在稳定性差等问题,纳米结构脂质载体、自微乳制备工艺复杂。
纳米混悬剂是在稳定剂作用下通过制剂技术使中药活性成分形成一种亚微胶体分散体系,无需脂质载体,具有载药量高、制备工艺简单等优势,可有效提高溶解度,促进药物溶出、体内吸收[12-14]。因此,本实验制备葫芦素B 纳米混悬剂,并考察其体内药动学,以期为相关研究提供新思路,也为临床提供新型相关制剂。
1 材料
SQP 型电子分析天平 [赛多利斯科学仪器(北京)有限公司]; YC-1800 型实验室低温喷雾干燥机(上海雅程仪器设备有限公司); 安捷伦1200 型高效液相色谱仪(美国安捷伦公司); Axia ChemiSEM 型扫描电镜(北京欧波同光学技术有限公司); LC-DMS-S 型加热磁力搅拌器(力辰科技仪器有限公司); G2 Autoplus/Autofill 型溶出仪(美国Hanson 公司); TP-300 型均质机(无锡迈拓环保科技有限公司); HPT-16 型氮吹仪(上海沪析实业有限公司); NKT-N9H 型粒度分析仪(山东耐克特分析仪器有限公司)。
葫芦素B 原料药(批号201025,纯度96.0%,湖北实顺生物科技有限公司); 葫芦素B 对照品(批号20200410,纯度98.5%,上海迈瑞尔生化科技有限公司); 雌酚酮对照品(批号20200915,纯度99%,上海迈瑞尔化学技术有限公司)。微粉硅胶(批号20190225,上海迈峰硅胶有限公司); 羟丙基纤维素(批号191026,山东戈麦斯化工有限公司); 十二烷基硫酸钠(批号20181026,苏州源泰润化工有限公司)。
SD 大鼠,雌雄兼具,体质量 (220±20)g,购自河南省动物实验中心,动物生产许可证号SCXK (豫)2020-0001。
2 方法与结果
2.1 纳米混悬剂制备 参考文献[11,13]报道,取50 mg 葫芦素B 原料药,溶于10 mL 无水乙醇中,作为有机相; 取稳定剂适量,溶于50 mL 蒸馏水中,作为水相,加热至45 ℃,将有机相缓慢滴到水相中(搅拌速度800 r/min),搅拌20 min 后减压(45 ℃)旋转蒸发20 min,得混悬液,在80 MPa下循环均质数次,置于-20 ℃冰箱中使体系快速降温[15],补加蒸馏水至50 mL,取出,过0.45 μm 微孔滤膜,即得。
2.2 葫芦素B 含量测定 采用HPLC 法。
2.2.1 色谱条件 Agilent Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈-水(65 ∶35); 体积流量1.0 mL/min; 柱温35 ℃; 检测波长228 nm; 进样量10 μL。
2.2.2 线性关系考察 取葫芦素B 对照品10.40 mg,置于10 mL 量瓶中,乙腈溶解定容至刻度,得1.04 mg/mL 贮备液,流动相依次稀释至10.4、5.2、2.6、1.04、0.104、0.052 μg/mL,分别取10 μL,在“2.2.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=90.66X-10.43 (r=0.999 9),在0.052~10.4 μg/mL 范围内线性关系良好。
2.2.3 供试品溶液制备 取纳米混悬剂1 mL,置于50 mL 量瓶中,甲醇超声溶解后流动相定容,取2 mL 至10 mL 量瓶中,流动相定容至刻度,即得。
2.2.4 方法学考察 取纳米混悬剂1 份,按“2.2.3” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,测得葫芦素B峰面积RSD 为1.54%,表明该方法重复性良好。取供试品溶液1 份,于0、6、12、18、24、48 h在“2.2.1” 项色谱条件下进样测定,测得葫芦素B 峰面积RSD 为0.77%,表明溶液在48 h 内稳定性良好。取供试品溶液适量,在“2.2.1” 项色谱条件下进样测定6 次,测得葫芦素B 峰面积RSD为0.63%,表明仪器精密度良好。取纳米混悬剂0.5 mL,置于50 mL 量瓶中,按“2.2.3” 项下方法平行制备9 份供试品溶液,分为低、中、高3组,每组3 份,分别加入1.04 mg/mL 贮备液0.25、0.5、0.75 mL,在“2.2.1” 项色谱条件下进样测定,测得葫芦素B 平均加样回收率分别为98.54%、101.06%、100.89%,RSD 分别为0.36%、0.84%、0.70%。
2.3 粒径、Zeta 电位测定 取纳米混悬剂100 μL,蒸馏水稀释50 倍,混匀,测定粒径、Zeta 电位,平行3 次,取平均值。
2.4 处方优化 采用单因素试验。
2.4.1 稳定剂种类 固定葫芦素B 投药量50 mg,稳定剂与药物比例2.5 ∶1,均质压力80 MPa,均质次数10 次,考察稳定剂种类对粒径、PDI 的影响,结果见图1。由此可知,单用PVP K30、羟丙甲基纤维素、阿拉伯胶、十二烷基硫酸钠时粒径、PDI 较大; 当2 种稳定剂联用,即PVP K30+十二烷基硫酸钠(1 ∶1)、羟丙基纤维素+十二烷基硫酸钠(1 ∶1)、阿拉伯胶+十二烷基硫酸钠(1 ∶1)时粒径、PDI 较低,以羟丙基纤维素+十二烷基硫酸钠(1 ∶1)更明显,最终选择其作为稳定剂。

图1 稳定剂种类对粒径、PDI 的影响(n=3)Fig.1 Effects of stabilizer type on particle size and PDI(n=3)
2.4.2 稳定剂与药物比例 固定葫芦素B 投药量50 mg,稳定剂羟丙基纤维素+十二烷基硫酸钠(1 ∶1),均质压力80 MPa,均质次数10 次,考察稳定剂与药物比例对粒径、PDI 的影响,结果见图2。由此可知,在一定范围内随着稳定剂比例增加粒径、PDI 降低,但稳定剂比例过高时两者反而升高,可能是由于体系黏度增加所致,也可能与过多稳定剂附着在纳米粒表面有关,最终选择3 ∶1 作为稳定剂与药物比例。

图2 稳定剂与药物比例对粒径、PDI 的影响(n=3)Fig.2 Effects of stabilizer-drug ratio on particle size and PDI (n=3)
2.4.3 均质次数 固定葫芦素B 投药量50 mg,稳定剂羟丙基纤维素+十二烷基硫酸钠(1 ∶1),稳定剂与药物比例3 ∶1,均质压力80 MPa,考察均质次数对粒径、PDI 的影响,结果见图3。由此可知,在一定范围内随着均质次数增加粒径、PDI降低,但过多时(14 次)两者反而升高,可能是由于体系温度急剧升高所致,根据Ostwald 熟化理论,小粒径药物会发生溶解,而大粒径药物会进一步长大,导致其平均粒径增加、分布不均匀,最终选择12 次作为均质次数。
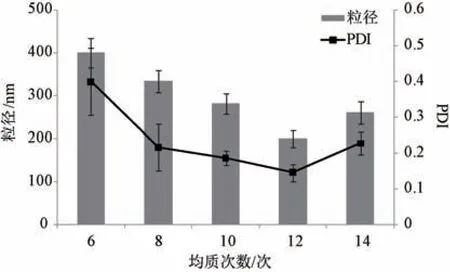
图3 均质次数对粒径、PDI 的影响(n=3)Fig.3 Effects of homogenization frequency on particle size and PDI (n=3)
2.5 验证试验 根据“2.4” 项下结果,确定最优处方为葫芦素B 投药量50 mg,稳定剂羟丙基纤维素+十二烷基硫酸钠(1 ∶1),稳定剂与药物比例3 ∶1,均质压力80 MPa,均质次数12 次。按上述优化工艺放大20 倍,并平行制备3 批样品,进行验证试验,结果见表1,可知粒径均在200 nm左右(图4),PDI 在0.140 左右,Zeta 电位在-32 mV 左右(图5),表明该工艺重复性良好。
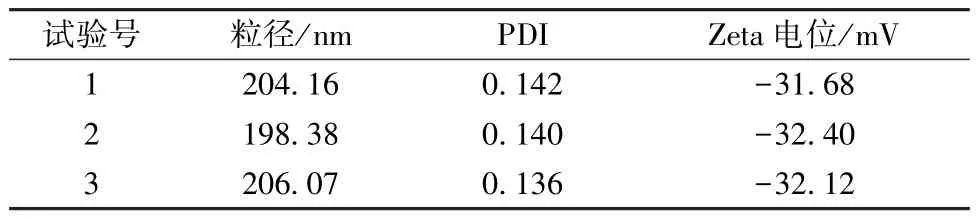
表1 验证试验结果(n=3)Tab.1 Results of verification tests (n=3)
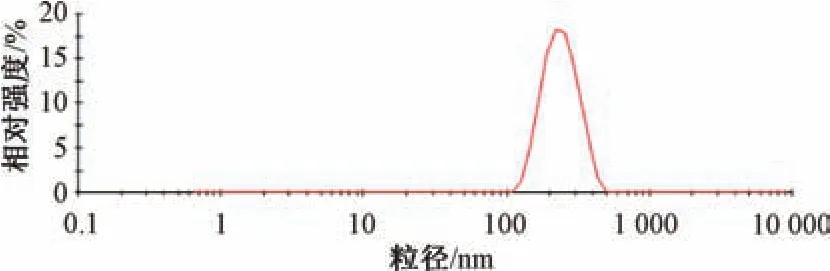
图4 葫芦素B 纳米混悬剂粒径分布Fig.4 Particle size distribution of cucurbitacin B nanosuspensions

图5 葫芦素B 纳米混悬剂Zeta 电位Fig.5 Zeta potential of cucurbitacin B nanosuspensions
2.6 形态观察 取纳米混悬剂0.1 mL,加入5 mL蒸馏水混匀,取T 型支架,覆以铜胶带,冲洗3次,滴2 滴稀释后的纳米混悬剂,自然晾干,置于离子溅射仪中喷溅60 s,在扫描电镜(放大50 000倍)下观察形态,结果见图6。由此可知,纳米粒呈类球形或椭圆形,无粘连。

图6 葫芦素B 纳米混悬剂扫描电镜图Fig.6 Scanning electron microscopic image of cucurbitacin B nanosuspensions
2.7 纳米混悬剂固化 采用喷雾干燥法。
2.7.1 支撑剂选择 课题组前期考察了乳糖、微粉硅胶、甘露醇,发现乳糖、甘露醇所得喷干产物黏性较大,而微粉硅胶所得喷干产物呈干燥、疏松粉末状态,最终选择其作为支撑剂。
2.7.2 制备工艺、处方筛选 取3 份纳米混悬剂,每份1 000 mL,分别按葫芦素B 与微粉硅胶用量比1 ∶2、1 ∶3、1 ∶4 加入微粉硅胶,充分搅拌后得混悬液,得喷雾干燥参数为泵体积流量4.5 mL/min,进风口温度120 ℃,喷嘴规格型号0.508 mm,出风口温度55 ~65 ℃,氮气体积流量0.5 m3/min,所得喷干产物呈干燥、疏松粉末状态。
取葫芦素B、物理混合物(葫芦素B 与微粉硅胶比例1 ∶3)、葫芦素B 纳米混悬剂喷雾粉适量(葫芦素B 含量均为10 mg),加入5 mL 介质,置于透析袋中(截留分子量8 000 ~12 000 Da),设定溶出介质为1 000 mL 0.5% SDS 溶液,温度为37 ℃,转速为75 r/min,于0.5、1、2、3、4、8、10、12 h 取样,其间及时补液来维持溶出介质总体积不变,过0.45 μm 微孔滤膜,测定累积溶出度,结果见图7。由此可知,葫芦素B、物理混合物12 h 内累积溶出度分别为29.90%、31.21%;葫芦素B 与微粉硅胶用量比为1 ∶2 时,喷雾粉4 h内累积溶出度接近90%,8 h 内基本溶出完毕,两者比例增加至1 ∶3 后3 h 内累积溶出度达95.23%,但增加至1 ∶4 时体外溶出行为无明显变化,最终选择1 ∶3 作为葫芦素B 与微粉硅胶用量比。
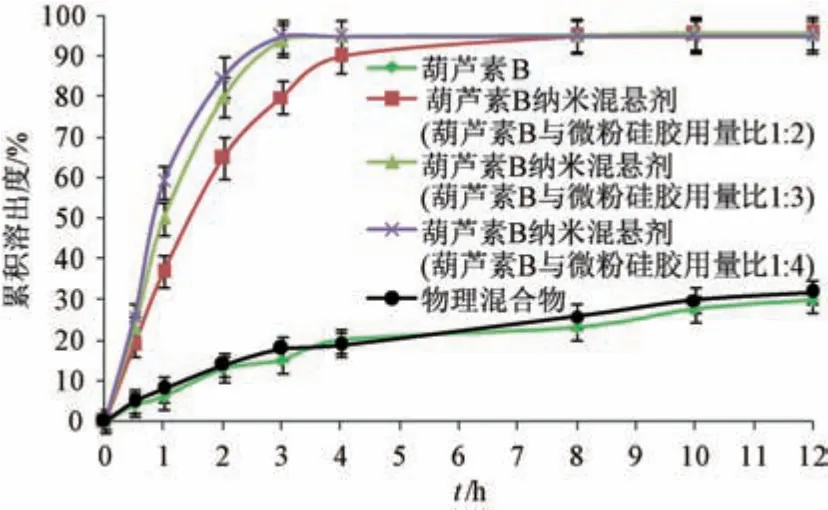
图7 葫芦素B 体外溶出曲线(n=3)Fig.7 In vitro dissolution curves for cucurbitacin B (n=3)
2.8 纳米混悬剂溶解度、质量分数测定
2.8.1 溶解度 取过量葫芦素B、物理混合物[葫芦素B 与辅料(羟丙基纤维素、十二烷基硫酸钠、微粉硅胶)比例同纳米混悬剂喷雾粉]、葫芦素B 纳米混悬剂喷雾粉(葫芦素B 与微粉硅胶用量比1 ∶3),置于10 mL 蒸馏水中,超声处理30 min 至饱和,室温下平衡2 d,取适量混悬液,过0.45 μm 微孔滤膜,测定葫芦素溶解度。结果,三者溶解度分别为44.68、48.07、1.14 mg/mL,即原料药在纳米混悬剂喷雾粉中的溶解度增加至25.5 倍。
2.8.2 质量分数 取纳米混悬剂喷雾粉20 mg,置于100 mL 蒸馏水中,加入50% 乙醇超声溶解,取适量,过0.45 μm 微孔滤膜,取1 mL 续滤液至10 mL 量瓶中,流动相定容,摇匀后测定葫芦素B含量,计算其质量分数。结果,葫芦素B 在纳米混悬剂喷雾粉中的平均质量分数为14.03%。
2.9 晶型分析 取葫芦素B、空白辅料(不加葫芦素B,辅料比例同纳米混悬剂喷雾粉)、物理混合物(葫芦素B+空白辅料)、葫芦素B 纳米混悬剂喷雾粉适量,进行X 射线粉末衍射(XRPD)分析,条件为Cu-Ka 靶,范围(2θ)3°~45°,结果见图8。由此可知,原料药图谱中出现大量晶型峰,表明它是一种晶型物质; 物理混合物图谱中仍可见原料药主要晶型峰,但强度较弱者消失,可能是被辅料掩蔽,表明原料药仍为晶型物质; 纳米混悬剂喷雾粉图谱中仅见辅料晶型峰,而原料药晶型峰全部消失,表明它转变为无定形状态。
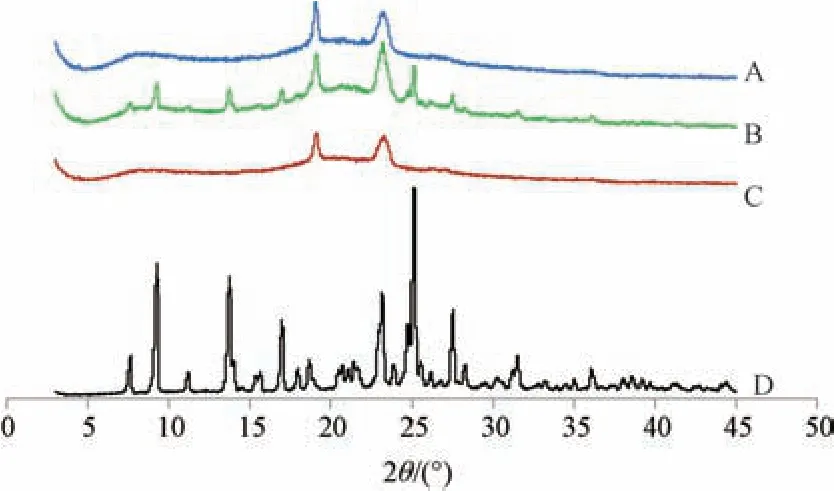
图8 各样品XRPD 图Fig.8 XRPD patterns for various samples
2.10 稳定性考察 取葫芦素B 纳米混悬剂喷雾粉(葫芦素B 与微粉硅胶用量比1 ∶3)适量,密封后置于温度25 ℃、相对湿度60%的恒温恒湿箱中,于0、1、3、6 个月取样,测定累积溶出度,结果见图9。由此可知,纳米混悬剂喷雾粉放置6个月后体外溶出基本无变化,表明其稳定性良好。

图9 不同时间点葫芦素B 纳米混悬剂累积溶出度(n=3)Fig.9 Accumulative dissolution rates of cucurbitacin B nanosuspensions at different time points (n=3)
2.11 体内药动学研究
2.11.1 UPLC-MS/MS 分析条件 参考文献[8]报道,ACQUITY BEH C18色谱柱(2.1 mm×50 mm,1.7 μm); 流动相乙腈-0.1% 甲酸(30 ∶70); 体积流量0.3 mL/min; 柱温30 ℃; 进样量5 μL。电喷雾离子源(ESI); 喷雾电压5 000 V; 离子源温度400 ℃; 气帘气30 psi (1 psi =6.895 kPa); 多反应监测模式(MRM); 检测离子对葫芦素Bm/z581.2~521.3,雌酚酮m/z269.3~145.1。
2.11.2 分组、造模与给药 取葫芦素B、物理混合物(比例同纳米混悬剂喷雾粉)、葫芦素B 纳米混悬剂喷雾粉适量,加入0.5%CMC-Na 溶液制成药液(葫芦素B 质量浓度均为1.5 mg/mL)。取空腹大鼠18 只,随机分为3 组,按10 mg/kg 剂量灌胃给予相应药物,于0.5、1、1.5、2、3、4、6、8、10、12 h 吸入乙醚麻醉,并立即于眼眶后静脉丛采血各约0.25 mL,置于肝素浸润离心管中,振荡混匀后3 000 r/min 离心3 min,取血浆,密封后置于-20 ℃冰箱中。
2.11.3 血浆样品处理 将血浆样品在37 ℃水浴中解冻后取50 μL,置于离心管中,加入40 μL 644 ng/mL 雌酚酮溶液、1 mL 乙腈,涡旋2 min,加入0.5 mL 乙酸乙酯,涡旋2 min,8 000 r/min离心15 min,取上清液,35 ℃氮气吹干,50 μL乙腈复溶,8 000 r/min 离心10 min,取上清液。
2.11.4 线性关系考察 取雌酚酮对照品适量,乙腈制成644 ng/mL 溶液,作为内标溶液。取葫芦素B 对照品,乙腈依次稀释至950、475、237.5、47.5、23.75、9.5 ng/mL,分别取50 μL 至离心管中,35 ℃氮气吹干,50 μL 空白血浆复溶,得质量浓度分别为950、475、237.5、47.5、23.75、9.5 ng/mL 的血浆对照品溶液,按“2.11.3” 项下方法处理,在“2.11.1” 项条件下进样测定。以对照品质量浓度为横坐标(X),对照品、内标峰面积比值为纵坐标 (Y)进行回归,得方程为Y=0.004 1X-0.413 7 (r =0.995 9),在9.5 ~950 ng/mL 范围内线性关系良好。
2.11.5 专属性试验 取空白血浆、血浆对照品溶液(9.5 ng/mL)、给药12 h 血浆样品适量,在“2.11.1” 项条件下进样测定,结果见图10。由此可知,葫芦素B、内标保留时间分别为6.18、8.42 min,不受其他杂质干扰,表明该方法专属性良好。
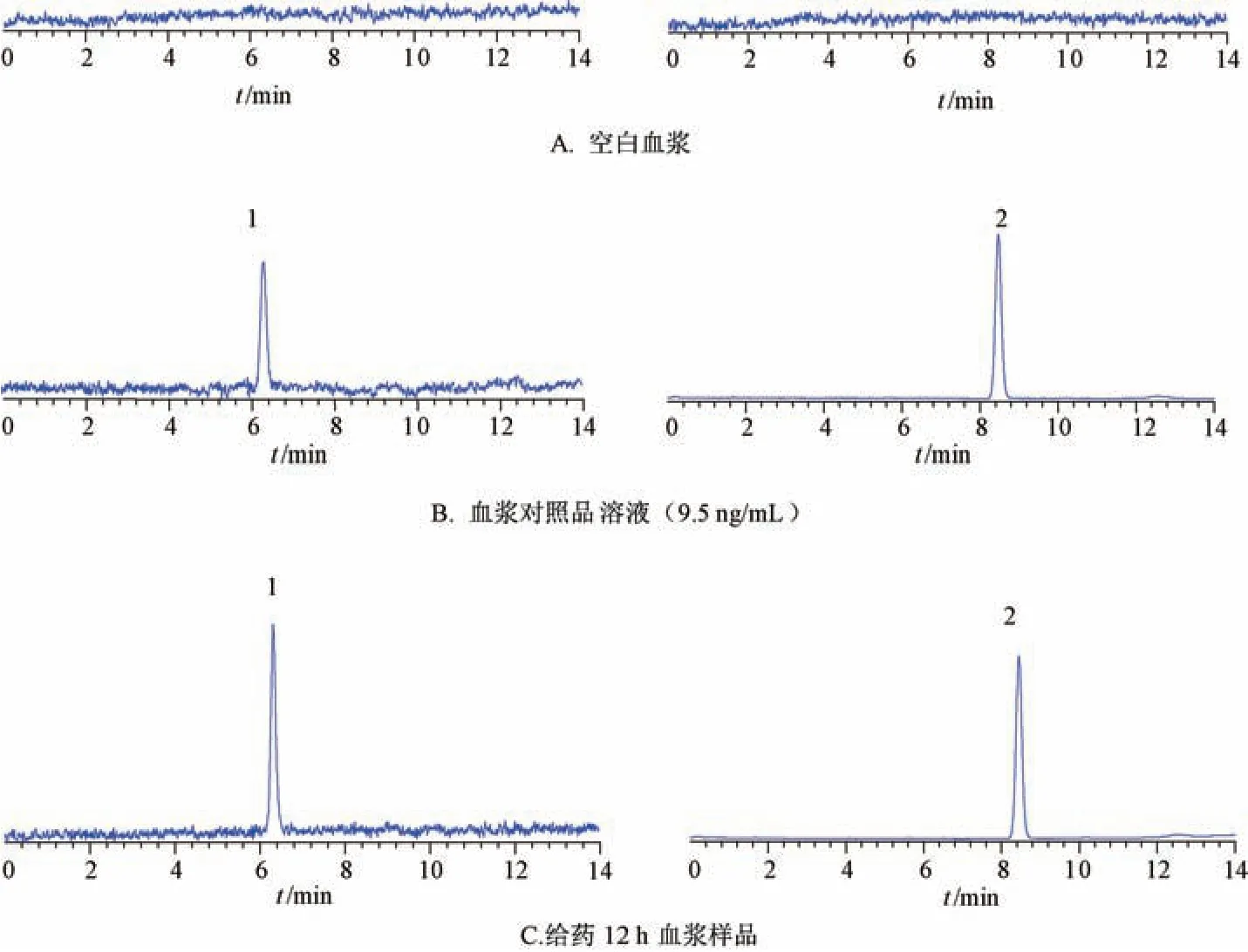
图10 葫芦素B 典型MRM 色谱图Fig.10 Typical MRM chromatograms of cucurbitacin B
2.11.6 方法学考察 取9.5、237.5、950 ng/mL血浆对照品溶液适量,同一天内在“2.11.1” 项条件下进样测定6 次,测得葫芦素B、雌酚酮峰面积比值RSD 分别为2.94%、3.60%、3.97%; 同法测定6 d,每天1 次,测得两者比值RSD 分别为5.65%、4.07%、4.26%,表明该方法日内、日间精密度良好。取给药0.5 h 血浆样品适量,于0、2、4、6、8、12、24 h 在“2.11.1” 项条件下进样测定,测得葫芦素B、雌酚酮峰面积比值RSD为6.04%,表明血浆样品在24 h 内稳定性良好。制备9.5、237.5、950 ng/mL 对照品溶液,在“2.11.1” 项条件下进样测定,计算峰面积A; 取空白血浆50 μL,按“2.11.3” 项下方法处理,平行9 份,得空白基质,分别加入9.5、237.5、950 ng/mL 对照品溶液 (含内标)各50 μL,在“2.11.1” 项条件下进样测定,计算峰面积B,计算提取回收率,公式为提取回收率= (A/B)×100%,另取9.5、237.5、950 ng/mL 对照品溶液(含内标)适量,按“2.11.3” 项下方法处理,在“2.11.1” 项条件下进样测定,计算峰面积C,计算基质效应,公式为基质效应= (B/C)×100%,结果葫芦素B 提取回收率分别为93.69%、96.03%、95.84%,基质效应分别为 96.16%、95.73%、95.91%; 雌酚酮提取回收率为96.96%,基质效应为98.44%,表明基质未对成分测定产生干扰。
2.11.7 结果分析 血药浓度-时间曲线见图11,采用DAS 3.2 软件中的非房室模型计算药动学参数,结果见表2。由此可知,与原料药比较,物理混合物tmax、t1/2、Cmax、AUC0~t、AUC0~∞无明显变化(P>0.05),表明辅料不会显著影响药物吸收;与原料药、物理混合物比较,纳米混悬剂tmax缩短(P<0.01),t1/2延长(P<0.05,P<0.01),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度与原料药相比增加至4.32 倍。
表2 葫芦素B 主要药动学参数(x±s,n=6)Tab.2 Main pharmacokinetic parameters for cucurbitacin B (±s,n=6)
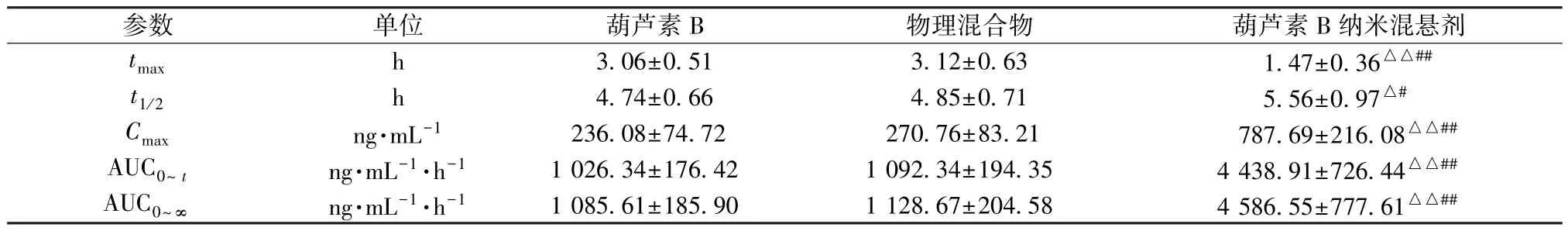
表2 葫芦素B 主要药动学参数(x±s,n=6)Tab.2 Main pharmacokinetic parameters for cucurbitacin B (±s,n=6)
注:与葫芦素B 比较,△P<0.05,△△P<0.01; 与物理混合物比较,#P<0.05,##P<0.01。
参数单位葫芦素B物理混合物葫芦素B 纳米混悬剂tmaxh3.06±0.513.12±0.631.47±0.36△△##t1/2h4.74±0.664.85±0.715.56±0.97△#Cmaxng·mL-1236.08±74.72270.76±83.21787.69±216.08△△##AUC0~tng·mL-1·h-11 026.34±176.421 092.34±194.354 438.91±726.44△△##AUC0~∞ng·mL-1·h-11 085.61±185.901 128.67±204.584 586.55±777.61△△##
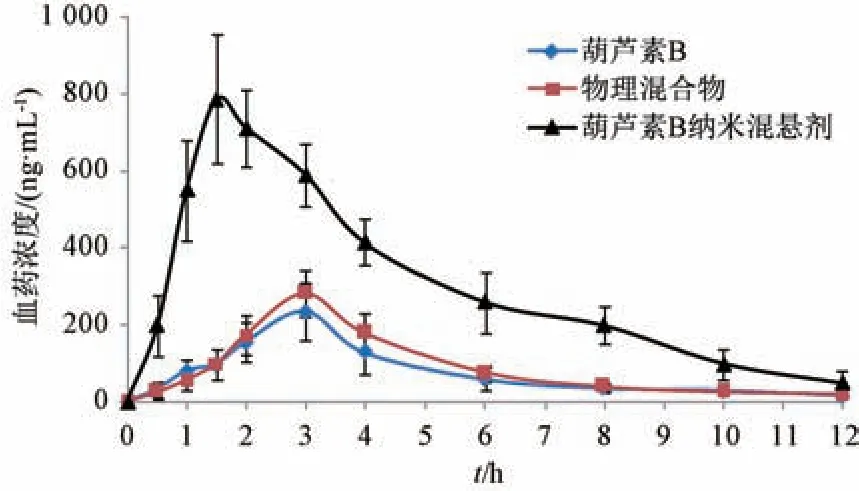
图11 葫芦素B 血药浓度-时间曲线(n=6)Fig.11 Plasma concentration-time curves for cucurbitacin B (n=6)
3 讨论
本实验发现,高压均质后混悬液体系温度较高,故通过快速降温(置于-20 ℃冰箱中)可使纳米粒形态、粒径瞬间变化程度较小,有利于形成粒径均一的葫芦素B 纳米混悬剂[15]。纳米混悬剂固化方法一般是加入冻干保护剂[13-14],但辅料用量较大,成本较高。另外,乳糖、甘露醇容易吸潮,玻璃化温度较低[16],导致喷雾粉黏度较大,而微粉硅胶抗黏性强,支撑效果优异,故本实验以其为支撑剂,大大减少了辅料用量,也便于工业化生产,并且放置6 个月其稳定性仍良好。
溶解度测定结果显示,纳米混悬剂将葫芦素B溶解度增加至25.5 倍,3 h 内后者基本全部溶出,可能与其粒径减小、无定形状态有关[17-18]。体内药动学研究结果显示,葫芦素B 纳米混悬剂t1/2延长,可能是由于纳米药物胃肠道粘附性较强,会对t1/2产生影响[19];tmax提前,可能与原料药在前3 h内溶出速率较快有关,同时其溶解度、累积溶出度大大提高,并转变为无定形状态,使得Cmax、生物利用度提高[20]。
目前,葫芦素B 上市片含量不足0.1 mg/片[21],而按本实验所得最优处方制成相同规格片剂后,微粉硅胶含量不足0.3 mg/片,远低于小于2%的要求[22]。另外,十二烷基硫酸钠口服致死剂量为0.5~5.0 g/kg[21],而制成上述片剂后其含量约为0.15 mg/片,安全边际较高。今后,将对葫芦素B纳米混悬剂喷雾粉片剂制备工艺、质量标准、抗妇科肿瘤药效学等方面展开研究,以期为临床提供新型相关口服制剂。
