高镍正极材料表面锂残渣的研究进展
2024-01-26王盼晴黄彦杰何一芃陈祁恒陈伟豪宁天翔邹康宇李灵均
王盼晴,黄彦杰,何一芃,陈祁恒,尹 提,陈伟豪,谭 磊,宁天翔,邹康宇,李灵均
(1长沙理工大学材料科学与工程学院,2长沙理工大学能源动力与工程学院,湖南 长沙 410000)
随着经济的高速发展和人民生活水平的提高,绿色理念逐渐深入人心,同时,为积极响应国家“碳中和”“碳达峰”的号召,锂离子电池作为环境友好的二次能源和储能技术的关键一环广泛应用在便携产品领域和电动汽车中[1]。目前锂离子电池的电化学性能和成本在很大程度上取决于正极材料[2]。但随着近些年硅碳负极的快速发展,正极材料逐渐成为锂离子电池发展中的短板。高镍层状正极材料具有高比容量、高工作电压及低成本等优点,是最具发展潜力的正极材料之一,备受关注[3]。高镍正极材料中存在由氧离子堆积成具有面心立方结构的框架,过渡金属(TM)离子和锂离子则分布在氧框架的八面体中心,从而构建出正极中独特的过渡金属层和锂层交替堆砌的层状结构。在充放电过程中,锂离子可以沿着二维空间间隙扩散,因此,高镍正极材料具有较高的锂离子迁移率。但高镍层状正极材料存在Li+/Ni2+阳离子混排、过渡金属溶解、不可逆相变、副反应及表面锂残渣等一系列问题,导致其容量衰退、循环性能下降和安全性能差,限制了实际应用[4]。其中,高镍正极材料表面的锂残渣(residual lithium compounds,RLCs)会严重影响电极的制备和电池的电化学性能,加速材料失效,制约其商业化进程。
RLCs 主要由LiOH、LiHCO3和Li2CO3等形式覆盖在高镍正极材料表面,阻碍锂离子运输,导致正极倍率性能下降。此外,RLCs 生成过程中常伴随着水与OH-等的产生,H2O会与有机电解液的锂盐LiPF6反应生成LiF,将导致表面活性物质降解与正极材料可逆容量衰退;而OH-则会攻击电极材料中的聚偏二氟乙烯(PVDF),使其发生严重的结构退化,进而导致正极浆料凝胶化,稳定性及加工性能下降。综上,高镍层状正极材料表面的RLCs将会影响其稳定性、容量及可加工性等一系列性能,甚至会急速加剧正极材料结构的退化,显著影响高镍层状正极材料商业化应用。因此,为进一步优化高镍层状正极材料性能、拓宽其应用领域,亟需一种能够有效消除表面RLCs对正极材料影响的手段。
因此,本工作将对高镍层状正极材料表面RLCs做详细讨论,总结消除其对正极材料影响的方法(图1),并做进一步展望。同时,本文针对RLCs的展望及研究也同样适用于钠离子电池正极材料表面的钠残渣。本文旨在突出RLCs原位再利用在高镍层状正极材料改性研究中的应用潜力,为锂离子电池的研究发展提供新的思路。
图1 本文RLCs相关内容示意图Fig.1 Schematic diagram of RLCs in this paper
1 正极材料表面锂残渣形成机理
RLCs通常被认为是任何剩余的含锂化合物,不属于层状氧化物晶格内部,主要以LiOH、LiHCO3和Li2CO3等形式存在于正极材料表面中,示意图如图2所示[5]。综合来说,RLCs的形成可以分为两个阶段,其中,锂镍混排是导致材料表面RLCs形成的关键因素。①在高温煅烧制备正极材料过程中,镍基正极材料会存在Ni3+向Ni2+的自发转变,同时伴随着氧化物离子的氧化,半径相近的Ni2+会占据锂空位(RLi+=0.076 nm,RNi2+=0.069 nm),诱导晶格Li+脱出形成Li2O,再跟H2O 和CO2反应,形成LiOH 和Li2CO3
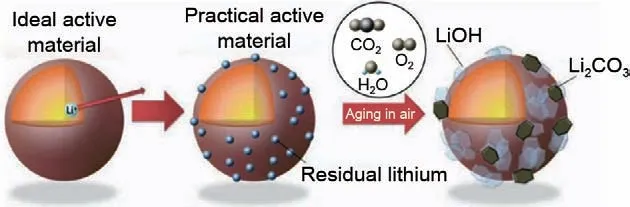
图2 高镍三元正极材料在空气中发生表面反应示意图[5]Fig.2 Surface reaction diagram of high-nickel ternary cathode material in air[5]
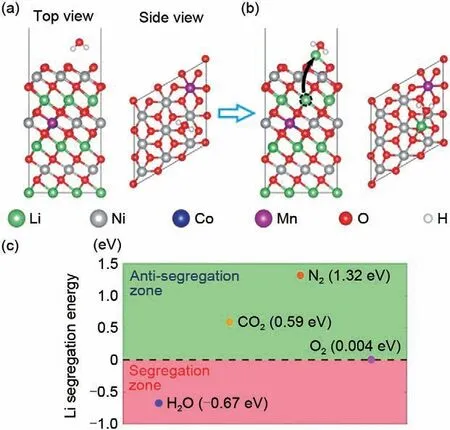
图3 (a),(b) 高镍三元正极材料(NCM)的原子结构和脱锂NCM在气体分子吸附作用下从内部移动到表面3b位点示意图。黑色虚线表示迁移的锂离子,黑色箭头指向次表面锂迁移到的表面位点。(c) H2O、O2、CO2、N2吸附作用下的Li迁移能图[15]Fig.3 (a), (b) Schematic diagram of the atomic structure and delithiated NCM of high-nickel ternary cathode materials (NCM) moving from the interior to the surface 3b site under the adsorption of gas molecules.The black dotted line indicates the migrating lithium ions, and the black arrow points to the surface site to which the subsurface lithium migrates.(c) Li migration energy diagram under H2O, O2, CO2 and N2 adsorption [15]
[6-7],相关反应式为式(1)~(4)。同时,在正极材料制备过程中,常加入过量锂源以弥补高温下锂源挥发造成的损失,而多余部分则以Li2O的形式残留在材料表面,导致材料RLCs 含量增加[2,6]。②当镍基正极材料暴露在空气中时,由于Ni3+的不稳定性,其结晶度也依然会恶化,同时生成LiOH和Li2CO3[8],这种现象普遍存在于所有高镍层状氧化物中。此外,氢氧化锂(无水或水合物)常常作为高镍层状正极材料的锂源,其储存过程中也会逐渐转化为Li2CO3,相关反应式为式(5)~(7)。而Li2CO3等杂质的存在不仅会增加正极材料合成过程中锂残渣的含量,还会降低原料中活性锂源的含量,导致反应不充分,形成缺锂态正极[9-12]。RLCS形成过程相关反应方程式如下[8,12-14]:
此外,Zou 等[15]利用原子级环境透射电子显微镜(ETEM)原位探测正极-空气界面反应的动力学及正极在空气中钝化的原理。结果表明,在水蒸气环境中,Li+离开主体结构进行表面钝化的倾向最强,水蒸气在决定正极-空气界面相关行为中起到了关键作用,即其能为Li+从体相到表面提供足够的驱动力(图2)。同时,最近的一项研究中发现,CO2本身不会导致高镍层状氧化物的降解[14]。在纯二氧化碳气氛中存储的高镍层状氧化物样品的边际重量变化与在干燥环境中存储的样品变化相近也证实了水的存在是Li2CO3形成的先决条件。同时,Sheng等[16]通过CO2气氛处理在高镍正极材料表面引入一层无定形Li2CO3包覆层提升高镍正极材料的结构稳定性,证明适当厚度的Li2CO3涂层可以避免正极材料在空气中降解,改善高镍正极材料固有的不稳定性,使其具有更好的电化学性能。
2 表面锂残渣对正极材料及电池的影响
表界面反应是影响高镍材料性能的重要因素之一。通常,高镍正极材料的表面较为活泼,在材料存储和电极制备的过程中极易发生表面副反应。其中,高镍层状正极材料表面RLCs的存在严重影响电极的制备与电池的电化学性能。具体地,由于RLCs 对水分非常敏感,导致电极浆料、极板、卷芯等部件在电池生产过程中环境湿度要求比较严苛,最终增加设备投入和生产成本[17]。RLCs 对高镍正极材料的影响主要在以下几个方面。
2.1 正极浆液凝胶化
正极浆料一般由活性物质、导电炭黑、聚偏氟乙烯(PVDF)黏结剂和N-甲基-2-吡咯烷酮(NMP)溶剂组成,要求其具有最佳黏度、适当的黏度-剪切速率关系和承受一定的机械应力等性能以满足生产的需要[5,18-19]。其中,PVDF 黏合剂具有很强的抗酸、氧化能力,是电池制造商的典型选择,但其极易发生结构退化,尤其是碱性环境下,其易受强亲核基团的影响[20-22]。而RLCs的生成伴随着OH-的产生,强亲核基团OH-会攻击、诱导PVDF发生脱氢氟化反应,从而生成共轭多烯,而多烯结构由共轭双键组成,更易受到OH-攻击,从而使PVDF发生严重的结构退化,进而导致正极浆料凝胶化。同时,正极液中OH-离子的浓度主要受有机溶剂中LiOH 的解离程度的影响。由于NMP 的吸湿特性,在浆液形成过程中,NMP 中的水浓度会导致LiOH的显著解离,进一步加剧正极浆料凝胶化程度,使其稳定性和加工性下降,影响锂离子电池的装配、长期保存及使用[5]。
2.2 加剧电解液副反应
目前锂离子电池常用电解液组分为1 mol/L 的LiPF6与碳酸甲乙酯(EMC)、碳酸二甲酯(DMC)和碳酸乙烯酯(EC)(体积比为1∶1∶1)混合的有机溶液。研究发现,Li2CO3在DMC和LiPF6的作用下会分解为CO2、LiF 和LiPO2F2[23]。特别是在高压下,Renfrew等[24]发现LIB中产生CO2、CO等气体的主要原因是Li2CO3等表面RLCs 在高压下的分解。因此,材料表面的RLCs会与有机电解液反应,释放出CO2、CO 等气体,并在电极颗粒表面产生不良的LiF沉淀。前者会导致电池膨胀,存在安全隐患,严重影响电池的安全性能;后者将降解材料表面的活性物质,导致材料可逆容量的损失[25-28]。
2.3 阻碍Li+运输
材料颗粒表面的LiOH、Li2CO3及反应产生的LiF 等电导率较低,形成的钝化膜包覆层将抑制锂离子的传输,增大界面阻抗,阻碍了材料的电化学动力学,进而降低了电池的电化学性能[29]。
3 材料表面锂残渣检测方法
由于高镍层状正极材料表面的RLCs 含量对电池浆料制备及电池长期储存、运行都有很大影响,因此在生产过程中快速、准确而简便的RLCs含量检测方法对鉴定高镍正极材料的品质极为重要。
3.1 滴定
目前,鉴于LiOH、Li2CO3在水中具有高溶解度,以质子转移反应为基础的酸碱滴定法一直是电池工业的首选检测手段。该方法可以简单地将正极材料粉末分散于去离子水中,过滤后用酸性水溶液(通常为HCl)滴定滤液,再用Warder 方法确定LiOH、Li2CO3的含量[30],滴定结果可以柱状图形式表示[图4(a)[31]]。酸碱滴定法操作简单,滴定过程可以使用自动滴定仪自动进行,机器计算等当点,也可以通过pH 试剂,如甲基橙和酚酞指示反应过程[32],通过分析滤液pH 和酸性水溶液用量估算RLCs 含量。但Zhou 等[32]认为pH 仅呈现氢氧化锂含量,而不能体现LiOH、Li2CO3的混合含量。同时,由于层状过渡金属氧化物同样分散于去离子水中,部分Li 从活性物质中浸出,以LiOH 的形式存在于滤液中,导致滴定结果偏离实际结果,人为地增加了滤液中的RLCs含量[33-35]。
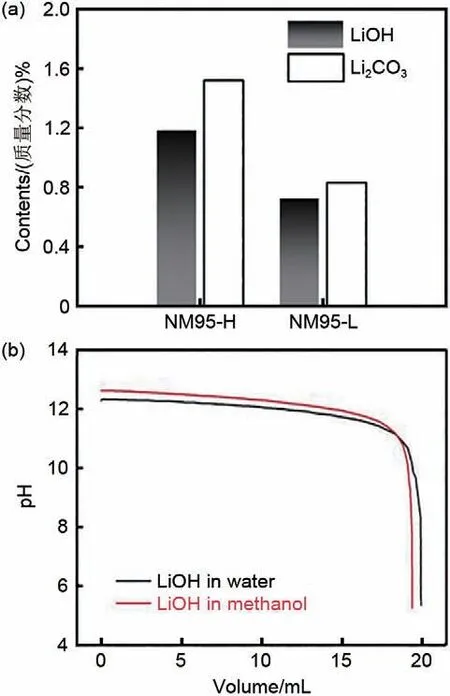
图4 (a) 正极材料锂残渣含量的滴定结果[31];(b) 以水(黑色)和甲醇(红色)为溶剂制备的0.025 mol/L氢氧化锂分析物的滴定曲线[36]Fig.4 (a) Titration results of lithium residue content of cathode materials[31]; (b) Titration curve of 0.025 mol/L lithium hydroxide analyte prepared with water (black)and methanol (red) as solvents[36]
Kim 等[36]以甲醇为溶剂,结合高分辨率扫描透射电子显微镜(HR-STEM)分析,研究了LiOH 含量与NMC91 电极材料Li 浸出之间的相关性。为了验证Li浸出的效果,将溶剂由常规的水改为可以选择性和有效地溶解LiOH 的无水甲醇进行滴定。用HCl 滴定0.025 mol/L LiOH 水溶液和0.025 mol/L LiOH 甲醇溶液,两种溶液的测定结果基本一致,说明用甲醇基溶剂制备分析物的新滴定方法可以准确检测分析物中LiOH含量[图4(b)]。因此,可以将高镍层状正极材料溶解于不会损害高镍正极材料的醇基溶剂中,如无水甲醇或乙醇,再进行滴定检测RLCs含量[37-40]。
3.2 X 射线光电子能谱(XPS)、傅里叶红外光谱(FTIR光谱)及拉曼光谱
除此之外,XPS、FTIR光谱及拉曼光谱等也被用来检测锂残渣含量,以弥补滴定法的不足。X 射线光电子能谱是材料与元器件显微分析中一种对材料损伤非常小的表面分析技术,其不仅可提供总体的化学信息,还能给出表面、微小区域和深度分布方面的信息,目前已被用于识别材料表面的RLCs。在XPS光谱中,有3个与RLCs有关的光谱(C 1s、Li 1s 和O 1s),其中,C 1s 峰为两个主要基团:有机碳基团和无机碳酸盐(—CO3),分别位于288 eV以下和289 eV 以上。有机碳基团(COOH、C=O、C—O和C=C)可能来自不定碳质,而以289 eV 为中心的峰可能与Li2CO3有关。Li 1s 光谱可以与LiNiO2中晶格锂的低结合能组分及LiOH、Li2CO3等表面RLCs 相关联。O 1s光谱显示了RLCs 和晶格氧的比例,可以通过不同峰峰强的对比判断各物质含量的高低[41-42]。如图5(a)和(c)所示,C 1s谱主要由C—C、C—H、C—O和RCO3Li四个峰组成,其中,C—O和RCO3Li来自于充放电过程中电解液分解的副产物。与未改性样品LiNi0.8Co0.15Al0.05O2(NCA)相比,LiTaO3涂层质量分数为3%的NCA 样品(NCALTO 3)中的C-O 和RCO3Li 峰较弱,图5(b)和(d)的O 1s 光谱中也显示改性后的正极材料中Li2CO3峰更弱,共同证明了Ta改性是从抑制电解液分解、表面RLCs形成等方面提升NCA材料电化学性能和结构稳定性[42]。同时,XPS也可以检测钠离子电池正极材料表面钠残渣含量,通过XPS 深度剖面分析,可以综合研究沿厚度方向的钠残渣含量。钠残渣与蚀刻时间的关系如图5(e)和(f)所示,钠离子电池层状正极材料O3-NaNi0.4Cu0.1Mn0.4Ti0.1O2(NCMT)的表面钠残渣含量在130 s后达到稳定,比值为50%,高于2% NaMgPO4修饰的NaNi0.4Cu0.1Mn0.4Ti0.1O2,即NMP@NCMT-2(14.6%)[43]。但XPS图谱中,LiOH和Li2CO3峰存在重叠部分,对XPS 检测数据的可靠性存在一定影响[5]。拉曼光谱和傅里叶红外光谱FTIR 光谱对LiOH 和Li2CO3的区分度比XPS 更高,但其峰强更低。Yang等[44]通过比较Li6.4La3Zr1.4Ta0.6O12(LLZTO)和LiPO2F2处理过的LLZTO(LPF-LLZTO)在拉曼光谱(863 cm-1)和FTIR 光谱(1090 cm-1)处Li2CO3特征峰,从而比较两者在空气中的稳定性[图6(a)、(b)]。Wang等[45]采用FTIR光谱鉴定了TiO2修饰的LiNi0.6Co0.2Mn0.2O2(0.5-NCM@TiO2)在暴露前后可能存在的表面不纯相。如图6(c)和(d)所示,875 cm-1和1460 cm-1处的特征峰与C=O键的伸缩振动有关,而3440 cm-1处的谱带与O—H键振动有关,而C=O 和O—H 的信号分别与Li2CO3和LiOH的表面RLCs相匹配。在此基础上,比拉曼光谱信号更高的使用金属元素进行表面增强拉曼光谱(SERS)可作为拉曼光谱的替代方案[5]。此外,通过X 射线吸收谱(XAS)也可以看到Li2CO3的特征峰,或许也可以通过此特征峰区别来区分LiOH和Li2CO3[41]。
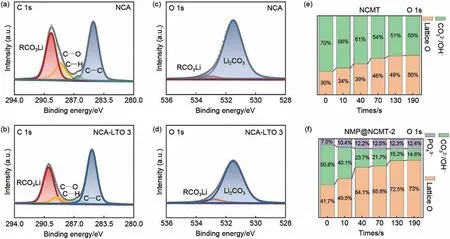
图5 NCA和NCA-LTO 3在1 C,3~4.3 V下循环200圈后表面的C 1s [(a),(b)]和O 1s [(c),(d)]的XPS光谱[42];[(e),(f)] NCMT和NMP@NCMT-2表面钠残渣和晶格氧与蚀刻时间比率[43]Fig.5 XPS spectra of C 1s [(a), (b)] and O 1s [(c), (d)] on the surface after 200 cycles of NCA and NCA-LTO 3 at 1 C, 3—4.3 V[42]; [(e), (f)] Ratio of sodium residue and lattice oxygen to etching time on NCMT and NMP@NCMT-2 surfaces[43]
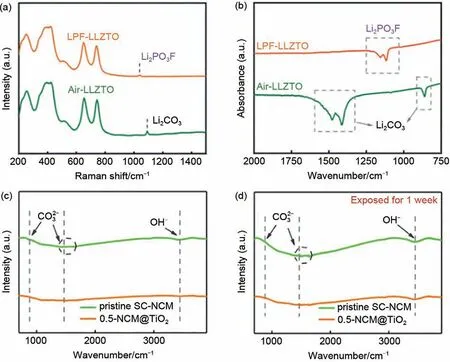
图6 (a) LLZTO和LPF-LLZTO的拉曼光谱;(b) LLZTO、Air-LLZTO和LPF-LLZTO的FTIR光谱[44];(c), (d) 原始SC-NCM和0.5-NCM@TiO2的FTIR光谱[45]Fig.6 (a) Raman spectra of LLZTO and LPF-LLZTO; (b) FTIR spectra of LLZTO, Air-LLZTO and LPF-LLZTO[44];(c), (d) FTIR spectra of raw SC-NCM and 0.5-NCM@TiO2[45]
3.3 飞行时间二次离子质谱(TOF-SIMS)、固态核磁共振(ssNMR)及热重分析结合质谱(TGA-MS)
近年来,在检测RLCs 含量方面,引入了既能区分残留的锂化合物,又能提供极好灵敏度的复杂技术,如TOF-SIMS、ssNMR及TGA-MS等。TOFSIMS是一种用于获取锂离子电池中元素或分子种类的化学信息的表面分析技术,离子利用率很高,能实现对样品几乎无损的静态分析,获得具有代表性的二次离子物种的深度分布[46]。通过TOF-SIMS可以显示二次离子LiCO3-的浓度随溅射时间的变化曲线,表明Li2CO3的分布随距离表面深度的变化。如图7(a),显示了F、Sb 共同改性的LiNi0.93Co0.03Mn0.03Al0.01O2(F-Sb-NCMA93)中LiCO3-浓度随着溅射时间增加而减少,表明这些物质集中在约10 nm的二次颗粒表面[47]。而ssNMR研究通过LiOH和Li2CO3具有明显区别的化学位移,从而很好地区分LiOH 和Li2CO3[图7(b)][48]。此外,TGA-MS 是利用热力学特点区分锂基化合物的特殊工具。由于LiOH和Li2CO3的熔点分别为471 ℃和723 ℃,具有较大差异,因此,可以通过TGA-MS显著区分高镍层状氧化物中的LiOH和Li2CO3。Luo等[49]发现LiOH和Li2CO3与硼酸加热条件下反应形成Li2B4O7的TG-DSC曲线具有明显差异,Li2CO3与硼酸反应的DSC曲线中有4个明显的吸热峰,其中温度最高的吸热峰为610.30 ℃,实际减重43.873%,接近理论值46.171%;而LiOH 的DSC曲线的最终吸热峰出现在467.82 ℃,当温度达到490.75 ℃时,实际减重为42.852%,比理论减重低4.902%,且重量不随温度的升高而变化[图7(c)和(d)]。
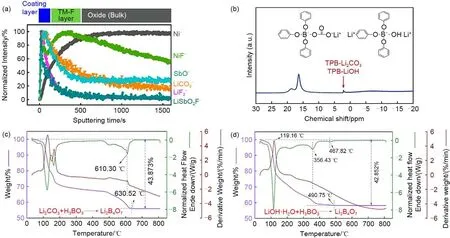
图7 (a) F-Sb-NCMA93中的代表性物种的归一化深度轮廓[47];(b) 在TPB、LiOH和Li2CO3之间的化学反应完成后,对上清液的11B NMR分析[48];(c), (d) Li2CO3与硼酸、LiOH与硼酸反应形成的四硼酸盐锂的TG-DSC曲线[49]Fig.7 (a) normalized depth profile of representative species in F-Sb-NCMA93[47]; (b) 11B NMR analysis of the supernatant after the completion of the chemical reaction between TPB, LiOH and Li2CO3[48]; TG-DSC curve of lithium tetraborate formed by the reaction of (c), (d) Li2CO3 with boric acid and LiOH with boric acid[49]
开发一种能够简便且准确定量分析正极材料中RLCs 的检测方法仍然是一项具有重大影响力的工作。上述的方法在用标准样品校准后均可用于定量分析,但其中仍然存在一些问题。XPS、拉曼光谱和FTIR光谱需要解决Li2CO3和LiOH区分或灵敏度差的问题,而表面灵敏度强的TOF-SIMS 校准过程极其困难。相比之下,NMR 和TGA-MS 具有更大的开发应用前景,其中,TGA-MS 对校准方法的要求更低,更适于进一步发展。同时,当通过除TGA-MS 外的方法对材料表面RLCs 定量分析时,由于其本质上是通过测定特殊化学键和组合方式对红外光等的吸收情况或X射线、一次离子等轰击样品表面激发出的光电子、二次离子等的能量、飞行时间等信息,进而得到材料近表面信息,样品表面光洁度、原子浓度和标样选取等对结果存在影响。一般来说得到的是检测样品中RLCs 的相对含量,而不是绝对含量。对于TGA-MS,在高镍层状正极材料中,准确区分RLCs 中Li2CO3和LiOH 分别与硼酸反应的起始温度和终止温度,并由此计算RLCs 各部分含量存在一定难度,因此,这些方法的准确度都达不到实际应用的标准,都无法代替滴定法。
4 消除表面锂残渣影响的手段
材料表面RLCs 的产生对高镍正极材料粉末储存、浆料制备和电化学性能等有显著的影响,研究者们采取了各种手段来降低这种影响,提高高镍正极材料的空气稳定性和储存性能。目前常见的手段有水洗退火结合工艺、二次烧结、使用电解液添加剂、表面涂层、掺杂及设计梯度结构材料等[50],本文按照锂残渣是否去除将消除材料表面锂残渣影响手段分为覆盖、去除及再利用三类。此外,通过掺杂等手段,可以降低锂镍混排程度,减少RLCs产生,从而降低RLCs的影响。
4.1 去除
将材料表面可溶性RLCs 通过溶液洗涤的方式去除,主要包括去离子水洗涤、醇洗(主要是无水乙醇)等,同时,通过二次烧结或构建包覆层的方式修复或保护洗涤过程中受损的材料表面[51]。去离子水洗涤是目前去除高镍层状正极材料表面RLCs工业化程度最高、应用最广的方法之一,洗涤除碱流程如图8所示。在洗涤过程中,水料比例、搅拌时间、搅拌频率/速率、洗涤次数、洗涤温度等因素都会影响水洗的效果,其中,水料比例为主要影响因素。此外,邵佳伟[52]对高镍层状正极材料水洗后干燥过程及其装置进行研究,设计生产了一套振动干燥设备系统,以干燥后的含水率、颗粒粒度为评价标准对其进行正交实验分析。综合分析得到最佳振动干燥的工艺参数为50%的装填率,4%的振动幅度,20 Hz的振动频率及140 ℃的导热油温度干燥120 min。其中,不同干燥方法也会影响水洗后高镍正极材料的性能。如图9(a)~(c)所示,与传统回转干燥方式相比,新型振动干燥在相同干燥时间后材料含水量更低;粒度测试中D50分布较大也更加接近于原料,这说明了振动干燥后正极材料颗粒破碎现象更少。组装电池测试后其电化学性能也优于传统方式干燥的正极材料。但在表面RLCs去除的同时,内部晶格锂也会溶解于溶剂中,加速结构中Li+流失,导致材料晶体结构的坍塌,从而导致材料热稳定性和电化学性能急剧衰退。同时,水洗后的材料表面更易受空气中H2O和CO2侵蚀,空气敏感性增加,进而导致材料结构从层状到尖晶石、类NiO 相的转化[53-54]。因此,在去除正极材料表面RLCs 的前提下,减轻水洗对材料结构及综合性能影响的同时合理优化去离子水洗涤工艺是当前的研究重点[29]。
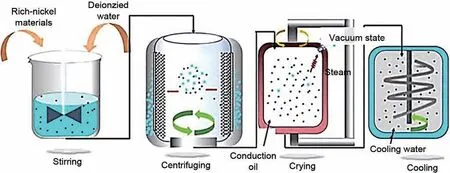
图8 去离子水洗涤除碱流程图[28]Fig.8 Flow chart of deionized water washing and alkali removal[28]
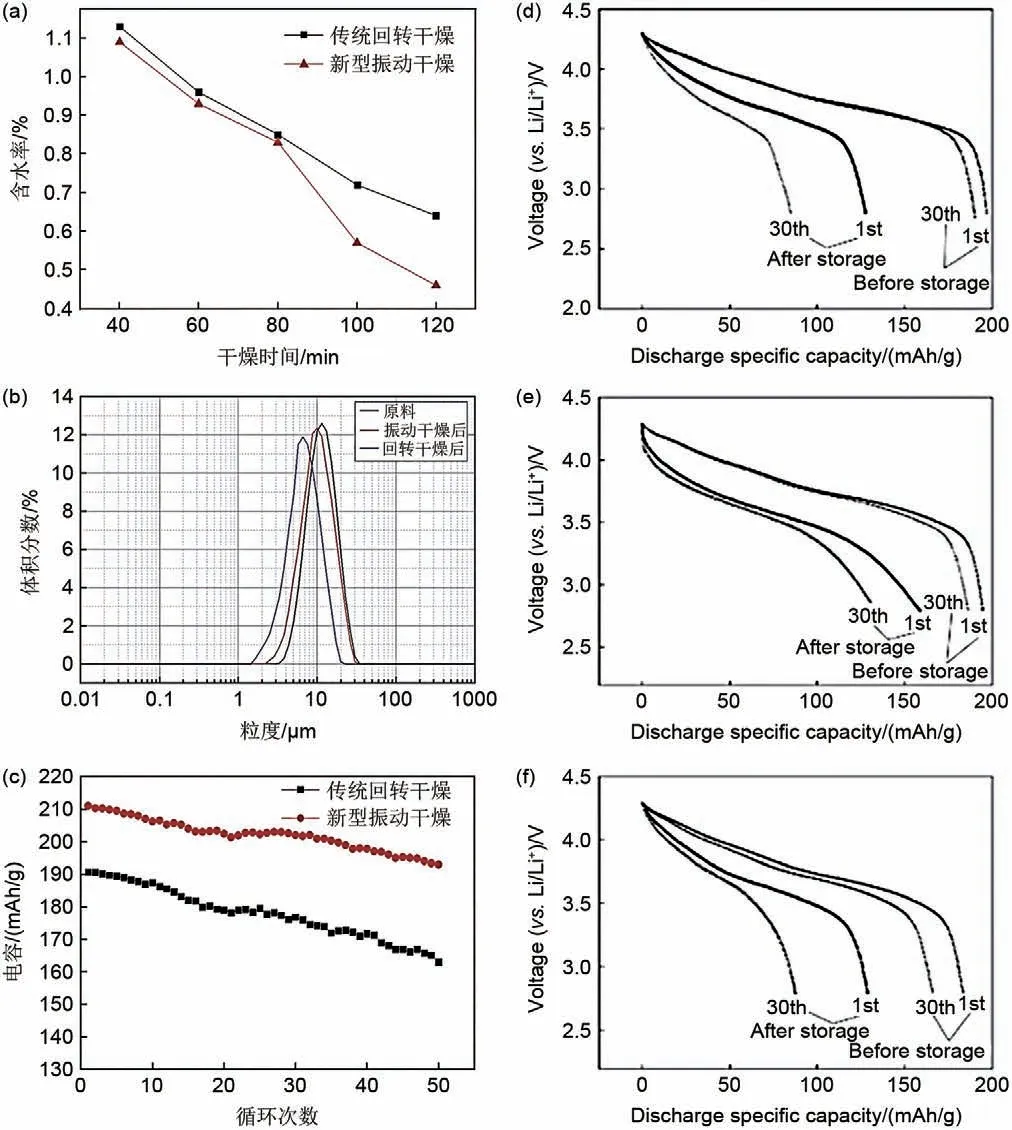
图9 (a)~(c)两种方法干燥后正极材料的干燥时间、粒度及电化学性能对比[52];(d) 新制备样品F;(e) 乙醇洗涤两次的样品EF2;(f) 先在空气中放置1 d再用乙醇洗涤两次的样品ES2在空气中保存3个月前后的第一、三十条放电曲线[55]Fig.9 (a)—(c) Comparison of drying time, particle size and electrochemical performance of cathode materials after drying by the two methods[52]; (d) Newly prepared sample F, (e) sample EF2 washed twice with ethanol,(f) sample ES2 first placed in air for 1 d and then washed twice with ethanol stored in air for 3 months before and after the first and thirtieth discharge curves[55]
选取无水乙醇作为溶剂洗涤去除高镍正极材料表面RLCs,其原理是利用LiOH微溶于无水乙醇和Li2CO3不溶的特性,选择性去除材料表面LiOH,同时减少Li2CO3的形成,而适当厚度的Li2CO3可以在去除RLCs 的同时,避免正极材料结构的退化,减轻洗涤对正极材料结构、稳定性及电化学性能的影响[13,28]。Liu 等[55]用无水乙醇溶剂洗涤LiNi0.8Co0.15Al0.05O2正极材料。结果表明,乙醇洗涤可以有效去除新制备的LiNi0.8Co0.15Al0.05O2上的LiOH/Li2O 合成残留物,在不破坏其体积结构、表面形貌和电化学性能的情况下,提高样品的抗H2O和CO2能力。此外,乙醇洗涤后的LiNi0.8Co0.15Al0.05O2在相对湿度为80%的空气中贮存3个月后的放电比容量和循环性能也优于未处理正极材料[图9(d)~(f)]。但单一醇溶液洗涤并不能完全去除高镍层状正极材料表面RLCs,对正极材料电化学性能提高有限,且材料表面Li2CO3在充放电循环过程中仍会导致电池胀气,安全隐患依然存在。
此外,还可以利用酸碱中和反应去除材料表面RLCs,如磷酸、稀硫酸和硼酸等[56]。Wu 等[57]还提出一种弱酸醇洗工艺,采用弱酸硼酸作为刻蚀液,在不破坏正极材料有序层状结构的同时去除表面RLCs 和岩盐相,导通锂离子在正极材料和电解液界面处的传输通道,同时减少电极材料表面和电解液之间的副反应,从而提高材料的放电比容量及容量保持率。
特别地,Li 等[51]通过饱和Li2CO3溶液选择性地去除表面RLCs中的LiOH,抑制晶格Li的溶解。同时,为了进一步提升洗涤后正极材料的表面稳定性,洗涤时加入LiH2PO4作为洗涤助剂,在材料表面构建具有高稳定性的保护性磷酸盐涂层,有效提高了正极材料的电化学稳定性。
4.2 物理包覆
通过在高镍层状正极材料表面构建人工保护层,即通过物理或低温处理(<500 ℃)的方法构建涂层,隔绝RLCs 与电解液和PVDF,减少接触,从而消除表面RLCs对正极材料的影响。研究者们采取了多种手段在材料表面构建保护层,上文提到的常见消除RLCs影响的手段中表面涂层、掺杂、使用电解液添加大多是在正极材料表面构建人工保护层,通过隔绝正极材料与电解液、空气中的水分接触减少RLCs 对高镍正极材料的影响。Neudeck 等[58]在LiNi0.8Co0.1Mn0.1O2(NCM811)表面构建Al2O3保护层,能够同时起到减少表面吸湿、防止电解液腐蚀的作用。同样地,在高镍正极材料表面构建Ni3(PO4)2-Li3PO4涂层也能起到相似的作用[59]。传统锂惰性金属氧化物(SiO2[60],ZrO2[61],TiO2[62-63]),磷酸盐(FePO4[64],Li3PO4[51])和氟化物(LiF[65],AlF3[66-67],PrF3[68])能够覆盖在RLCs 表面,有效抑制电极与电解液[69]之间的副反应,同时,涂层作为物理屏障,能够隔离HF腐蚀,缓解过渡金属的溶解。部分表面改性示意图如图10 所示,图10(a)中,反应器中NCM 颗粒完全暴露在空气中,H2O 蒸汽与气化气体Ar2一起引入反应器,并与表面羟基进行自限化学吸附,然后注入气态的TiCl4,TiCl4与H2O发生相互作用,分子中的氯原子逐步被羟基取代。水解结束时,TiO2在颗粒表面非均相成核,并快速聚集生长,形成表面均匀包覆的TiO2,紧密附着在颗粒表面将容量保持率从89.08%提高到95.89%[63]。在图10(b)中,Li等[68]通过湿化学原位沉积法将PrF3包覆在LiNi0.8Co0.1Mn0.1O2颗粒上。PrF3涂层有效地将活性物质和电解液与HF腐蚀隔离,同时减少长时间循环过程中表面微裂纹的产生。此外,作为一种物理屏障,PrF3在很大程度上缓解了电解液中过渡金属的溶解。结果表明,PrF3涂层可以大大提高NCM811在高压下的稳定性[图10(c)]。但该类涂层大多为锂惰性涂层,离子电导率低,影响锂离子的传输,导致电池倍率性能下降。使用Li2TiO3[70]等含锂金属氧化物或导电性好的金属氧化物作为正极涂层,不仅可以抑制界面副反应,消除RLCs 对高镍正极材料的影响,还能通过促进锂离子传输,从而克服表面涂层的影响进一步提升锂离子电池的倍率性能。但其在RLCs 和含氢氟酸的电解液液体环境中并不能保持电化学稳定性及化学稳定性。
此外,也可以通过采用电解液添加剂在正极材料表面构建高离子导电性和良好化学稳定性、电化学稳定性的理想CEI 膜,避免RLCs 与电解液直接接触,从而降低RLCs 对高镍正极材料的影响[71]。Wu 等[72]选择树枝状介孔二氧化硅(DMS)作为电解液添加剂,使CEI 膜自发脱氟,形成LiPO2F2,原位形成增强电子和锂离子扩散的抗氟保护层,避免RLCs与电解液直接接触,抑制界面副反应。DMS添加剂在高镍层状正极材料中可能保护机理如图11所示,最初,DMS 均匀地沉积在正极表面上,在正极材料和电解液之间形成物理屏障,同时由于SiO2的组成而增强了电解液的阻燃性。在长期循环过程中,一方面,DMS和HF之间的氟化反应可以产生新的CEI 层组合物(由SiOxFy组成),然后可以作为抗氟化层以防止进一步的酸腐蚀。这意味着只要HF存在,CEI层中的SiOxFy含量就会不断增加,直到达到动态平衡,即CEI 层实时对HF 腐蚀的抵抗力就会越来越强,从而很好地达成隔绝正极与电解液的作用,同时,也避免了与表面RLCs有关的副反应出现。
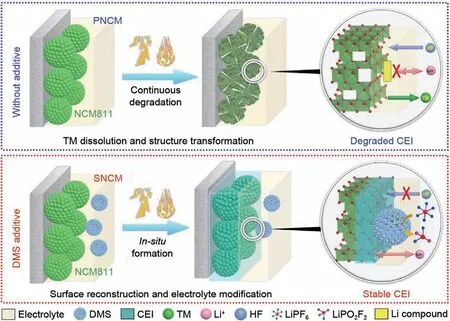
图11 DMS添加剂在高镍层状正极材料中可能保护机理示意图[72]Fig.11 Schematic diagram of the possible protection mechanism of DMS additives in high-nickel layered cathode materials[72]
4.3 原位再利用
利用RLCs 特性对材料表面的RLCs 再利用,即以RLCs 为原料原位合成涂层,消除RLCs 对高镍层状正极材料的影响,延缓结构退化与材料失效,提升材料性能,同时,构建表面涂层,保护材料结构,减少电解液与正极材料之间的接触,抑制副反应,延长了电池的使用寿命,促进高镍层状正极材料及以锂离子电池为核心的新能源汽车商业化的蓬勃发展[73-80]。
Zhu 等[81]采用湿涂敷法和热处理法制备了由RLCs 与(NH4)2HPO4反 应 形 成 的Li3PO4修 饰 的LiNi0.8Co0.1Mn0.1O2(NCM811)正极材料,示意图如图12(a)所示。去除RLCs 后,促进了锂离子的扩散,降低电解液中HF和H2O的含量,抑制电解液与活性物质之间的有害副反应,从而提升了倍率性能和循环性能,如图12(b)~(e)所示。RLCs除去后,不论是1 C下,还是高倍率、高温模式下,NCM811正极材料的循环稳定性都显著提升。同时,NCM811正极材料在不同倍率下的放电比容量也更稳定。Li等[2]采用原位水解-缩合法在NCM811 表面制备聚硅氧烷(EPS)涂层,利用高温反应诱导RLCs与EPS发生反应,生成Li2SiO3包覆层,示意图如图13(a)所示,同时实现RLCs 的去除和构建表面包覆层的目的,保护材料结构,稳定表面相变,从而获得优异的容量保持率(1 C 下,循环100 圈后容量保持率为92.0%)和优异的倍率性能(10 C 时,放电比容量为131.1 mAh/g),有效提高锂离子电池正极材料的电化学性能[图13(b)~(e)]。
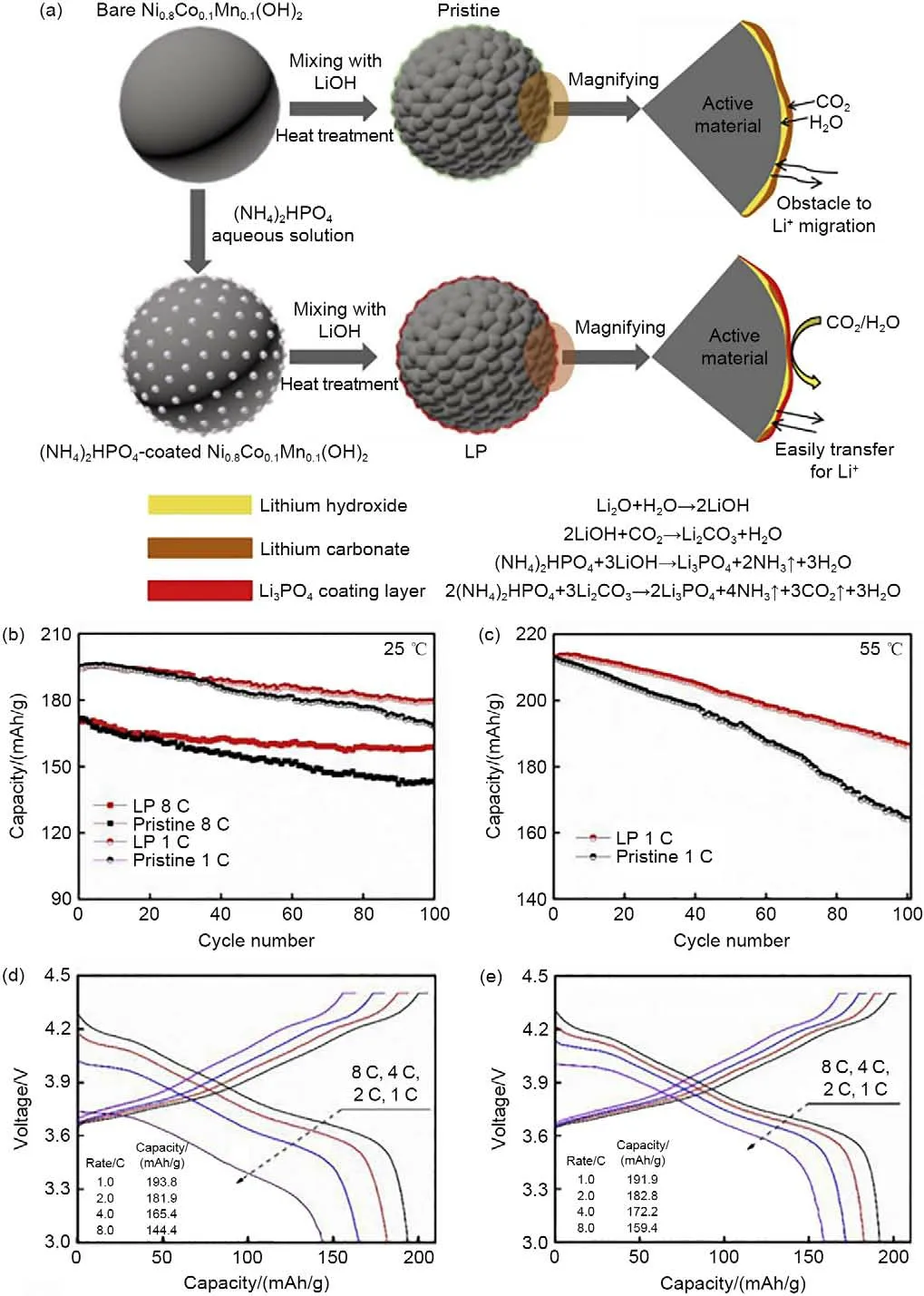
图12 原始样品与Li3PO4修饰的NCM811正极材料(LP) (a) 表面化学反应示意图;在 (b) 1 C和8 C和 (c) 1 C,55 ℃和3.0~4.4 V电压范围内的循环性能;(d) 原始样品和 (e) 改性样品的倍率性能[81]Fig.12 Schematic diagram of the surface chemical reaction between the original sample and the Li3PO4-modified NCM811 cathode material (LP) (a); Cycling performance in the (b) 1 C and 8 C and (c) 1 C, 55 ℃ and 3.0—4.4 V voltage ranges; (d) Rate performance of the original sample and (e) the modified sample[81]
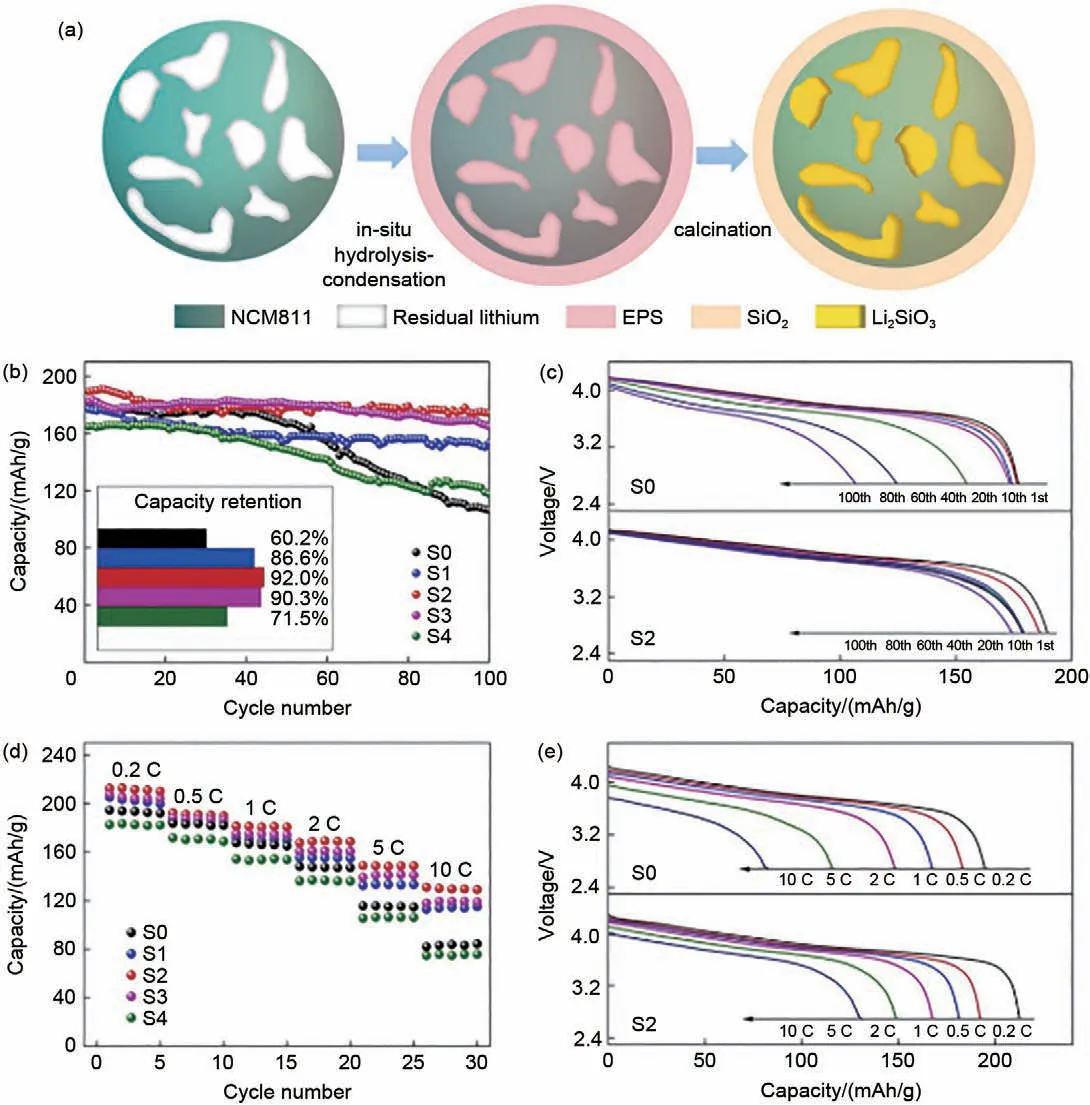
图13 (a) SiO2-Li2SiO3包覆NCM811的合成工艺示意图;S0-S4样品在(b)、(c) 1 C和25 ℃下的循环性能,(d)、(e) 不同电流密度下的倍率性能,S0为未改性对比样,S1~S4分别表示不同LiOH含量(1.07%,1.09%,1.11%和1.13%)和EPS改性的NCMDis811正极材料[2]Fig.13 (a) Schematic diagram of the synthesis process of SiO2-Li2SiO3 coated NCM811; Cycling performance of S0—S4 samples at (b), (c) 1 C and 25 ℃; Rate performance at (d), (e) different current densities, S0—S4 indicates unmodified, different LiOH content (1.07%, 1.09%, 1.11% and 1.13%) and EPS-modified NCM811 cathode material[2]
Luo 等[49]通过硼酸与材料表面RLCs 在650 ℃下反应转化为四硼酸锂Li2B4O7,从而制备了四硼酸锂包覆和硼掺杂的高镍低钴LiNi0.925Co0.03Mn0.045O2正极材料[图14(a)]。如图14(b)~(e)所示,在55 ℃的温度下,改性样品循环性能显著提升,在100次循环后的循环保留率为72.86%,而NCM 原样的循环保留率为59.65%。同时,材料表面RLCs 的去除和快离子导体涂层的构建有效提升了锂离子扩散能力,改性后NCM 快速充放电能力也明显优于原样。
Zhang等[42]采用高温固相法对NCA进行了LiTaO3涂层和Ta5+掺杂的双重改性[图15(a)]。该改性通过消耗材料表面RLCs 形成涂层,这不仅减少了RLCs 的有害影响,还构建了坚固的Li+导电涂层,有效抑制了表面副反应和不良相变,极大地促进了锂离子的扩散,显著增强其倍率性能。Lv等[82]通过煅烧均匀混合的Ni0.85Mn0.09Al0.06(OH)2、LiOH·H2O和In2O5Sn 合成改性正极,记为InSn-NMA85。其中,In2O5Sn中的In2O3与RLCs中LiOH反应,在材料表面形成了LiInO2层[83]。此外,In 和Sn 通过高温煅烧掺杂进入正极晶格,在InSn-NMA85中分布良好[图15(b)]。双元素掺杂与原位诱导的LiInO2界面相协同延长了高镍无钴正极材料在高压(≥4.5 V)和高温(≥45 ℃)下的循环寿命。
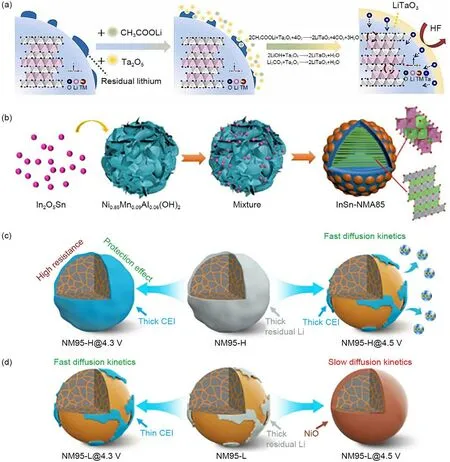
图15 (a) NCA-LTO3反应过程的示意图[42];(b) InSn-NMA85的合成路线示意图[82];(c) 表面RLCs含量高的LiNi0.95Mn0.05O2(NM95-H)和 (d) RLCs含量低的LiNi0.95Mn0.05O2 (NM95-L)正极在2.7~4.3 V以及2.7~4.5 V活化后RLCs变化示意图[31]Fig.15 (a) Schematic diagram of the NCA-LTO3 reaction process[42]; (b) schematic diagram of the synthetic route of InSn-NMA85[82]; (c) Schematic diagram of the change of RLCs after activation of LiNi0.95Mn0.05O2(NM95-H) and (d) LiNi0.95Mn0.05O2 (NM95-L) cathode with low RLCs content at 2.7—4.3 V and 2.7—4.5 V with high surface RLCs content[31]
此外,Yim 等[48]通过双功能添加剂硼酸三苯酯(TPB)中缺电子B选择性地与高镍正极材料的RLCs相结合,去除表面RLCs,有效降低了电池内压。同时,TPB 通过电化学反应在电极表面形成有效的正极/电解液界面(CEI)层,大大提高了高镍正极的表面稳定性。同时,Wang 等[31]发现材料表面RLCs 在4.3 V 截止电压下可以转变为CEI 膜,均匀覆盖在材料表面,防止电解液攻击正极材料,抑制副反应,从而提高高镍氧化物正极的循环稳定性[图15(c)和(d)]。
除了以RLCs 为原料原位构建表面涂层外,Fan等[84]还利用RLCs溶于水的特性,设计出一种简单高效且环保的方法成功将正极材料与铝箔分离,无需使用有机溶剂,也不会导致二次污染[图16(a)]。作者选择水作为分离介质进行正极与铝箔的剥离。当电极浸入水中时,由于压实密度降低,孔隙率增加,水分子更容易渗透到废电极中。在颗粒表面的RLCs被溶解后,由于电极的致密结构,可以在集电极与活性材料颗粒接触的界面处形成高碱性环境。铝箔上钝化层(Al2O3)倾向于与碱反应生成可溶解的LiAlO2,从而削弱了活性材料与集流器之间的附着力[85]。此外,在碱性环境中很容易触发PVDF失活,由PVDF膨胀和集流器腐蚀组成的电极内部环境破坏将促进活性物质与铝箔分离过程。同时,从图16(b)~(g)水处理前后的光学照片及SEM 图可以看出回收的铝箔保持完整,可以直接重复使用,实现闭环回收。通过剥离试验进一步表征了水处理后电极片界面附着力的变化。在相同的拉伸速度下,测试相同尺寸的电极片的拉伸力。如图16(h)所示,处理后和未处理的电极片的平均剥离强度分别为57.76 和246.03 N/m。显然,水浸后分离正极材料和铝箔所需的剥离强度远小于未处理电极片所需的剥离强度,水处理后更易实现铝箔的回收。
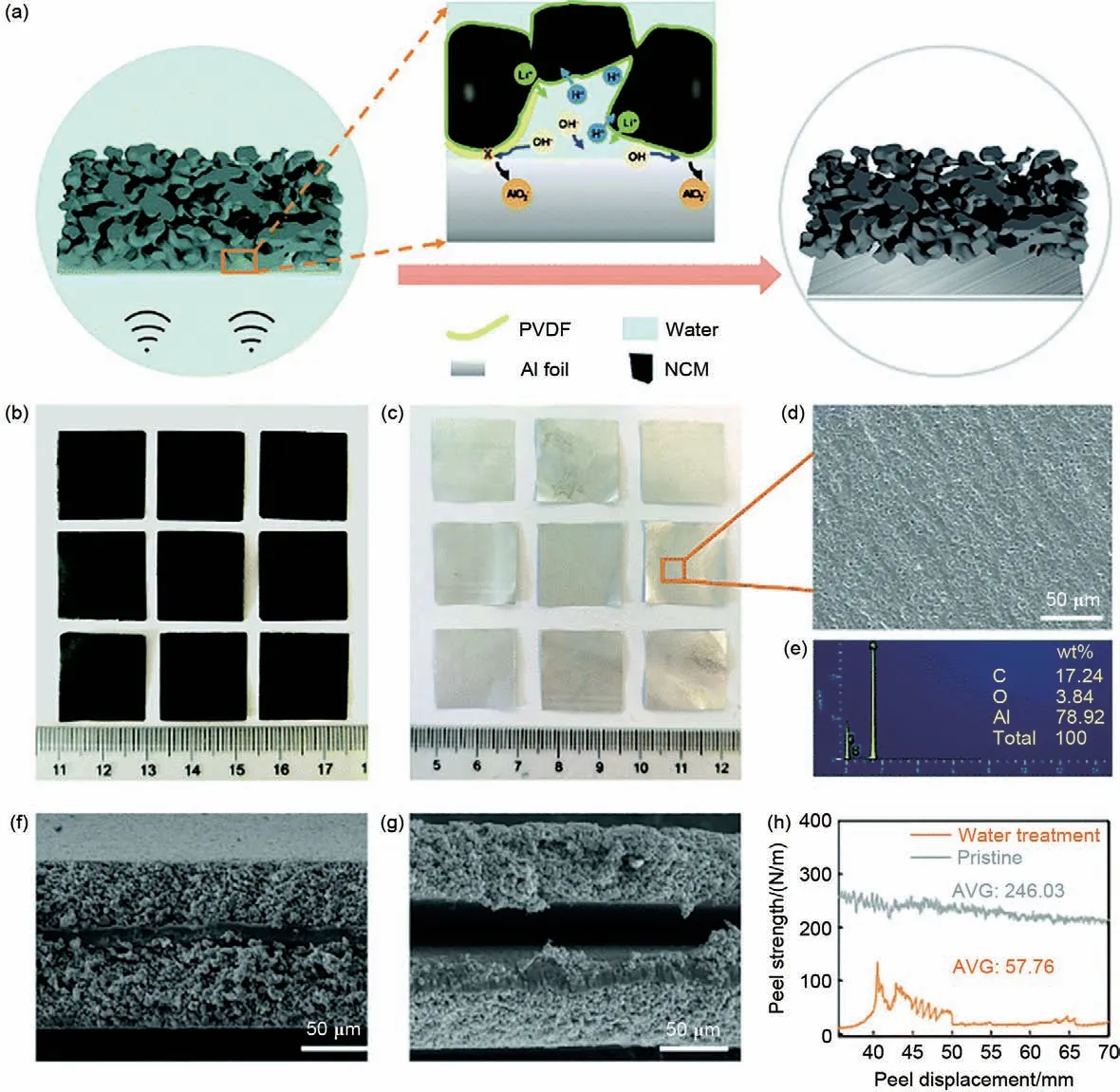
图16 分离过程和结果的说明 (a) 分离过程的示意图和可能的分离机制,分离后尺寸为2 cm×2 cm的 (b) 降解电极片和(c) 铝箔的光学照片;(d) SEM图像和 (e) 分离的铝箔的映射结果;水处理前 (f) 和 (g)水处理后电极的扫描电镜图像;(h) 水处理前后各电极的剥落强度[84]Fig.16 Description of the separation process and results (a) Schematic diagram of the separation process and possible separation mechanisms, optical photograph of (b) degraded electrode sheet and (c) aluminum foil with a size of 2 cm×2 cm after separation; (d) Mapping results of SEM images and (e) separated aluminum foil;Scanning electron microscopy images of electrodes before (f) and (g) before water treatment; (h) Flowering strength of each electrode before and after water treatment[84]
在烧结过程中,挥发的Na+也会在正极表面沉积,在钠离子电池层状正极材料(NCMT)上形成钠残渣(NaOH/Na2CO3/NaHCO3),导致严重的界面反应和性能衰退。Xu 等[43]利用Mg(CH3COO)2、磷酸与表面钠残渣反应生成NaMgPO4(NMP),形成的NaMgPO4作为一种特殊的表面离子导电性通道,改善了电极反应动力学,显著提高了改性正极在高电流密度下的倍率性能。组装以NMP@NCMT-2为正极和硬碳(HC)为负极的扣式全电池,评估正极材料在1.5~4.3 V 高电流密度下的长期循环稳定性,进而评估其商业可行性。钠离子电池的示意图如图17(a)所示。半电池中正极和负极的独立电压分布如图17(b)所示。NMP@NCMT-2//HC 全电池的初始库仑效率(CE)高达85.8%,可逆比容量为157.3 mAh/g(基于正极质量),能量密度为316 Wh/kg(基于总质量)。经过300 次循环后,在1.2 C 下,全电池的容量保持为初始容量的70%左右,CE值均高于99.8% [图17(d)]。此外,NMP@NCMT-2全电池的性能超过了NCMT全电池,并且在倍率性能、放电容量和容量保持方面优于大多数先前报道的正极层材料[图17(e)]。这种优异的电化学性能极大促进了NMP@NCMT-2 全电池在钠离子电池大规模储能体系中的应用。
5 总结与展望
本文综述了高镍层状正极材料表面RLCs 形成原理、对正极材料及电池的影响及检测方法,重点探讨了消除RLCs 影响的手段、策略,包括RLCs的覆盖、去除及再利用。不同手段在不同程度上可提高高镍层状正极材料的综合性能,但仍然存在一些问题。在材料表面RLCs上构建人工保护层,可有效提升材料的循环性能和安全性能,但钝化保护层的厚度和对锂离子扩散的影响难以调控;用去离子水、无水乙醇等溶液洗涤正极材料,可以去除大部分RLCs,但需要后续退火处理或表面包覆等方式修复或保护洗涤后高空气敏感性的材料表面,同时,在退火过程中,还需要添加锂源以补充洗涤过程损失的锂,这些大大增加了材料制备成本,并使制备过程复杂化[86]。对于高镍正极材料,处理表面RLCs 的理想策略是去除RLCs,同时在材料表面构建锂导电层,隔开活性材料与电解液,但不阻碍锂离子在活性材料与电解液之间的传输。以RLCs为原料原位合成保护层有望实现上述目标,并已经在高镍层状正极材料的改性中取得广泛应用。但在构建保护涂层时,除了需要考虑其对锂离子扩散的影响外,后续还需要考虑在含氢氟酸的电解液液体环境中,保护涂层能否保持良好的电化学稳定性及化学稳定性。可以从电解液方面着手,设计一款与正极材料副反应少且在电池循环过程中能与RLCs反应原位形成均匀保护涂层的电解液,从而减少表面RLCs对高镍正极材料的影响。
同时,目前已有的表面RLCs 检测手段仍存在一些问题。工业中应用最广的酸碱滴定法仍会受到Li浸出和pH主要体现RLCs中LiOH含量的影响,改用甲醇等作为溶剂进行滴定测试可减少Li浸出对测试结果的影响,但其对Li2CO3的检测精度仍需进一步测试。XPS、拉曼光谱、FTIR光谱、TOF-SIMS、NMR 和TGA-MS 具有更大的开发应用前景,除了之前提到过的灵敏度、校准等问题外,对材料表面RLCs 含量的检测及检测的准确度仍需优化,仍需进一步开发能够简便且准确定量分析正极材料中RLCs 的检测方法,也可以考虑多种检测方法共同使用,协同准确检测材料表面锂残渣的存在及含量,如通过甲醇滴定材料RLCs 中LiOH 含量,再结合材料在不同温度下与硼酸的反应确定LiOH 和Li2CO3含量,并检测甲醇滴定结果的准确性。
此外,其他材料,如含钠层状正极材料和富锂材料,也会遇到表面空气不稳定等问题,导致颗粒表面Na/Li残渣形成和pH升高。同时,对于含钠层状正极材料,还会发生水嵌入或Na+/H+交换,从而破坏层状结构,这些变化还会引发浆液碱化、脱气和电解液分解等问题。本文中锂离子电池中高镍层状正极材料表面RLCs的处理经验可以指导含钠层状正极材料和富锂材料的进一步提升、优化,如通过消耗材料表面钠/锂残渣构建原位涂层,保护材料结构。同时,也突出了锂残渣原位再利用在高镍层状正极材料改性研究中的应用潜力,借助材料表面RLCs可以更好地实现表面包覆、双重修饰等包覆层的均匀沉积,为锂离子电池的研究发展提供新的思路。
